
- •Лекция №12 Молекулярная физика и термодинамика
- •12.1. Система, параметры состояния, равновесное состояние и процесс, закон Авогадро, уравнение Клайперона-Менделеева.
- •12.2. Парциальное давление в газах
- •12.3. Внутренняя энергия.
- •12.4. Экспериментальные подтверждения молекулярно-кинетической теории
Лекция №12 Молекулярная физика и термодинамика
Система, параметры состояния, равновесное состояние и процесс, закон Авогадро, уравнение Клайперона-Менделеева, закон Дальтона, внутренняя энергия газа. Экспериментальные подтверждения молекулярно-кинетической теории.
12.1. Система, параметры состояния, равновесное состояние и процесс, закон Авогадро, уравнение Клайперона-Менделеева.
Молекулярная физика представляет собой раздел физики, изучающий свойства вещества, исходя из молекулярно кинетических представлений. В качестве объекта исследования молекулярная физика рассматривает идеальный газ. Считается, что газ состоит из отдельных молекул, которые можно представить в виде упругих шариков находящихся в постоянном беспорядочном хаотичном движении. Интенсивность этого движения зависит от температуры газа. Доказательством этого утверждения служит Броуновское движение частиц.
Молекулярно кинетическая теория ставит себе целью объяснения свойства тел наблюдаемых непосредственно в опытах (давление, объем, температура), как суммарный результат действия молекул составляющих физическое тело. При этом используется статистический метод, при котором интересуются не движением отдельных молекул, а средними величинами, которые характеризуют движение совокупности большого числа молекул. Отсюда проистекает другое название этой науки - Статистическая физика.
Изучением свойств тел и состояний вещества занимается так же наука Термодинамика. В отличие от молекулярно кинетической теории термодинамика изучает макроскопические свойства тел и явлений природы, не интересуясь их микроскопическим строением. В основе термодинамики лежат несколько фундаментальных законов природы (называемых началами термодинамики). Начала сформулированы путем обобщения коллосального количества опытных фактов и поэтому выводы термодинамики имеют весьма общий характер. Однако надо помнить, что законы классической термодинамики сформулированы для равновесных процессов и поэтому имеют ограничения в их применимости к реальным физическим процессам.
Рассматривая изменения состояния вещества с различных точек зрения, молекулярно кинетическая теория и термодинамика, взаимно дополняя друг-друга, образуют единую науку.
Для характеристики массы атомов и молекул используются величины, получившие название относительной атомной массы элемента (Аr – отношение массы атома к 1/12 массы атома углерода С12) и относительной молекулярной массы (Мr – отношение массы молекулы к 1/12 массы атома углерода С12) . Таким образом атомные и молекулярные массы вещества есть величины безразмерные. Величина 1/12 С12 называется атомной еденицей массы me и измеряется в кг.
Колличетво вещества в котором содержится число частиц равное числу атомов в 0,012 кг С12 называется молем.
Число частиц содержащихся в 1 моле вещества неизменно и равно числу Авогадро NA=6,022 1023 1/моль
Массу моля называют молярной массой μ = NA Мr me me=1,66 10-27кг
Таки образом, масса моля выраженная в граммах численно равна относительной молекулярной массе.
Системой тел или просто СИСТЕМОЙ будем называть совокупность рассматриваемых тел. Примером может служить жидкость и находящийся над ней пар. Системой может являться и одно тело, например газ.
Всякая система может находиться в различных состояниях отличающихся параметрами состояния. Такими как например Р, Т, V и т.д. Не всегда параметры системы имеют определенные значения. Например, температура или давление в различных частях системы может быть не одинакова. В этом случае состояние системы называют неравновесным. Если тело изолировать и предоставить самому себе, то со временем температура (давление) во всем объеме выровняются. Система перейдет в равновесное состояние и для того, чтобы изменить это состояние необходимо внешнее воздействие на систему.
Процесс самопроизвольного перехода системы из неравновесного состояния в равновесное называется релаксацией, а время этого перехода называется временем релаксации. За это время параметры системы принимают единое значение для всего объема системы.
Равновесным состоянием системы называют такое состояние при котором параметры системы без внешнего воздействия остаются постоянными сколь угодно долго .
Если рассмотреть пространство (оно называется фазовым пространством), где по координатным осям отложены параметры состояния, то равновесное состояние будет обозначаться точкой. Неравновесный процесс будет характеризоваться уже линией, так как хотя бы один из параметров системы претерпевает изменения, последовательно проходя через ряд промежуточных состояний. Рис 12.1
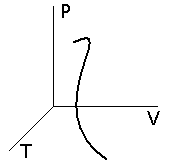
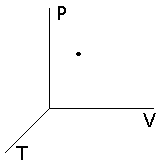
Рис.12.1
Если процесс изменения параметров достаточно медленный, такой что параметры меняются как бы сразу во всем объеме, то каждое промежуточное состояние можно рассматривать, как квазиравновесное. Поэтому такой процесс можно рассматривать, как последовательность равновесных состояний.
Процесс, состоящий из непрерывной последовательности равновесных состояний, называется равновесным или квазистатическим.
Равновесный процесс может быть проведен в обратном направлении при этом система будет последовательно проходить через те же состояния, но в обратной последовательности. Поэтому равновесные процессы называют обратимыми. Такой процесс в фазовом пространстве параметров системы изображается кривой.
Некоторые процессы при которых система после ряда изменений возвращается в исходное состояние называются круговыми или циклами. Графически такой процесс изображается замкнутой кривой (Рис.12.2)
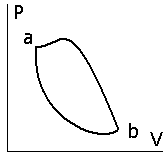
Рис.12.2
Все количественные выводы классической термодинамики с которой мы будем знакомиться строго применимы лишь к равновесным процессам.
Рассмотрим некоторый объем газа определяемый параметрами P,V,T. Эти параметры закономерно связаны друг с другом, так, что изменение одного из них влечет изменение других F(P,V,T)=0
Простешими свойствами обладает газ взаимодействие между молекулами которого пренебрежимл мало. Такой газ называется идеальным. По свойствам близки к идеальным газам легкие газы такие как водород, гелий, даже воздух и разреженные газы..
При небольших плотностях газы хорошо подчиняются закону PV/T=const.
Это уравнение состояния идеального газа. Авогадро установил, что при t = 00С и Р=1атм моль любого газа занимает объем 22,4литра. Отсюда для одного моля газа можно найти константу в уравнении состояния идеального газа
const = P0 Vм/T0=R= 8,31 дж/моль К
Таким образом, для произвольной массы газа уравнение состояния можно записать как:
УРАВНЕНИЕ КЛАЙПЕРОНА-МЕНДЕЛЕЕВА PV = (m/μ)RT
Придадим уравнению другой вид. Введем величину k= R/NA
(K =1,38 10-23дж/К – постоянная Больцмана) и ν = m/μ
Уравнение примет вид PV= ν NA kT учитывая, что ν NA=N и N/V=n получим Р= nkТ, где n – число молекул в единице объема газа.
Более детально рассмотрим строение газа.
Плотность газов при нормальных условиях почти в 1000 раз меньше чем у жидкостей. Отсюда следует, что молекулы в газах сильно разрежены, поэтому они слабо взаимодействуют и этим можно пренебречь. Однако молекулы, находясь в беспорядочном движении сталкиваются со стенками сосуда и изредка между собой, поэтому достаточно хорошо подходит модель упругих столкновений.
Рассмотрим кубический сосуд с газом (Рис.12.3). Сторона сосуда пусть будет Δl
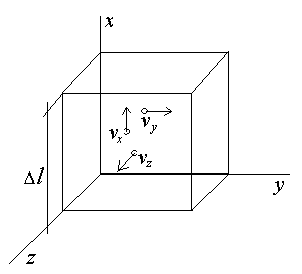
Рис.12.3
Газ находящийся в сосуде представляет совокупность большого количества беспорядочно движущихся упругих шаров. Если молекул в объеме достаточно много, то с большой степенью точности можно полагать, что 1/3 шаров движется вдоль оси Х, 1/3 движется вдоль У и 1/3 движется вдоль оси Z. Молекула летящая перпендикулярно стенке после упругого удара отскочит от него, после этого импульс молекуды изменится на 2mv. На стенку в этот момент будет действовать сила Δf = 2mv/t.
Молекула отразится от стенки пролетит через весь объем отразится от противоположной стенки и повторно ударится в стенку через время равное 2 Δl/v. Поэтому для определения средней силы воздействия на стенку объема подставим это время в формулу для силы Δfср= mv2/ Δl. При этом полная сила воздействия на одну стенку ( с учетом того, что на нее воздействует только 1/3 всех молекул) определится как
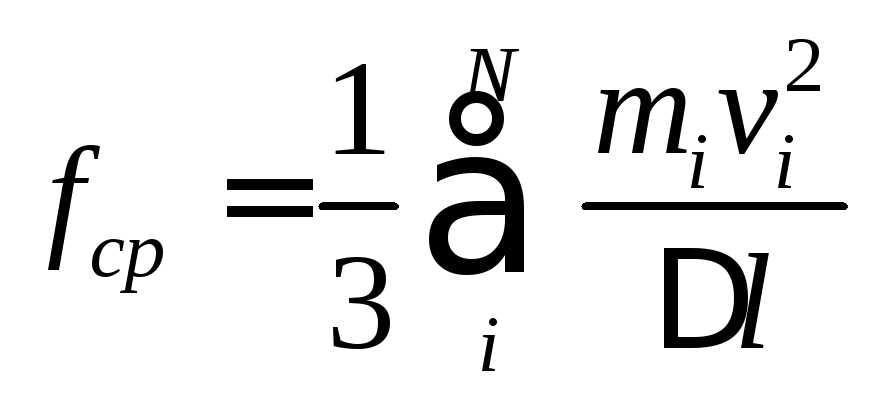
Вынесем за знак суммы m умножим, разделим на N, а обе части равенства разделим на Δl2.
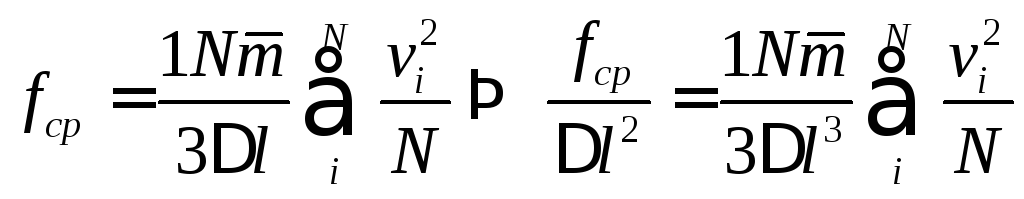

Учитывая, что
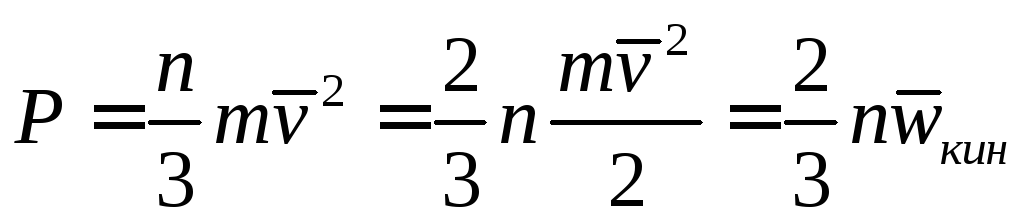
получим
В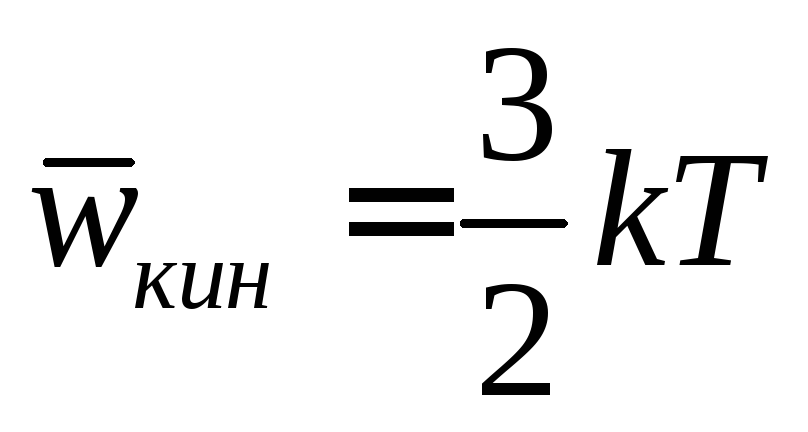 спомним,
чтоP=nkT
и сравнивая
с полученной формулой видим, что средняя
кинетическая энергия одной молекулы
равна
спомним,
чтоP=nkT
и сравнивая
с полученной формулой видим, что средняя
кинетическая энергия одной молекулы
равна
