
Desktop_1 / Лекции 1 симестр / МОЛФИЗИКА15
.docЛекция №15
Молекулярная физика и термодинамика
Уравнение адиабаты, политропические процессы, работа совершаемая идеальным газом при различных процессах, Ван-дер-ваальсовский газ. Внутренняя энергия Ван-дер-ваальсовского газа
15.1. Уравнение адиабаты
В ходе какого либо прцесса газ кроме основного уравнения состояния (уравнение Клайперона-Менделеева) подчиняется дополнительному условию определяемому характером процесса. Так например в ходе изобарического процесса для идеального газа выполняется условие Р=const или, что соответствует V/T=const, в ходе изохорического процесса V=const (P/T=const). При изотермическом процессе T =const (PV=const).
PV=const называется уравнением изотермы идеального газа, а кривая определяемая этим уравнением называется изотермой.
Адиабатическим
называется процесс без притока и отвода
тепла во вне. Найдем уравнение связывающие
параметры идеального газа при
адиабатическом процессе. Возьмем
уравнение первого начала термодинамики
![]() и
подставим в него выражение для для
внутренней энергии и работы совершаемой
газом.
и
подставим в него выражение для для
внутренней энергии и работы совершаемой
газом.
![]()
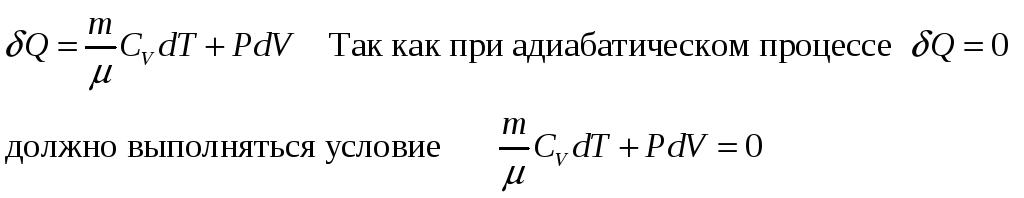
Выразим Р через V и T, используя уравнение Клайперона-Менделеева.
![]()
![]()
Подставим это выражение в условие и получим
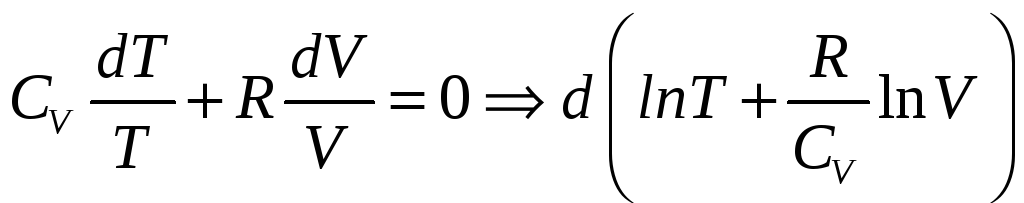
Преобразуя получим:
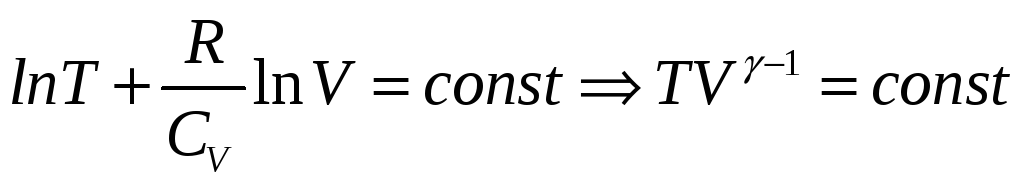
Отсюда следует
Где γ = Ср/СV
Это уравнение адиабаты идеального газа в переменных T, V. Мы можем перейти к уравнению в переменных Р,V. Заменим в нем Т выраженным из уравнения Клайперона-Менделеева.
![]()
Подставим это выражение в уравнение адиабаты и получим (Рис.15.1):
![]()

Рис.15.1
15.2. Политропические процессы
Политропическими процессами назыаются процессы, при которых теплоемкость тела остается постоянной. С=const.
Получим уравнение политропы для идеального газа. Запишем первое начало термодинамики для одного моля газа, представив Q в виде CdT а dU – в виде CVdT
![]()
Возьмем уравнение состояния для одного моля идеального газа и возьмем дифференциал от обеих частей уравнения
![]()
И![]() сключим
из этих двух уравнений dT
и произведя
приведение подобных членов получим:
сключим
из этих двух уравнений dT
и произведя
приведение подобных членов получим:
Учитывая, что CV+R=Cp и разделив уравнение на PV получим
![]()
Интегрирование этого уравнения приводит к соотношению
![]()
Разделим это равенство на (C- CV) и обозначим n=(C- Cp)/ (C- CV)после чего потенцированием уравнения получим уравнение политропы
![]()
Где n-показатель политропы
![]()
При C= CV легко видеть, что выполняется условие
Что означает постоянство объема при совершении процесса. Так как при этом показатель политропы равен бесконечности, политропический процесс с n= является изохорическим. При n=0 уравнение политропы вырождается в Р=const и процесс является изобарическим. При n=1 уравнение политропы превращается в уравнение для изобарического процесса РV=const, а при n=γ становится уравнением адиабаты РVγ=const. Из выражения для определения показателя политропы можно получить формулу для теплоемкости идеального газа
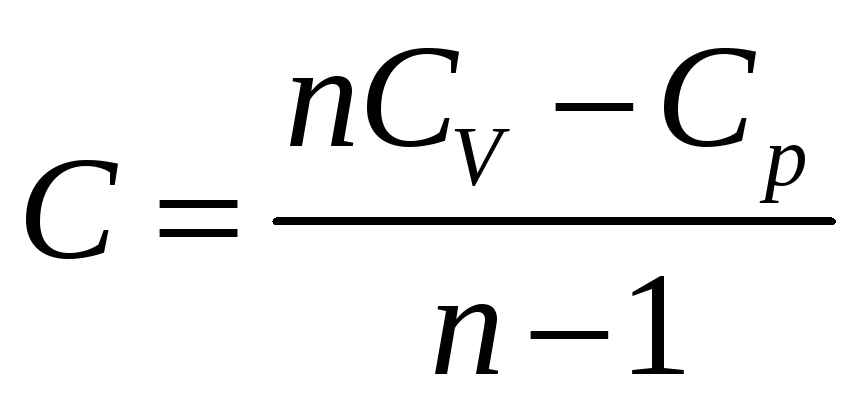
Подстановка n=γ делает теплоемкость С =0 ,а подстановка n=1 делает С =.
Таким образом при адиабатическом процессе, когда нет обмена теплом с внешней средой, теплоемкость системы равна 0, а при изотермическом процессе теплоемкость равна бесконечности.
Таким образом политропические процессы в зависимости от показателя политропы подразделяются следующим образом:
Процесс n
Изобарический 0
Изотермический 1
Адиабатический γ
Изохорический
15.3. Работа совершаемая идеальным газом при различных процессах
Работа совершаемая каким либо телом над внешними телами при переходе из состояния 1 в состояние2 равна

Д![]() ля
нахождения интеграла воспользуемся
уравнением политропы , которое можно
записать как:
ля
нахождения интеграла воспользуемся
уравнением политропы , которое можно
записать как:
Отсюда P=P1V1n/Vn подставляя это выражение под знак интеграла и получим

Е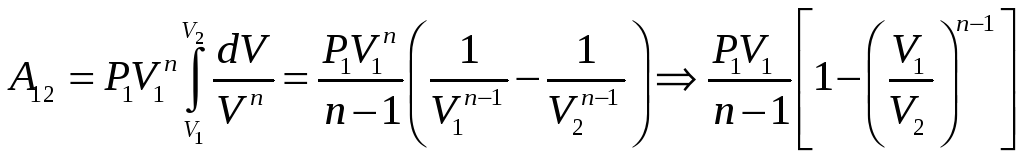 сли
n1,
то
сли
n1,
то
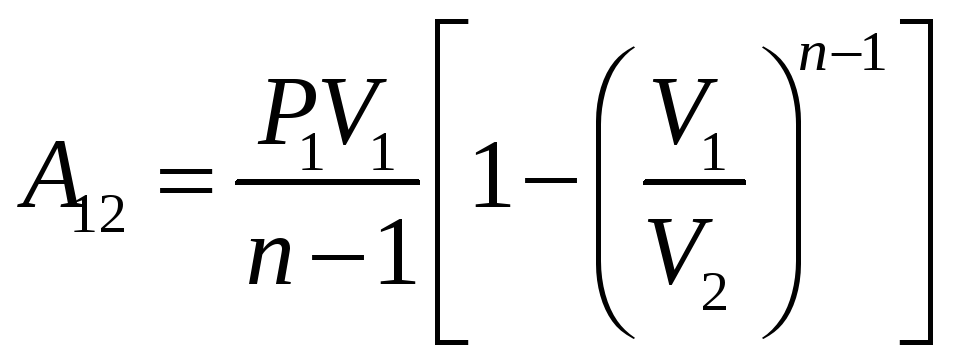
Воспользуемся уравнением состояния (уравнением Клайперона-Менделеева
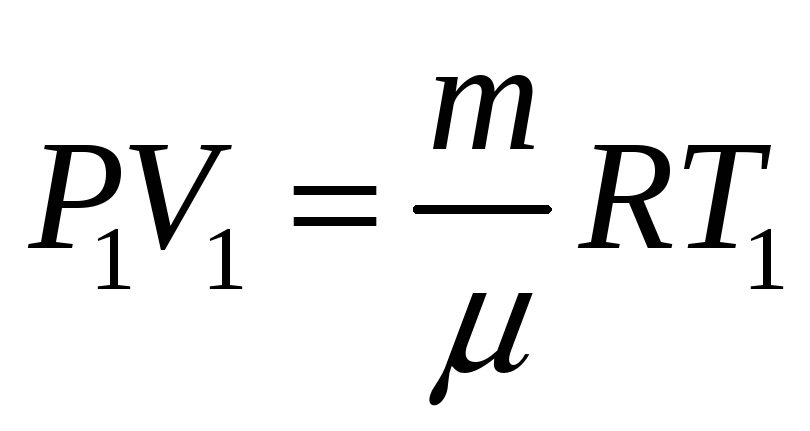

И получим
Из этих выражений для работы при политропическом процессе легко получмть работу при адиабатическом процессе. Для этого в полученном выражении достаточно заменить n на γ

Найдем выражение для работы совершаемой идеальным газом при изотермическом и изобарическом процессах

Так как Т=const

Д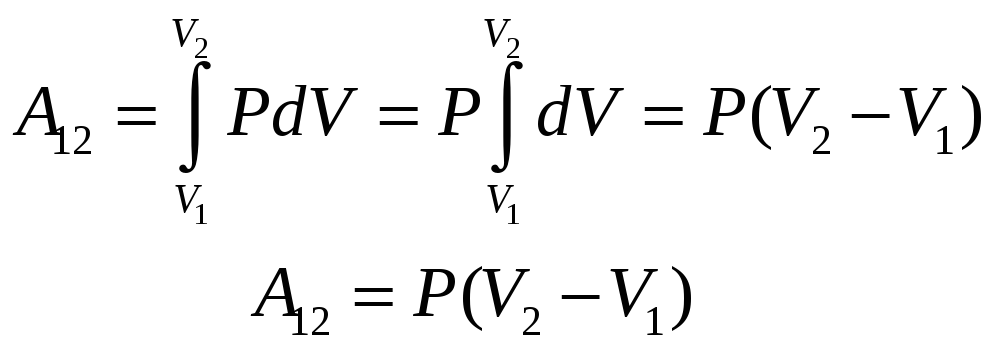 ля
изобарического процесса работа находится
проще так как Р=const
ля
изобарического процесса работа находится
проще так как Р=const
Таким образом, для 1)политропического процесса
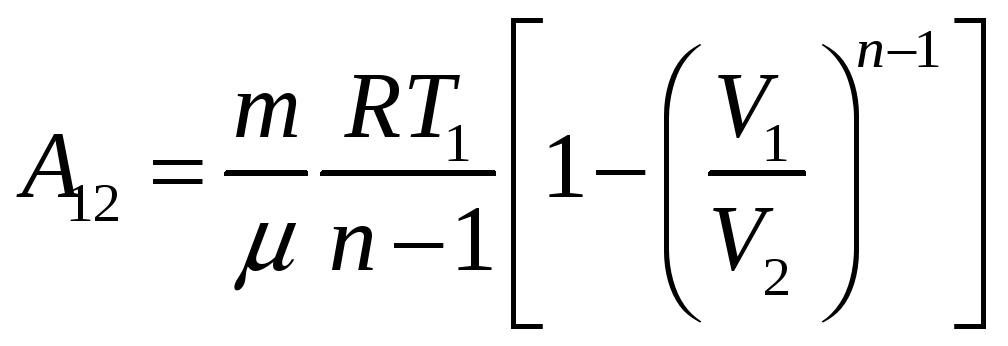
2) адиабатического процесса

3) изотермического процесса

4) изобарического процесса
![]()
15.4. Газ Ван-дер-ваальса
Поведение реальных газов описывается уравнением Клайперона –Менделеева

Однако, при высоких давлениях(порядка сотен и более атмосфер), низких температурах (около нуля градусов по шкале Цельсия), большом молекулярном весе газа наблюдается отклонение от этого закона. Связано это с тем, что свойства газа при этих условиях уже отклоняются от свойства идеального газа. При этих условиях становятся существенным силы взаимодействие между отдельными молекулами и их эффективный размер
Для описания поведения газов в широком интервале плотностей и температур Ван-дер-ваальсом было предложена удачная формула полученная на основе закона для идеальных газов но содержащая некоторые добавки учитывающие размер молекул и силы взаимодействия между ними. Для одного моля газа это уравнение записывается так:
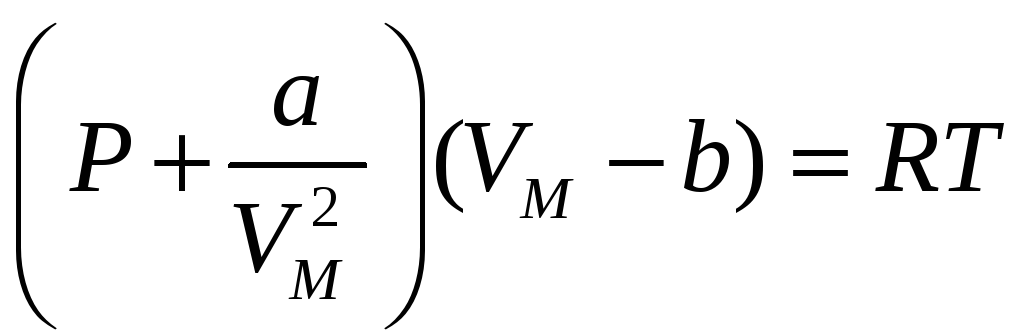
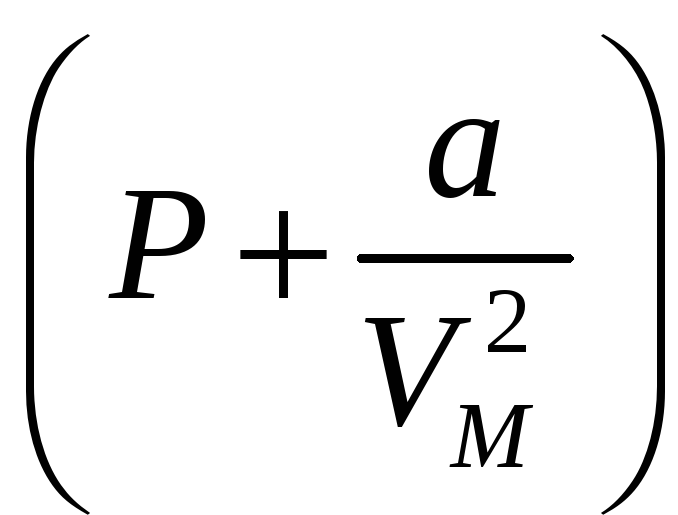
В этом выражении скобка
Аналогична давлению в законе для идеальных газов
В скобках Р имеет смысл давления которое оказывает газ на стенки сосуда. Газ в объеме в результате притяжения между молекулами испытывает как бы большее чем Р давление. Это дополнительное давление определяется членом a/V2M , где а –константа Ван-дер-ваальса измеряемая в Па м2/моль2.
В![]() ыражение
в скобках
ыражение
в скобках
Аналогично объему в уравнении для идеального газа. В скобке VM – это объем занимаемый газом член b вторая константа Ван-дер-ваальса измеряемая в м3/моль. Эта константа учитывает тот факт, что реальные газы имеют как бы меньший объем, где могут двигаться молекулы, в следствие того, что молекулы реального газа имеют собственный объем уменьшающий свободный объем занимаемый газом. Для каждого сорта газа существуют свои константы Ван-дер-ваальса.
Для того чтобы перейти от уравнения описывающего поведения одного моля Ван-дер-вальсовского газа к уравнению для произвольной массы газа необходимо данный объем газа V входящий в уравнение разделить на количество молей( ν = .m/μ) Таким образом получим уравнение для произвольного количества Ван-дер-вальсовского газа
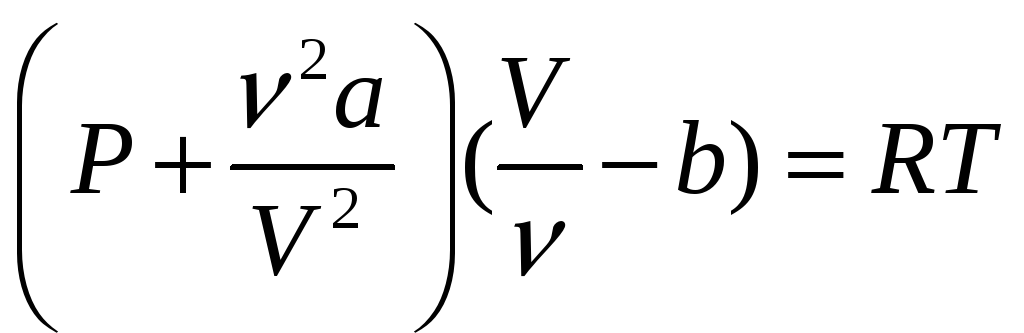
15.5. Внутренняя энергия газа Ван-дер-ваальса
Молекулы идеального газа не взаимодействуют между собой. Молекулы газа Ван-дер-ваальса притягиваются друг к другу, поэтому при изменении расстояния между молекулами (при этом изменяется объем газа) совершается работа. Таким образом при сжатии или расширении газа меняется его внутренняя энергия. Работа совершаемая газом определяется как
![]()
Работа производимая силами взаимодействия молекул определяется дополнительным давлением в уравнении Ван-дер-ваальса а/V2М ,таким образом для одного моля газа
![]()
П![]()
![]() ри
неограниченном увеличении объема газа
(его расширении) Ван-дер-ваальсовский
газ становится идеальным газом.
Внутренняя энергия идеального газа не
зависит от объем, а зависит только от
температуры газа и для одного моля
равняется U=CVT
. Таким образом
ри
неограниченном увеличении объема газа
(его расширении) Ван-дер-ваальсовский
газ становится идеальным газом.
Внутренняя энергия идеального газа не
зависит от объем, а зависит только от
температуры газа и для одного моля
равняется U=CVT
. Таким образом
Поэтому внутренняя энергия Ванн-дер-ваальсовского газа будет:
Для произвольного количества молей газа внутренняя энергия выразится как

