5.2. Электроды
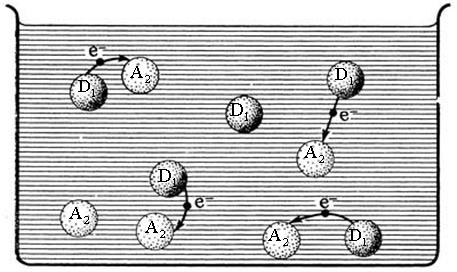
Перераспределение электронной плотности в окислительно-восстанови-тельной реакции D1 + A2 A1 + D2, если проводить ее в специальном устройстве - гальваническом элементе, может быть использовано для создания электродвижущей силы (ЭДС). Рис. 5.1 иллюстрирует, каким образом химическую энергию можно превратить в электрическую.
|
|
|
Рис. 5.1. Слева – хаотические переходы электронов в массе окислительно-восстанови-тельной реакции; справа – упорядоченные электронные переходы в гальваническом элементе.
Гальванический элемент образован электродами (основная его часть) и может быть дополнен мембраной, проницаемой для одного типа ионов.
Рассмотрим простейший тип электрода металл - ион металла Mz+│M, соответствующий обратимой окислительно-восстановительной полуреакции между ионами металла из раствора и электронами из электрода с образованием нейтральных атомов электрода. Эта гетерогенная реакция протекает на границе раздела фазы раствора (S – solution) и фазы металлического (М - metal) электрода
Mz+ (S) + z e– M (M) ; Mz+/z + e– M/z, (5.1)
ze–– избыточная часть «электронного газа» в металле. Подразумевая фазовую принадлежность каждого компонента, чаще используют сокращенную форму записи уравнения полуреакций (вторая в (5.1)).
|
|
В зависимости от природы раствора и металла возможны два варианта. 1) Атомы металла при его растворении покидают кристаллическую решетку и переходят в раствор в виде положительных ионов. За счет оставленных на электроде электронов он приобретает отрицательный заряд и, соответственно, отрицательный потенциал, препятствующий дальнейшему растворению электрода. 2) Ионы осаждаются на электроде. Недостаток электронов, которые нейтрализуют приходящие из раствора ионы, формирует положительный потенциал электрода. |
|
Рис. 5.2. Процессы на электроде. |
Равновесие электрод
- раствор и в том, и в другом случае
определяется равенством электрохимических
потенциалов
i-х
компонентов в фазе с потенциалом φ.
![]() , (5.2)
, (5.2)
где F = 96485.3 Кл/моль – число Фарадея (абсолютная величина заряда моля электронов). Отметим, что электрохимический потенциал, по определению, кроме химического потенциала (μi) включает в себя электростатическую энергию моля частиц с зарядом zi в поле с потенциалом φ.
Итак, для реакции (5.1) на электроде Mz+| M равновесие и соответствующий равновесный потенциал определяются равенством
![]() ,
(5.3)
,
(5.3)
где штрих отмечает подфазу электронного “газа” электрода. При подстановке (5.2) в (5.3) получаем
![]() .
(5.4)
.
(5.4)
Подставляя
выраженный через активность химпотенциал
катиона в растворе
![]() находим межфазную разность потенциалов
находим межфазную разность потенциалов
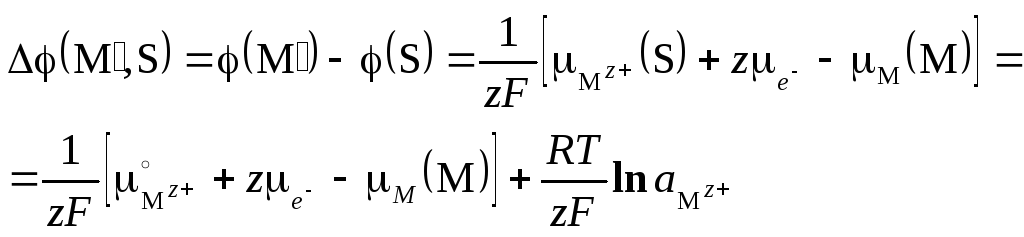 (5.5)
(5.5)
При условии отсчета
энергии от состояния простых веществ
химический потенциал электрода можно
считать равным нулю:
![]() .
Введя обозначение для оставшейся части
первого слагаемого (5.5)
.
Введя обозначение для оставшейся части
первого слагаемого (5.5)
![]() (5.6)
(5.6)
окончательно получаем (штрих, детализирующий фазу М, как и далее – опущен)
![]() (5.7)
(5.7)
Разность потенциалов на границе раздела фаз электрод (металл) – раствор ионов этого металла (межфазная разность потенциалов) выражена через стандартную разность потенциалов (индекс «˚») и активность (напомним – исправленную концентрацию) ионов в растворе. В свою очередь, стандартное значение разности потенциалов, выраженное через стандартные химические потенциалы компонентов фаз, как принято, соответствует активности равной 1.
Следующий тип так называемых газовых электродов (рис. 5.3) образован тремя сосуществующими фазами: исходный раствор, газ, обе эти фазы контактируют с фазой инертного металла. Обозначение электрода: G | G2 | Pt (если инертный металл - платина).
Вариант (а) 1/2 G2 + e– G–, например G– ≡ Cl– – ионы хлора в растворе;
Вариант (б) G+ + e– 1/2 G2, например G+ ≡ H+ .
|
|
Условие равновесия для приэлектродной химической реакции (вариант (а)), как и ранее определяется соответствующим уравнением для электрохимических потенциалов:
|
|
Рис. 5.3. Электрод газ | инертный металл. |
При этом в отличие от идеального химический потенциал неидеального газа, выражается не через давление, а через летучесть f, аналогично активности соответствующей исправленному давлению.
В полученной после аналогичных преобразований разности потенциалов уравнению (а) соответствует верхний знак, уравнению (б) - нижний:
 ,
(5.9)
,
(5.9)
где
![]() – стандартное значение межфазного
потенциала приf
и a =
1.
– стандартное значение межфазного
потенциала приf
и a =
1.
|
|
Электрод - ион | нерастворимая соль | металл (X– | MX | M) имеет две поверхности раздела. С одной стороны соль MX контактирует с раствором, содержащим анионы X–, а с другой стороны - с металлом M. Обычный пример - хлорсеребряный электрод: Cl– | AgCl | Ag . Еще один пример такого электрода - так называемый каломельный электрод Cl– | Hg2Cl2 | Hg . Электродная реакция MX + e‾ ↔ M + X‾ включает компоненты трех фаз, что учитывается при записи условия равновесия (5.10): |
|
Рис. 5.4. Электрод ион | нерастворимая соль | металл |
![]() ,
(5.10)
,
(5.10)
![]() ,
,
![]() ,
(5.11)
,
(5.11)
где
![]() .(5.12)
.(5.12)
Все рассмотренные выше электроды - материализация окислительно-восстановительных или редокс-реакций, связанных с переносом электронов. Однако термин редокс-электрод применяется в тех случаях, когда вещества в растворе существуют в двух окислительных состояниях.
Обозначение редокс-электрода A2+, A+ | M , где M - инертный металл соответствует полуреакции A2+ + e– = A+.
Примеры: Fe3+ + e– Fe2+ - биологически важное гидрохиноновое равновесие.
Вывод, подобный предыдущим, дает выражение для межфазной разности потенциалов и его стандартной составляющей
![]() , (5.13)
, (5.13)
![]() . (5.14)
. (5.14)
Важно, что положение равновесия с необходимым соотношением окисленных форм можно регулировать изменением разности потенциалов. С другой стороны раствор с заданным соотношением концентраций восстановленных и окисленных ионов позволяет поддерживать требуемую разность потенциалов.
|
|
Если два раствора соли MX различной концентрации разделить мембраной, проницаемой, например, только для катионов M+, то за счет их диффузии в разбавленный раствор устанавливается мембранный потенциал:
– следствие равенства электрохимических потенциалов фаз α и β с различной концентрацией ионов. Один из "живых" примеров мембранной системы - стенка биологической клетки, |
|
Рис. 5.5. Возникновение мембранного потенциала. |
которая более проницаема для ионов K+, чем для Na+ и Cl¯. Внутри клетки концентрация K+ в 10‑30 раз больше, чем снаружи и поддерживается действием "специального насоса". Горючее для него –аденозинтрифосфорная кислота (АТФ). Управление ферментами. (in,ex) = 0,07 В.
Импульс 0,02 В изменяет структуру мембраны, и она становится проницаемой для Na+. Это приводит к уменьшению (in,ex) , которое в свою очередь приводит в активность соседние клетки и т.д., что формирует волну передачи нервных импульсов.