Электропроводность электролитов.
Закон Ома: I = U/R. При заданной длине проводника l и площади его поперечного сечения S сопротивление R определяется удельной электропроводностью κ или удельным сопротивлением ρ материала проводника: κ = 1/ ρ = l / (S R), (Ом ∙м)-1
Ионная проводимость растворов электролитов (проводники 2-го рода) обусловлена их диссоциацией Кν+А ν- = ν+ Кz+ + ν− Az-, ν+ z+ = ν− z – .
Скорость миграции ионов под действием поля напряженностью Е:
![]() определяется
балансом действующих на ион сил
электрического поля и трения Стокса (
z
e
E
=
6 π
η
r
υ
).
определяется
балансом действующих на ион сил
электрического поля и трения Стокса (
z
e
E
=
6 π
η
r
υ
).
Подвижность ионов – это умноженная на число Фарадея удельная скорость λ± = F υ ± /E = F z±e / (6 π η r±), (5.27)
где η – вязкость среды, r± - эффективный радиус ионов.
При бесконечном разбавлении справедлив закон независимого движения ионов (Кольрауш). λ∞ = λ∞+ +λ∞− При этом λ∞ η = const – (правило Вальдена).
В общем случае эквивалентная электропроводность пропорциональна степени диссоциации α λ = κ∙1000/(С, моль/л) = λ∞ ∙α ∙fλ ,
где fλ - коэффициент электропроводности – аналог коэффициента активности, характеризующий межионное взаимодействие.
Для слабых электролитов f λ ≈ 1 и решение для α из закона разведения Оствальда при концентрациях С << Кд может быть приближенно представлено в виде α ≈ 1 – С/ Кд . При этом λ = λ∞(1- С/ Кд).
Для разбавленных
растворов сильных электролитов (α ≈ 1)
Кольрауш экспериментально нашел, а
Онсагер теоретически обосновал
концентрационную зависимость "квадратного
корня". λ
= λ∞∙f
λ
= λ∞
− const
![]() .
.
Вышеприведенные зависимости из измерений электропроводности позволяют определять эффективные размеры ионов (r+ , r−) , вязкость среды, наконец количественные закономерности в поведении степени диссоциации электролитов. Измерение электрической проводимости электролитов – кондуктометрия - кроме определения физико-химических характеристик применяется в химическом анализе (кондуктометрическое титрование по минимуму электропроводности в точке эквивалентности).
В проводимости одновременно участвуют анионы и катионы. Их доли в эквивалентной электропроводности обычно неодинаковы и характеризуются числами переноса: t± = λ ± / λ = v ± / v .
Числа переноса определяются либо прямым измерением скоростей движения окрашенных ионов в электрическом поле, либо по изменению концентраций в прианодном и прикатодном пространствах до и по окончании электролиза (Гитторф)
5.9. Законы Фарадея.
где I – ток, z - электрохимическая валентность.
Объединенная форма раскрывает физический смысл эмпирически установленных законов Фарадея.
-
Масса m вещества, претерпевшего химическое превращение, пропорциональна электрическому заряду q, прошедшему через электролит. Коэффициент пропорциональности – Кэ = Мэ / F- электрохимический эквивалент.
-
Электрохимические эквиваленты разных веществ пропорциональны их химическим эквивалентам. Коэффициент пропорциональности 1/F определяет число Фарадея, заряд иона zF / NA и его кратность элементарному заряду e.
Законы Фарадея являются общими и точными. Отклонения обусловлены побочными неэлектрохимическими составляющими. При этом эффективность или КПД собственно электрохимического процесса оценивается выходом по току. Ниже представлен отсутствующий в литературе вывод закона Фарадея.
Закон кратных отношений в соответствии со стехиометрией химической реакции 0 = Σ νi Ai , (νi < 0 для реагентов) определяет изменение количества вещества всех участников реакции через единую реакционную переменную – координату реакции ξ: (ni - n0i)/νi = Δni /νi = ξ.
Его применение к
электродной полуреакции Mz+
+ z e–
= M
(0 = - Mz+
- z e–
+ M),
с одной стороны, к электронам -Δnе
/(-z)=
ξ, с другой - , к металлу ΔnM
=
ξ, формирует равенство: ΔnM
=
Δnе
/z,
из которого после очевидных подстановок
ΔnM
=
m/M
и
Δnе
= q/F
следует
объединенный закон Фарадея
![]() .
.
5.10. Скорость электрохимической реакции
как гетерогенной реакции определяется изменением числа молей n к единице поверхности электрода S (см. раздел "Химическая кинетика").
υ = (1/S) dn / dt.
При использовании законов Фарадея эта скорость может быть выражена через плотность тока i = I / S . (n =m /M = i S t / zF)
υ = i / zF.
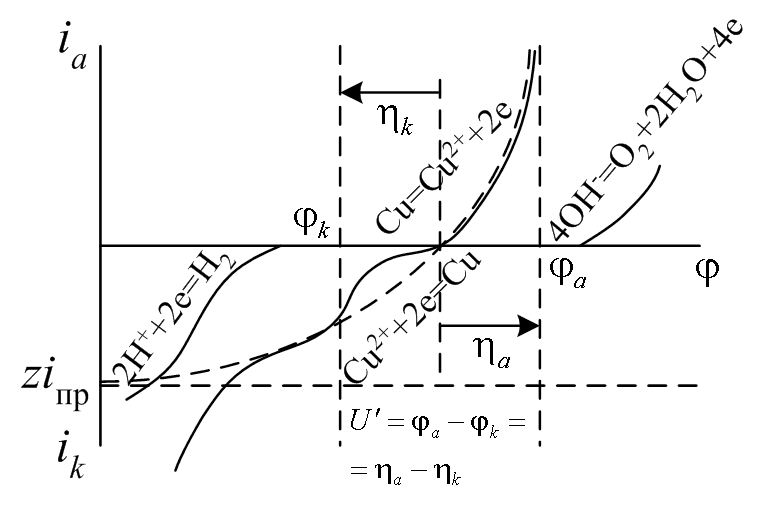
Эксплуатация химического источника тока или электролиз (см. далее) является неравновесными, чаще стационарными процессами и характеризуется величиной электродного потенциала φ отличающегося от равновесного φр. Их разность, как мы увидим далее, пропорциональная току, называется электродной поляризацией η = φ – φр.
В отношении отдельных составляющих (стадий) скорости гетерогенной электрохимической реакции используют термин перенапряжение.
-
Первая стадия – транспорт реагентов к электроду и продуктов от электрода в электролит.
-
Вторая, собственно электрохимическая стадия, связана с переходом электронов и ионов через границу раздела раствор – электрод. Эту стадию обычно сопровождают и дополняют предшествующие или последующие реакции а) химических и б) фазовых превращений.
5.11. Транспортное, диффузионное перенапряжение
Транспорт участников реакции осуществляется за счет
-
миграции заряженных частиц, взаимосвязанной с числами переноса;
-
диффузии в приэлектродный слой с необходимостью учета конвективной, потоковой ее составляющей.
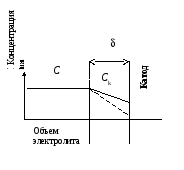
Для простейшей электрохимической системы под током рассмотрим случай, когда транспорт ионов будет более медленной стадией по сравнению с электрохимической.
+ M │ Ca Mz+(C) Ck│ M –
Скорость установившегося, стационарного прикатодного процесса vк = vмигр + vдифф с учетом электрохимического её определения и конкретизацией диффузионной составляющей равна
i / (zF) = tк i / (zF) + D (C - Ck) / δ ,
где tk – число переноса для катионов; D - коэффициент диффузии ионов, δ – эффективная толщина диффузионного слоя.
|
|
Концентрация катионов в обедненном прикатодном слое Ck, которая и определяет неравновесный электродный потенциал под током, равна Ck = C (1 – i /(z iпр)),
где iпр = DFC/(δ (1 – tк)), - предельный ток. |
После подстановки Ck в ηк получаем искомое диффузионное перенапряжение катодного процесса как функцию тока
ηк = φ – φравн = φº + (RT/(zF)) lnCк – [φº +(RT/(zF)) lnC ]
ηк,а = (RT/(zF)) ln(1 – i /(z iпр)),
Для удобства графического отображения полученных зависимостей η(i) и обратной ей i(η) условимся внутри электрохимической ячейки считать ток, входящий в электрод – положительным, а выходящий – отрицательным. Последняя формула с учетом знака z принимает единый вид и для катода и для анода, а за ней следует обратная зависимость тока на электродах от перенапряжения.
η = (RT/(zF)) ln(1 – i / (z iпр)), i = z iпр (1 – exp (z y)),
где y = η RT/F – безразмерное перенапряжение. На катоде y, η < 0, i → z iпр при η → - ∞. На аноде y, η > 0, а i → ∞ при увеличении η.
|
|
||
|
Рассмотренная модель диффузионного перенапряжения как для катодного, так и для анодного процессов учитывает миграцию заряженных частиц и их диффузию, в том числе конвективную.
Химическую составляющую (химическое перенапряжение) электродного процесса упрощенно представляют в виде промежуточных химических реакций, дополняющих собственно электродную Ox + z e– Red.
Например, собственно электрохимической стадии катодного выделения меди (реакция (b)) из раствора Cu(CN)2– предшествует реакция (a) образования окислителя (Ox =CuCN)
Cu(CN)2– CuCN + CN– (a) CuCN + e– Cu + CN– (b).
Аналогичным образом в виде квазихимических реакций можно выразить и фазовое перенапряжение, т.е. торможение электродной реакции за счет сопутствующих фазовых превращений (образование газов, покрытий и т.д.). Например, для катодной электрокристаллизации металлов дополнительно учитывается стадия зародышеобразования.
В практических исследованиях перенапряжение делят на диффузионное и активационное. При такой расширенной трактовке выражения для катодного и анодного перенапряжений включают в себя соответствующие кинетические параметры.
![]() ,
, ![]() ,
,
где i0 - плотность тока обмена, кроме диффузионных, включает в себя и кинетические (активационные) характеристики гетерогенных электродных процессов.
В области малых перенапряжений |zy| << 1, exp (zy) ≈ 1+ zy
![]() ,
,
![]() .
.
Вывод: при изготовлении электродов сравнения, обеспечивающих постоянство равновесного потенциала, используются системы с большим током обмена i0.
В области больших перенапряжений z y >> 1
![]()
![]()
эмпирическое уравнение Тафеля используется, в частности, для характеристики электролитического выделения водорода. Например, для кислых растворов (H3O+ + e– 1/2 H2 + H2O)
|
Металл |
Pt |
Au |
Ni |
Fe |
Cu |
Ag |
Sn |
Zn |
Hg |
Pb |
|
a, В |
0,1 |
0,4 |
0,63 |
0,7 |
0,87 |
0,95 |
1,2 |
1,24 |
1,41 |
1,56 |
|
b, В |
0,03 |
0,12 |
0,11 |
0,12 |
0,12 |
0,1 |
0,13 |
0,12 |
0,11 |
0,11 |
На величину поляризации существенно влияет состояние поверхности: ее уменьшает шероховатость; покрытие платиновой черни на поверхности платины снижает ее до нуля. Перенапряжение водорода падает с повышением температуры (за счет активационного увеличения i0).
Кстати, расчетное значение таффелевского коэффициента b = 0,118 В при β = 0,5 и Т = 298 К в большинстве случаев совпадает с наблюдаемыми величинами.
Механизм и последовательная теоретическая модель электродной поляризации до сих пор не установлены. На качественном уровне эксперимент интерпретируется совокупностью последовательных стадий.
1) массодоставка H+ (H3O+) из раствора к электроду;
2) адсорбция, дегидратация и разряд H+;
3)
образование молекулярного водорода: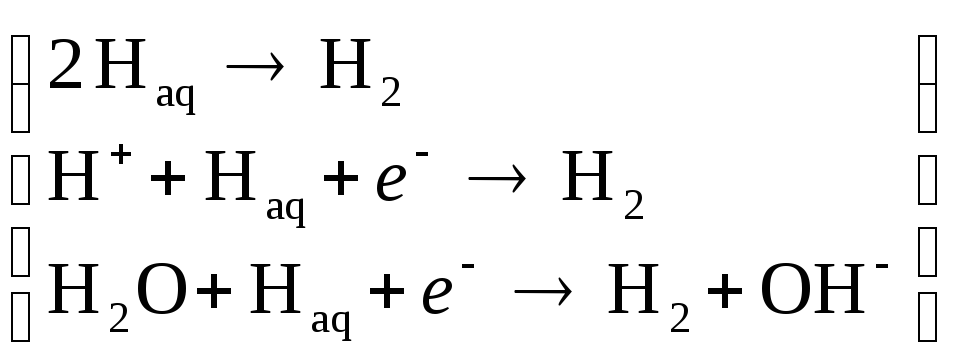 ;
;
4) десорбция с пузырьковым фазо-, точнее, газообразованием.
В настоящее время лимитирующей и определяющей считается вторая стадия "замедленного разряда". На величину перенапряжения водорода влияют состав раствора, pH, общая концентрация ионов, наличие ПАВ и т.д.
Величина
водородного перенапряжения, нежелательная
с точки зрения получения водорода, может
играть положительную роль, например, в
технологии электролиза водных растворов
солей цинка. Вследствие высокого
перенапряжения водорода на Zn потенциал
его выделения (в нейтральном растворе
![]() =
–0,41 В) сдвигается в сторону отрицательных
значений, благодаря чему возможно
катодное осаждение металла (
=
–0,41 В) сдвигается в сторону отрицательных
значений, благодаря чему возможно
катодное осаждение металла (![]() =
–0,76 В) с выходом по току до 95 %.
=
–0,76 В) с выходом по току до 95 %.
Режим электролиза для гальванического элемента – это принудительная реализация невыгодной восстановительной полуреакции путем создания избытка электронов, а значит отрицательного потенциала на катоде. Положительный потенциал на аноде от внешнего источника призван нейтрализовать электроны также невыгодной окислительной полуреакции.
Главное качество и назначение электролиза заключается в проведении ОВР, в более широком смысле процессов, самопроизвольное протекание которых по термодинамике невозможно. Например, разложение одномолярного раствора HCl (1 М) на элементы сопровождается возрастанием энергии Гиббса на 131,26 кДж/моль:
1/2 Cl2 + e– Cl– L = 1,36 В
H+ + e– 1/2 H2 R = 0
H+ + Cl– = 1/2 H2 + 1/2 Cl2 , E = –1,36 В G = –FE = 131,26 кДж/моль
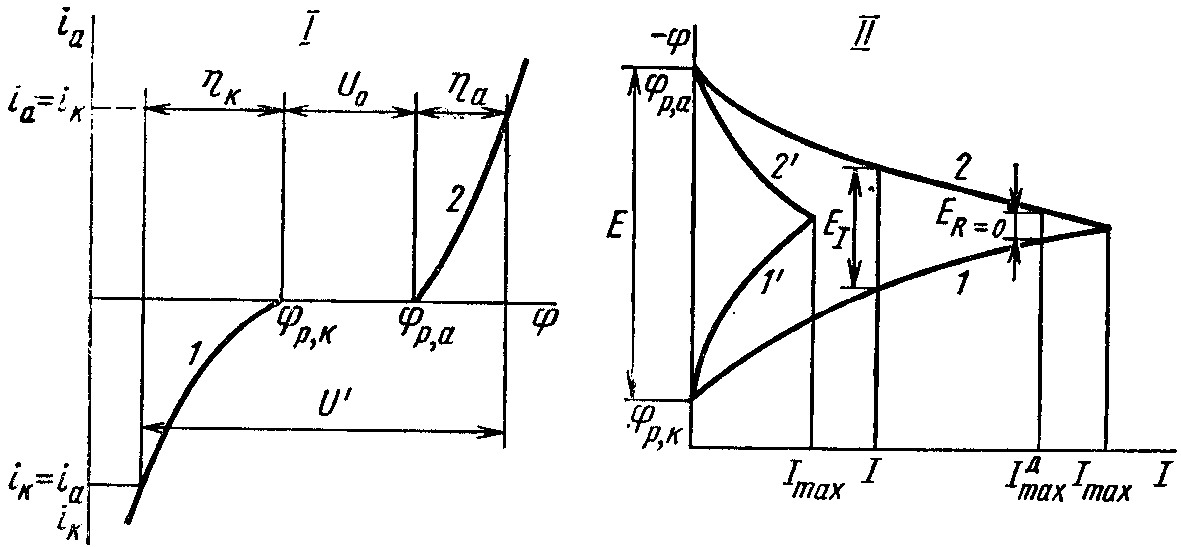
Для осуществления электролиза, в соответствии с рис. 5.12. (I) к электролизёру необходимо приложить разность потенциалов или напряжение
U = U′ + U = a – k + U ,
которое кроме омического падения напряжения электролита, электродов и контактов U, включает в себя разность потенциалов поляризованных электродов под током U′ = a – k , называемую напряжением разложения электролита:
U′ = p,a + |a| – (p,k – |k|) = p,a – p,k + |a| + |k|= U0 + |a| +|k|.
Здесь указанные электродные потенциалы выражены через соответствующие равновесные потенциалы и электродные поляризации .
|
|
|
Рис. 5.12. Катодные (1) и анодные (2) поляризационные кривые при электролизе (I) и работе гальванического элемента (II) |
При
этом разность равновесных электродных
потенциалов называется обратимым
напряжением разложения электролита:
U0
= p,a
– p,k
, которое численно равно э.д.с.
электрохимической ячейки в режиме
гальванического элемента, и которое
соответствует реакции, обратной реакции
при электролизе. Например,
![]() , T =
298,15 К.
, T =
298,15 К.
Напряжение разложения воды на платиновых электродах с учетом перенапряжений на электродах составляет U' = 1,7 В. Эта же величина соответствует и кислородсодержащим кислотам и щелочам, поскольку при электролизе их водных растворов идет разложение воды.
Процессы, протекающие при электролизе, можно разбить на три группы:
1) При катодном осаждении металла с использованием растворимого анода из того же металла в случае равенства катодного и анодного выхода по току электродные реакции обратны друг другу и химических превращений в электролизере не происходит (пример электролиза CuSO4 с медными элктродами).
2) Электролиз раствора соляной кислоты - пример электролиза сопровождающегося химическим разложением электролита.:
3) Химические реакции, в которых участвуют различные компоненты электролита и растворитель.
Примером может служить электролиз кислого раствора KCl с инертным анодом:
|
Возможные реакции на аноде |
, В |
Возможные реакции на катоде |
, В |
|
А1: 1/2 Cl2 + e– Clˉ |
1,36 |
К1: К+ + e- К |
-2,93 |
|
А2: ¼ O2 + H+ + e- 1/2 H2O |
1,23 |
К2: H+ + e– 1/2 H2 |
0 |
Выбор полуреакций по минимальной катодно-анодной разности потенциалов, соответствующей минимуму энергетических затрат, дает реакции А2 и К2, однако по меньшему перенапряжению вместо кинетически заторможенной реакции А2 с выделением кислорода следует выбрать А1 , с выделением хлора. Т.о. результирующая реакция соответствует сумме подчеркнутых: H+ + Clˉ = 1/2 H2 + 1/2 Cl2
Широкому практическому применению электролиза способствует высокое качество продуктов (например, чистота) и достаточная экономич-ность метода. Электролиз является практически единственным способом получения важнейших металлов, таких, как алюминий и магний. Существенное значение имеет электролиз раствора NaCl с получением хлора, водорода и щелочи, а также электролитический способ производства ряда препаратов (KMnO4, NaClO, бензидин, органические фторпроизводные и др.). Катодное осаждение металлов играет большую роль в металлургии цветных металлов и в технологии гальванотехники.
Поляризационные явления в химических источниках тока.
Для ОВР RedL + OxR → OхL + RedR в гальваническом элементе под током I , в соответствии с вольт-амперной характеристикой электродных полуреакций (рис. 5.11) анодная поляризация (перенапряжение) увеличивает равновесный потенциал, а катодная - уменьшает. (В выражениях представлены модули перенапряжений.)
OxL + ze- ← RedL, φa = φp,a + ηa ,
OxR + ze- → RedR , φk = φp,k – ηk.
ЭДС гальванического элемента EI = φk – φa = φp,k – φp,a – (ηk + ηa ).
По закону Ома I = EI /( R + Rex )= [E – (ηk + ηa )] /( R + Rex ),
R, Rex - сопротивление самого источника и внешней нагрузки.
Сопоставление поляризационных кривых 1, 2 и 1', 2' на рис. 5.12 (II) показывает, что чем выше поляризация, тем меньше отбираемый ток и мощность.
Снижение вредных поляризационных явлений при разработке гальванического элемента осуществляется соответствующим выбором систем и введением специальных деполяризаторов.
Практическое использование электрохимических процессов
Важнейшим применением электролиза является извлечение с его помощью ряда химических элементов из природного сырья. Например, хлор, водород и натрий получают путем электролиза соляных растворов или расплавленного NaCl. Почти весь вырабатываемый в настоящее время алюминий – продукт электролиза раствора Al2O3 в криолите. Предпочтительный вариант диссоциации Al2O3 в расплаве криолита (Na3[AlF6]): 2 Al2O3 = Al3+ + 3 AlO2−
определяет следующие электродные процессы (Федотьев):
A: 2AlO2- = Al2O3 + O + 2e- ; K: Al3+ + 3e- = Al .
Выделяющийся на аноде кислород окисляет "жертвенный" графитовый электрод.
Расплавленный MgCl2 путем электролиза превращается в магний и хлор.
Окончательная стадия получения меди – ее электрорафинирование. Элементы с более низким, чем медь, окислительным потенциалом, как, например, серебро золото и платина, не способны окисляться на аноде и стекают с него на дно ванны, а элементы, имеющие более низкий восстановительный потенциал по сравнению с медью, не могут восстанавливаться на катоде и остаются в растворе. Процесс ведется так, что только медь окисляется на аноде и восстанавливается на катоде, где благодаря этому получается медь высокой степени чистоты.
Процесс электроосаждения металлов основан на общих законах электрохимии, однако для нанесения хороших покрытий необходимо соблюдать столько мер предосторожности, что эта техника порой граничит с искусством. Хорошего серебряного покрытия можно добиться при работе с цианидным комплексом серебра Ag(CN)2−, он позволяет поддерживать очень низкую концентрацию ионов Ag+, благодаря чему достигается осаждение серебра равномерным и плотно прилегающим слоем. В других случаях для обеспечения высоких свойств электропокрытий приходится вводить в раствор такие добавки, как сахар, крахмал и мочевину.
Среди гальванических элементов - несомненный лидер по использованию – элемент Лекланше (1865 г.), известный всем под названием сухого элемента. Цинковый сосуд, в котором помещается этот элемент, представляет собой анод; катодом служит угольный стержень. Электролит содержит мелко размельченный MnO2, а также хлорид аммония; оба эти вещества участвуют в восстановительной реакции.
Гальваническому элементу − Zn│ZnCl2 + NH4Cl + MnO2│C +
соответствует токообразующая реакция
Zn + 2 MnO2 + 2 NH4Cl → [Zn (NH3)2]Cl2 + 2 MnO(OH), Eo = 1,55 ÷ 1,85 B.
Сухой элемент практически невозможно регенерировать или перезарядить, поэтому его называют первичным элементом.
Вторичные элементы (аккумуляторы) основаны на обратимых электродных реакциях. Принципы работы наиболее распространенного из них - свинцового и его электродные реакции мы уже рассмотрели. Добавим, что он создан Планте в 1859 г. но до сих пор по распространенности держит явное первенство, благодаря дешевизне, возможности работать в разных режимах. Ресурс стартерных 100 ÷ 300 циклов, тяговых 300÷1500. Ео = 1,95 ÷2,15.
Второе место среди аккумуляторов держат щелочные.
NiO(OH) +1/2 M{Cd, Fe(II), Zn} + H2O = Ni (OH)2 + 1/2 M (OH)2
NiO(OH) +H2О + e- → Ni (OH)2 + OH− ~ 0,6 B;
Cd(OH)2 + 2 e- ← Cd + 2 OH− -0,81 B
Среди перспективных конструкций отметим серно-натриевый:
3S + 2Na = Na2S3 (300 ÷ 3500C) Ео = 2,08 В.
Проблема − в изготовлении пластин керамического электролита NaAlO2 с проводимостью по катионам Na+.
Металлогидридный:
H2O + e- ← ½ H2 + OH−
NiO(OH) +H2О + e- → Ni (OH)2 + OH−
½ H2 + NiO(OH) = Ni (OH)2
|
|
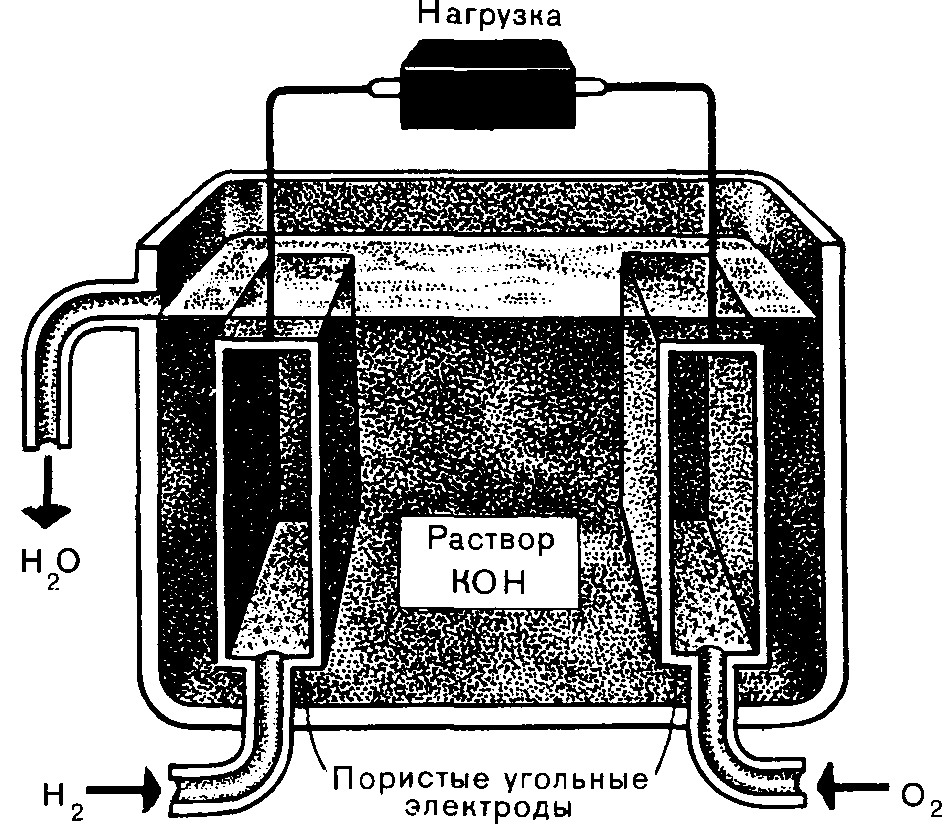
Непрерывно действующей разновидностью гальванического элемента является топливный элемент (ТЭ), в котором химическая энергия окисления (сгорания) топлива по электрохимическому механизму превращается в электрическую, а не тепловую. КПД тепловых электростанций менее 40%. КПД ТЭ принципиально может достигать 100%. A : H2 + 2OH - → 2H2O + 2e– K : 1/2O2 + H2O + 2 e–→ 2OH– H2 + 1/2O2 → H2O Eo (1атм) = 1,229 (25 оС); 1,162 (100 оС) |
|
Рис. 5.13. Топливный электрохимический элемент на водороде и кислороде |
Разрабатываются среднетемпературные ТЭ с фосфорнокислым электролитом и другие для использования не ОСЧ, а технического водорода. В США и Японии есть действующие электростанции мощностью ~ 10 МВт.
Развивается направление по созданию биохимического ТЭ, в котором используются ферменты и мембраны, обладающие селективной проницаемостью для катионов и анионов.