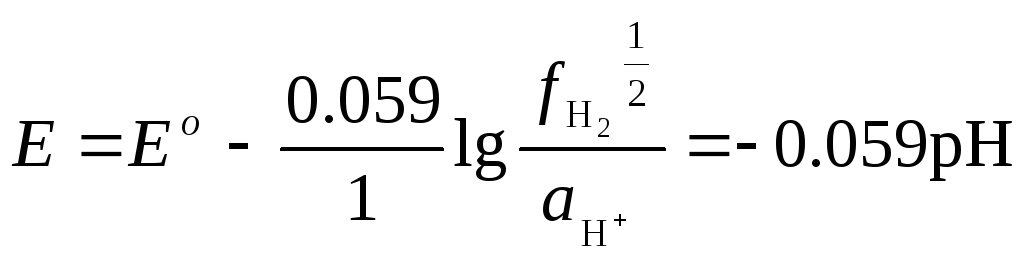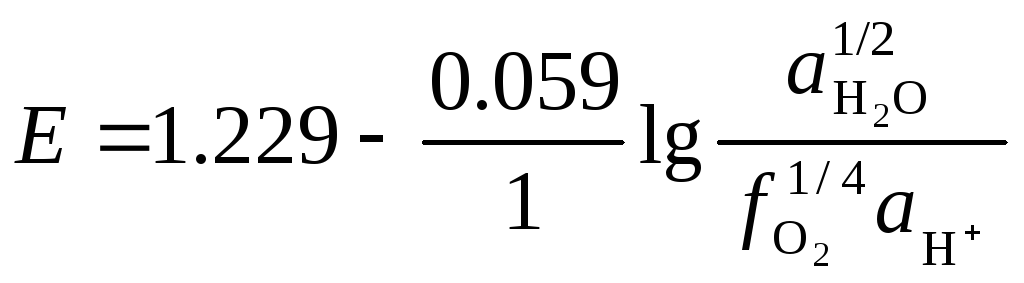Lektsii / Электрохимия
.docЭлектрохимия в одной лекции.
-
Важные в электрохимии ОВР представляются совокупностью взаимосвязанных или сопряженных полуреакций:
окисление
А
 :
:
![]()
K:
![]()
 восстановление
восстановление
![]()
-
Каждая полуреакция материализована (протекает) на соответствующем электроде: восстановительная на катоде (К), а окислительная на аноде (А)
Электрод - это активный или пассивный (инертный) проводник, опущенный в электролит. Может дополнительно омываться газом.
-
Систематизация полуреакций, записанных в восстановительной форме, выполнена на основе стандартных потенциалов φо, измеряемых относительно стандартной водородной полуреакции, потенциал которой принят за 0.
3 .1
.1
![]()
![]()

![]()
![]()
![]()
![]()
![]() (водородом
можно восстановить медь)
(водородом
можно восстановить медь)
Реализуемость
реакции определяется![]() .
Фундаментальное соотношение связывает
.
Фундаментальное соотношение связывает
![]() с
с
![]() .
.
![]()
-
Чем больше потенциал, тем выгоднее восстановительная полуреакция.
-
Ведущей, т.е. определяющей направление протекания ОВР будет восстановительная полуреакция с б
 льшим
потенциалом.
льшим
потенциалом. -
Обозначение гальванического элемента: Pt, ||Cu, Pt
-
С
Гальв.эл-т
(разрядка)
Электролиз
(зарядка)
винцовый аккумулятор



![]()


![]()
![]() -0.41
А (-)
К
-0.41
А (-)
К
разрядка


![]()
![]() +1.68 К
(+)
А
+1.68 К
(+)
А
зарядка
(сложение по
хвостам)
(сложение по
остриям)![]()


![]()
![]()
![]() ,
(-403.3 на моль Pb)
,
(-403.3 на моль Pb)
Режим гальванического элемента: Выгодная восстановительная реакция отнимая у катода электроны создаёт там положительный потенциал (формируется “+” на катоде). “−“ на аноде формируется за счёт того, что выгодная окислительная реакция оставляет там электроны.
Режим электролиза − это принудительная реализация невыгодной восстановительной полуреакции путём создания избытка электронов и отрицательного потенциала на катоде. “+” на аноде от внешнего источника нейтрализует электроны «невыгодной» окислительной полуреакции.
A(+) K(-)![]()
![]()
-
Э

 лектролиз
раствора соли меди:
лектролиз
раствора соли меди:
А



![]()

 :
:
![]()
К

![]()
![]()
![]()
 Cu
= Cu
! более чистая медь (рафинирование)
Cu
= Cu
! более чистая медь (рафинирование)
Медь очищается, потому что одни ионы не восстанавливаются на катоде и остаются в растворе, а другие образуют нерастворимый шлам при окислении анода.
В i
A
K 0.337
i



![]()

![]()



![]() ,
B
,
B
![]()


0 0.337

![]()

![]()
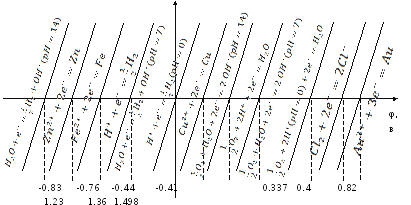
-
Принципы выбора сопряженных полуреакций из возможных на оси потенциалов. (
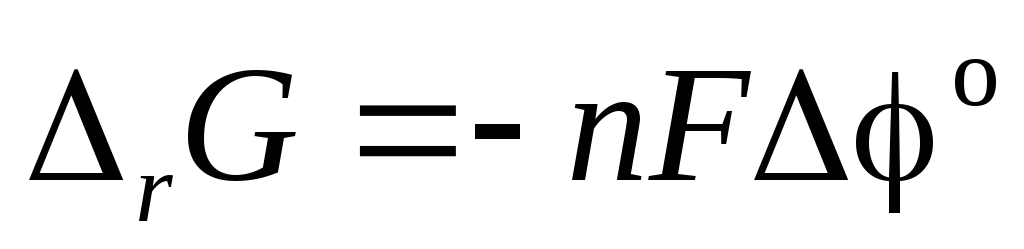 )
)
-
Характеризующие процесс полуреакции определяются наличием:
-
компонентов в электродах, электролите, а также
-
сопутствующих газов и конденсированных веществ.
-
Для гальванического элемента с позиции максимальной энергетической выгодности (
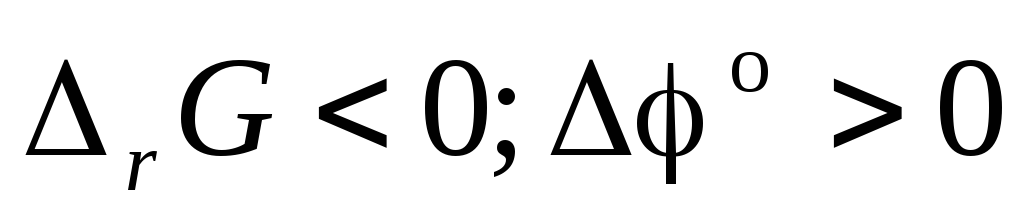 )
на
оси потенциалов из возможных выбираются
)
на
оси потенциалов из возможных выбираются
максимально:
-
правая восстановительно-катодная полуреакция
-
левая окислительно-анодная полуреакция.
-
-
При электролизе внешняя разность потенциалов при необходимости по минимуму преодолеть невыгодную ОВР (
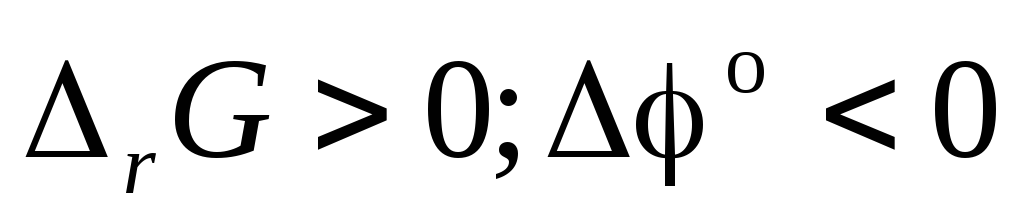 )
направлена
на принудительную реализацию
)
направлена
на принудительную реализацию
|
минимально: |
|
-
К





-0.44 0.82


 оррозионный
гальванический элемент.
оррозионный
гальванический элемент.

![]()
![]()
|
|
|
-
П







 ротекторная
(анодная) защита жертвенным анодом
ротекторная
(анодная) защита жертвенным анодом
![]()
-0.76
-0.41
|
A
|
|
-
Электролиз раствора
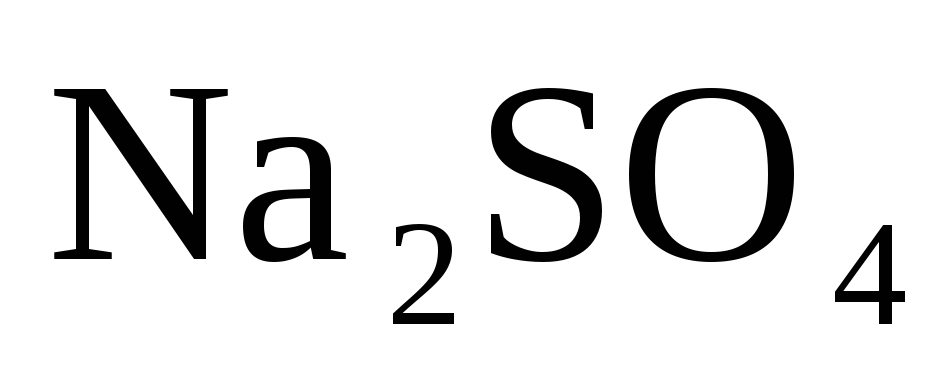
|
Возможные п/р на катоде K:
|
Возможные п/р на аноде A:
|



![]()
![]()
-
К
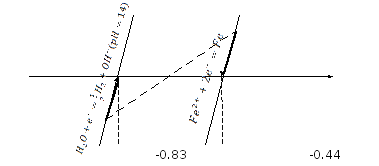 атодная
защита (электролиз). Растворение
жертвенного металла (железа).
атодная
защита (электролиз). Растворение
жертвенного металла (железа).
![]()
![]()
Топливный (гальванический) элемент

![]()
![]()

![]()
![]()
Уравнение
Нернста определяет
отличие «нестандартного» от стандартного
потенциала для электродной
восстановительной полуреакции
![]() относительно
стандартной водородной:
относительно
стандартной водородной:
![]()









![]()
![]()
![]()
![]()




![]()
![]()
0.824
-0.41
0
0.403
0.816
1.229
|
|
|
|
Для стандартной водородной п/р H+
+
e−
=
½ H2
(активность газообразного компонента вместо давления выражается фугитивностью f) |
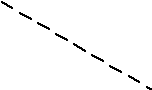
Окислительное разложение воды:
|
Особенность в записи полуреакций в нейтральной среде ( pH=7):
-
при восстановительном её протекании следует использовать левую форму записи, поскольку изначально практически нет ;
-
при окислительном протекании используется правая форма, поскольку вначале нет .

 (+):
(+):
 К
(-):
К
(-):