
Техника Лабораторных Работ
.pdf71
3.8. Определение плотности жидкости
Цель работы: Определите плотность раствора соли, выданного инженером практикума, при помощи пикнометра и ареометра.
Реактивы: водный раствор неорганической соли.
Приборы и материалы: стеклянный цилиндр, набор ареометров, пикнометр, аналитические весы.
Выполнение работы.
Для быстрого определения относительной плотности жидкости применяют ареометр (денсиметр).
Получите раствор исследуемой жидкости и набор ареометров у инженера практикума. Налейте раствор соли в стеклянный цилиндр емкостью примерно до половины его объема. Наливать жидкость до краев не следует, так как при погружении ареометра жидкость может перелиться через край. Поэтому уровень жидкости в цилиндре должен быть на несколько сантиметров ниже края цилиндра.
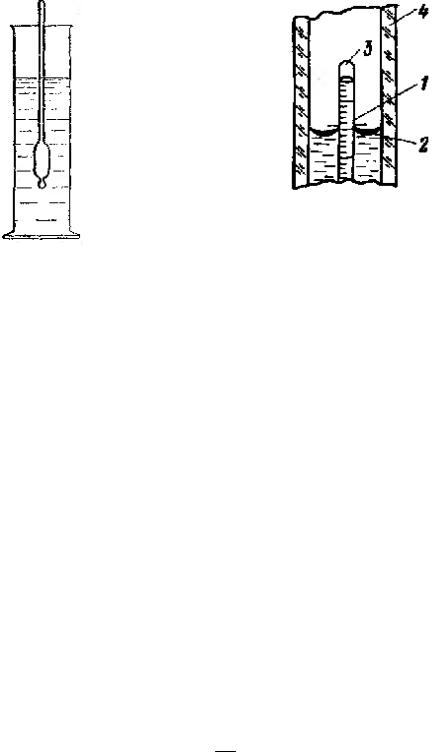
Первым в раствор погружают ареометр, предназначенный для испытания жидкостей с наименьшей плотностью. Такой ареометр будет всплывать даже в самой легкой жидкости. Он не опустится на дно, не ударится и не разобьется. Его легко можно будет извлечь из раствора за верхнюю часть. Если есть сомнение в том, что ареометр подходит для данной жидкости, то погружать ареометр в жидкость следует осторожно, не выпуская его из рук до тех пор, пока не станет очевидным, что он плавает. Тогда руку можно отпустить, и ареометр примет нужное положение. Ареометр должен находиться в центре цилиндра и ни в коем случае не касаться стенок или быть к ним очень близко, так как положение ареометра в цилиндре отражается на точности показаний. Точно так же недопустимо, чтобы ареометр касался дна цилиндра (рис. 52).
Если ареометр окажется легким, и уровень жидкости в цилиндре не достигнет шкалы, то ареометр извлекают в кристаллизатор для последующего мытья. В тот же цилиндр можно опустить следующий, более тяжелый по интервалу плотности, ареометр.
В результате последовательного перебора будет найден такой ареометр, который останется плавать в таком положении, что уровень жидкости окажется в пределах отсчетной шкалы (рис. 53).
Отсчет проводят по делениям шкалы ареометра через 1 – 2 минуты после погружения. Деление, против которого установился верхний мениск жидкости, показывает значение плотности жидкости.
После определения плотности все использованные ареометры промывают водопроводной водой, ополаскивают дистиллированной водой, высушивают при комнатной температуре и убирают в специальный футляр.
72
|
Рис. 53. Мениск вокруг трубки |
|
|
ареометра: |
|
Рис. 52. Правильное |
1 – верхний край, 2 – нижний край |
|
мениска, 3 - трубка ареометра, 4 – стенка |
||
расположение ареометра в |
||
цилиндра |
||
цилиндре |
||
|
Более точно значение плотности можно найти при помощи пикнометра.
У инженера практикума получите пикнометр. Вымытый и высушенный пикнометр вместе с пробкой взвесьте на аналитических весах. Запишите это значение массы m1.
Затем заполните пикнометр исследуемым раствором до метки. Отсчет ведите по нижнему краю мениска. Излишек жидкости из пикнометра можно удалить при помощи пипетки с капиллярным кончиком или полоской фильтровальной бумаги. После этого пикнометр закройте пробкой и тщательно оботрите снаружи куском ткани либо бумаги, не оставляющей на поверхности пикнометра следов волокон, и взвесьте на аналитических весах. Значение массы m2 запишите.
Вылейте раствор, промойте пикнометр дистиллированной водой и заполните его ей до метки. Определите массу пикнометра на аналитических весах. Запишите результат m3.
Плотность исследуемой жидкости ρ20, пренебрегая плотностью воздуха и принимая плотность воды при комнатной температуре равной 0.9982 г/мл, вычисляют по формуле:
ρ20 = 0.9982 г × m2 − m1
мл m3 − m1
В отчете отразите Ваши расчеты плотности одного и того же раствора двумя разными методами, сравните полученные значения между собой. Проверьте результат у инженера практикума.
Исходя из природы соли, используйте измеренное значение плотности для нахождения концентрации ее раствора, основываясь на приводимой в справочниках зависимости плотности раствора от концентрации.
73
3.9. Определение температуры плавления
Цель работы: Определите температуру плавления вещества, выданного инженером практикума.
Реактивы: образец неизвестного вещества.
Приборы и материалы: прибор для определения температуры плавления, песчаная баня, электрическая плитка.
Выполнение работы.
Получите у инженера практикума прибор для определения температуры плавления, стеклянный капилляр и навеску неизвестного вещества.
Встеклянный капилляр плотно набейте тонкий порошок исследуемого вещества. Высота слоя вещества в капилляре должна быть не более 2 – 3 мм. Для этого открытый конец капилляра опустите в мелко растертое вещество, затем переверните капилляр вниз дном, зажмите капилляр в пальцах руки и резко постучать рукой о стол, при этом вещество осядет вниз и уплотнится. Эту операцию повторите несколько раз, пока в капилляре не соберется достаточное количество вещества.
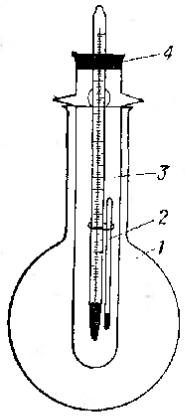
Чисто вытертый снаружи капилляр прикрепите с помощью резинового кольца к термометру на уровне ртутного резервуара. Термометр вместе с капилляром закрепляют на пробке в пробирке, которую вставляют в колбу с глицерином. Нижний конец термометра при этом должен находиться на несколько миллиметров выше дна пробирки. Собранный прибор нагревают на песчаной бане (рис. 54).
Вмомент плавления непрозрачные кристаллы превращаются в нижней части капилляра в прозрачную каплю. Эту температуру принимают за температуру плавления вещества.
Первое определение температуры плавления считают ориентировочным. Для получения более точного результата опыт повторяют три раза. При каждом последующем определении прибор необходимо немного охладить (примерно на 10 °С). Используя результат первого определения температуры, при последующих определениях подъем температуры вблизи точки плавления производят медленно. Температуры плавления рассчитывают как среднее арифметическое из показаний трех последовательных определений и проверяют правильность определения у инженера.
74
Рис. 54. Прибор для определения температуры плавления:
1 – сферическая плоскодонная колба с глицерином, 2 –капиллярная трубка, 3 – пробирка с расширением в верхней части, 4 – пробка с вставленным термометром.
75
3.10. Определение температуры кипения жидкости
Цель работы: Определите температуру кипения вещества, выданного инженером практикума.
Реактивы: индивидуальное вещество.
Приборы и материалы: прибор для определения температуры кипения, песчаная баня, электрическая плитка.
Выполнение работы.
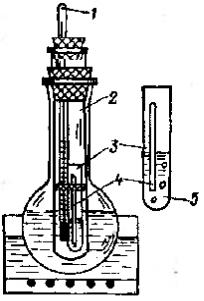
Определение температуры кипения жидкости по Сиволобову производят в приборе, изображенном на рис 55.
Рис. 55. Прибор для определения температуры кипения:
1 – термометр, 2 – большая пробирка, 3 – маленькая пробирка с веществом, 4 – капилляр с запаянным верхним концом, 5 – исследуемая жидкость.
Получите у инженера практикума прибор для определения температуры кипения жидкости, маленькую пробирку с исследуемым веществом и капилляр. В колбу с глицерином помещают пробирку, в которую через пробку вставляют термометр. К термометру у ртутного резервуара с помощью резинового кольца прикрепляют пробирку из тонкостенного стекла. В пробирку помещают несколько капель жидкости, температуру кипения которой нужно определить, и опускают в нее капилляр запаянным концом вверх. Нагревают колбу на песчаной бане до тех пор, пока из капилляра не начнут выходить пузырьки газа, после чего нагревание прекращают и охлаждают прибор. Отмечают температуру, при которой пузырьки почти перестанут выделяться из капилляра. Это и будет температура кипения исследуемой жидкости.
76
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1.Воскресенский П.И. Техника лабораторных работ.- М., 1973.
2.Рачинский Ф.Ю., Рачинская М.Ф. Техника лабораторных работ.- Л.,
1982.
3.Крешков А.П. Основы аналитической химии.- М., 1976.- Т.2.
4.Практикум по неорганической химии / Под ред. В.И.Спицына.- М.,
1984.
5. Скуг Д., Уэст Д. Основы аналитической химии.- М.,1978.
