
Техника Лабораторных Работ
.pdf61
3.4. Перекристаллизация
Цель работы: Проведите очистку 15 г: а) хлорида аммония, б) сульфата калия, в) сульфата аммония перекристаллизацией из водного раствора и рассчитайте выход очищенной соли.
Реактивы: дистиллированная вода, хлорид аммония, сульфат калия, сульфат аммония.
Приборы и материалы: плоскодонная колба на 100 мл, водяная баня, мерный цилиндр, электрическая плитка.
Выполнение работы.
Очистка твердых химических веществ перекристаллизацией позволяет отделить растворимую примесь от растворимого вещества. Процесс основан на различной растворимости основного вещества и загрязняющих его примесей в соответствующем растворителе или смеси растворителей. Для проведения очистки приготавливают горячий концентрированный раствор очищаемого вещества, близкий к насыщенному. Поскольку растворимость большинства веществ при уменьшении температуры снижается, то при охлаждении исходного раствора получится пересыщенный раствор основного вещества, из которого самопроизвольно выпадают кристаллы очищаемого вещества. Поскольку примесей в основном веществе немного, то по отношению к ним насыщенного раствора не образуется, так что примесь сможет остаться в растворе. Некоторая небольшая часть примеси на практике оказывается в очищаемом веществе за счет процессов сокристаллизации, адсорбции и окклюзии.
Перекристаллизация включает несколько стадий: приготовление концентрированного раствора очищаемого вещества, фильтрования горячего раствора для отделения нерастворимых примесей и оставшихся нерастворенными кристаллов, охлаждения раствора для достижения пересыщения, кристаллизации очищаемого вещества, отделения кристаллов от маточного раствора, удаления растворителя высушиванием. Часто перед фильтрованием горячий раствор обрабатывают активным углем с целью его обесцвечивания и удаления коллоидных взвесей. В ряде случаев необходимая очистка твердого вещества достигается лишь в результате повторной (многократной) перекристаллизации.
Для приготовления насыщенного раствора соли, указанной преподавателем, и на основании справочных данных по растворимости рассчитывают массу воды, которую необходимо добавить к 15 г исходной безводной соли для получения насыщенного при 80 °С раствора. Полученное значение массы нужно проверить у преподавателя.
На техно-химических весах взвешивается заданное количество твердого вещества, которое переносят в химический стакан и добавляют

62
отмеренный мерным цилиндром рассчитанный объем дистиллированной воды. Стакан с раствором помещают на песчаную баню и нагревают до кипения. При достижении точки кипения должно произойти полное растворение очищаемого вещества, так что кипящий раствор должен оказаться прозрачным. Нагревание прекращают при появлении на поверхности жидкости небольшой корочки мелких кристаллов. Если вещество полностью не растворится, то добавляют дополнительную порцию дистиллированной воды. Если и после этого количество нерастворившегося вещества не уменьшится, то следует прибегнуть к горячему фильтрованию.
Горячее фильтрование проводят преимущественно с использованием металлических воронок с двойными стенками (рис. 46) или воронок, обогреваемых электрическим током. За счет нагревания отростка газовой горелкой либо съемным электронагревателем в металлической рубашке во время фильтрования находится постоянно подогреваемый теплоноситель, например, поддерживается кипение воды. Нагретую взвесь наливают по стеклянной палочке в предварительно нагретую металлическую воронку. Отфильтрованный раствор стекает в приемник.
Рис. 46. Проведение горячего фильтрования: 1 – металлическая воронка с двойными стенками, 2 – обогреваемый отросток, 3 – стеклянная воронка с бумажным фильтром.
Стакан с отфильтрованным раствором охлаждают сначала на воздухе, а далее в сосуде с холодной водой. Выпавшие кристаллы отделяют от маточного раствора при помощи фильтрования на складчатом фильтре, промывают несколькими порциями охлажденной дистиллированной водой и высушивают на воздухе до воздушно-сухого рассыпчатого состояния. После высушивания определяют массу очищенной соли и рассчитывают выход продукта.

63
3.5. Перегонка
Цель работы: Проведите очистку 50 мл водопроводной воды перегонкой и рассчитайте выход дистиллята.
Реактивы: водопроводная вода с добавкой одной капли раствора FeCl3, раствор роданида калия KNCS или роданида аммония NH4NCS.
Приборы и материалы: прибор для перегонки, кипелки, электрическая плитка.
Выполнение работы.
Простая перегонка сводится к частичному испарению кипящей жидкой смеси, полному отводу и конденсации образовавшихся при этом паров. Как правило, простую перегонку применяют для разделения термически устойчивых жидких веществ от нелетучих примесей и веществ, сильно отличающихся по температуре кипения, для отделения жидкости от растворенных в ней твердых веществ, для концентрирования растворов, для очистки сжиженных газов.
Для проведения перегонки собирают прибор, изображенный на рис. 47. Он состоит из колбы Вюрца с трубкой для отвода паров кипящей жидкости в холодильник, термометром, нисходящим холодильником, аллонжем и приемником дистиллята.
Рис. 47. Установка для простой перегонки.
64
Вколбу Вюрца емкостью 100 мл наливают 50 мл водопроводной воды, измерив ее объем мерным цилиндром. Затем в ту же колбу помещают кипелки - кусочки фарфора или стеклянные капилляры. Кипелки используют обычно один раз. Они, касаясь изнутри внутренней поверхности колбы Вюрца, образуют центры парообразования и обеспечивают равномерное кипение содержимого колбы (перегонного куба) без толчков и внезапного вскипания жидкости.
При сборке прибора ртутный резервуар термометра располагают так, чтобы его верхняя часть находилась на уровне нижнего края отверстия отводной трубки колбы. В этом случае ртутный резервуар хорошо омывается парами перегоняемой жидкости, и показания термометра соответствуют температуре кипения жидкости. На конце ртутного резервуара термометра при перегонке должна удерживаться и периодически падать вниз капля конденсата. Ее отсутствие указывает на то, что пар перегрет, и термометр показывает температуру, превышающую температуру кипения жидкости.
Движение охлаждающей воды в холодильнике всегда направляют снизу вверх, к более горячей части внутренней его трубки. При подаче охлаждающей воды в обратном направлении она стекает по наружной трубке, не охватывая внутреннюю трубку, подлежащую охлаждению. В лучшем случае такой холодильник работает менее эффективно, чем воздушный той же длины. В худшем случае от механических напряжений, вызванных перепадом температуры, холодильник растрескивается.
Колбы с перегоняемой жидкостью нагревают в колбонагревателях, газовыми горелками, в жидкостных банях и песчаных банях. Скорость перегонки считают нормальной, если из холодильника стекает примерно одна капля конденсата в 2 – 3 с. До конца перегонять жидкость не рекомендуют, чтобы не допустить растрескивания куба и разложения кубового остатка. Перегонку прекращают, когда в колбе остается немного жидкости.
Полученный дистиллят собирают, и при помощи мерного цилиндра измеряют его объем. По этим данным рассчитывают выход. Отделение примеси ионов железа от воды перегонкой устанавливают качественной реакцией с роданид-ионами. Сравнивают интенсивность окраски, вызываемой добавлением роданид-ионов к исходной воде и к полученному дистилляту.
Вотчете указывают внешний вид исходной жидкости и полученного дистиллята, формулируют заключение об эффективности очистки воды от ионов железа на основании качественной реакции, приводят расчет выхода очищенной воды и примерную скорость перегонки, выраженную числом капель дистиллята в секунду.

65
3.6. Возгонка
Цель работы: Проведите очистку 0.5 г бензойной кислоты методом сублимации и рассчитайте выход продукта.
Реактивы: бензойная кислота.
Приборы и материалы: фарфоровая чашка, стеклянная воронка, фильтровальная бумага, песчаная баня.
Выполнение работы.
Возгонка (сублимация) – процесс превращения твердого вещества в пар, минуя жидкое состояние. Процесс, обратный возгонке, называется десублимацией. Возгонка позволяет очистить летучее твердое вещество от нелетучей примеси.
Для проведения возгонки взвесьте на техно-химических весах 0.5 г бензойной кислоты и поместите ее в фарфоровую чашку, закрытую листком фильтровальной бумаги с несколькими отверстиями в нем. Далее поверх бумаги поместите воронку широким концом книзу, диаметр которой несколько меньше диаметра чашки (рис. 48).
Рис. 48. Прибор для возгонки:
1 – стеклянная воронка, 2 – фильтровальная бумага, 3 – фарфоровая чашка.
После сборки прибора аккуратно поместите его на песчаную баню под тягу и продолжайте нагревать до тех пор, пока основная масса вещества из чашки не возгонится. Далее, захватив пинцетом или зажимом за чашку, перенесите прибор в сборе на керамическую плитку для его охлаждения. После полного охлаждения аккуратно снимите воронку и лист бумаги, так, чтобы возгон с воронки не попал обратно в чашку. Стеклянной палочкой соберите на фильтровальную бумагу очищенное вещество со стенок воронки и взвесьте его на техно-химических весах. Исходя из значений масс исходной навески и возгона, рассчитайте выход продукта.
В отчете отразите цвет исходной и полученной в результате сублимации бензойной кислоты, а также форму очищенных кристаллов. Отметьте время, необходимое для выполнения возгонки.
66
3.7. Титрование
Цель работы: Определите концентрацию раствора кислоты или щелочи, выданного инженером практикума, методом титрования и рассчитайте доверительный интервал полученного значения.
Реактивы: раствор кислоты либо щелочи, раствор кислоты либо щелочи с известной концентрацией (0.1 н.), раствор индикатора (фенолфталеин, метиловый оранжевый или лакмус).
Приборы и материалы: бюретка для титрования, пипетка Мора объемом 10 или 20 мл, груша, воронка, стаканчик на 50 мл, плоскодонная коническая колба для титрования на 150 мл .
Выполнение работы:
Определение концентрации раствора кислоты или щелочи выполняется при помощи титрования. Он применяется, если известны объемы растворов реагирующих веществ и концентрация одного из реагентов.
В плоскодонную колбу или стакан на 200 мл у инженера практикума получите раствор кислоты либо щелочи, концентрацию которого следует определить. Также получите у инженера раствор щелочи либо кислоты с известной концентрацией, т.е. стандартный (титрованный) раствор.
Приготовьте к работе бюретку для титрования, установив зажим или закрыв кран. Ополосните бюретку небольшим объемом стандартнеого раствора, после чего вылейте этот раствор в слив через нижний конец бюретки, открыв зажим или кран.
Укрепите бюретку в штативе и через воронку залейте в нее титрованный раствор несколько выше нулевого деления. Снимите воронку, исключая таким образом попадание капель стандартного раствора в бюретку в ходе титрования.
Удалите пузырьки воздуха из нижнего кончика бюретки. Попробуйте полностью открыть зажим бюретки и получить сильную струю жидкости в подставленный стакан или колбу. Если вытеснить воздух таким способом не удается, то погрузите оттянутый кончик бюретки в стакан со стандартным раствором, присоедините резиновую грушу через резиновую трубку и пробку к верхнему отверстию бюретки и, приоткрыв кран, засосите немного жидкости. Пузырек воздуха при этом выйдет внутрь бюретки и далее в атмосферу. Для бюретки, оборудованной резиновой трубкой и краном, достаточно отвести от себя и соседей по лаборатории кверху стеклянный наконечник и, осторожно приоткрывая кран, вытеснить воздушный пузырек стандартным раствором.
Доведите уровень жидкости в бюретке до нуля, выпуская раствор по каплям через нижний конец бюретки и стараясь не оставлять капли на стенках бюретки. Отсчет уровня нужно вести по нижнем краю мениска

67
(рис. 49). При этом глаз наблюдателя должен находиться на одной высоте с уровнем жидкости в бюретке.
Убедитесь в отсутствии течи раствора через кран или зажим. На кончике бюретки не должны образовываться капли. Бюретка готова к работе.
Рис. 49. Подготовка бюретки к титрованию:
1 – закрепление бюретки в штативе, 2 – заполнение бюретки титрованным раствором, 3 – доведение объема жидкости до нуля, 4 – иллюстрация неточности отсчета показаний, связанных с положением глаз наблюдателя.
Следующий этап – отбор точного объема раствора неизвестной концентрации пипеткой. Ополосните вымытую пипетку раствором, который нужно оттитровать. Для этого к верхнему отверстию пипетки присоедините сжатую резиновую грушу, погрузите нижний конец пипетки в раствор и наберите в пипетку жидкость выше метки. Следите за тем, чтобы нижний конец пипетки постоянно был погружен в жидкость. В противном случае попавший воздух забросит набранный раствор в резиновую грушу. Отсоедините грушу и вылейте содержимое пипетки в слив.
Отберите ополоснутой пипеткой точный объем раствора для титрования. С помощью груши наполните пипетку через нижнее отверстие на 2 – 3 см выше метки. Снимите грушу и закройте указательным пальцем верхнее отверстие пипетки, удерживая ее между большим пальцем с одной стороны и средним и безымянным пальцами той же руки с другой стороны (рис. 50). Для достижения герметичности указательный палец рекомендуется смочить водой, коснувшись выжатой мокрой тряпки. Избыток жидкости, находящийся выше метки, медленно сливают из пипетки, ослабив слегка нажим указательного пальца либо наклонив его. Хорошие результаты дает также вращение пипетки большим, средним и безымянным пальцами. Как только нижний край мениска коснется метки, расположенной на уровне глаз, отверстие пипетки вновь плотно закрывают, усилив нажим пальце на верхнее
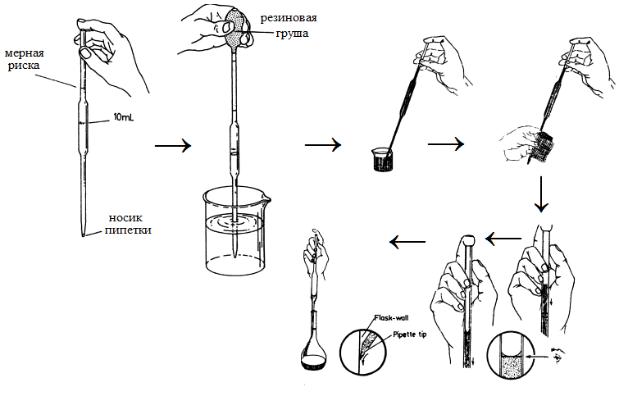
68
отверстие, и переносят кончик пипетки в предварительно ополоснутую дистиллированной водой колбу для титрования.
Вылейте содержимое пипетки в колбу для титрования, открыв верхнее отверстие пипетки. Во время сливания жидкости пипетку держат вертикально или слегка наклонив ее. Вытекание жидкости продолжается около одной минуты, причем на внутренней стенке пипетки не должно оставаться капель жидкости. Для обеспечения точности отбора объема выполните однократное длительное (в течение 10 – 15 секунд) касание дна колбы для титрования выше уровня жидкости, наклонив ее. Выньте пипетку из колбы, оставив каплю жидкости в носике.
Рис. 50. Порядок действий при отборе пробы с помощью пипетки.
Перед началом титрования в колбу для титрования с раствором неизвестной концентрации добавьте 2 – 3 капли раствора индикатора. Их окраска в различных средах и интервалы рН перехода указаны в табл. 3.
Табл. 3. Интервалы |
перехода |
важнейших |
кислотно-основных |
|||
индикаторов. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Окраска |
|
Интервал |
|
Индикатор |
|
Кислотной |
|
Щелочной формы |
перехода |
|
|
|
формы |
|
рН |
||
|
|
|
|
|
||
Фенолфталеин |
|
Бесцветная |
|
Малиновая |
8.2 – 10.0 |
|
Лакмус |
|
Красная |
|
Синяя |
5.0 – 8.0 |
|
Метиловый оранжевый |
|
Розовый |
|
Желтая |
3.0 – 4.4 |
|

69
После этого проводят ориентировочный опыт. Для этого небольшими порциями (по 0.5 мл) приливают титрованный раствор из бюретки в колбу с раствором неизвестной концентрации до изменения окраски индикатора. Раствор в колбе во время опыта следует все время перемешивать легким круговым движением (рис. 51). Как только индикатор изменит свою окраску, добавление реактива из бюретки нужно прекратить и произвести отсчет объема израсходованной жидкости с точностью до десятых долей миллилитра.
Рис. 51. Положение рук при титровании.
Повторите титрование еще три раза, более точно (по каплям) дозируя стандартный раствор вблизи конечной точки титрования (примерно за 0.5 ─ 0.7 мл перед ее достижением в ориентировочном или предшествующем опытах). Резкое изменение окраски индикатора от одной капли титрованного раствора является показателем конца реакции. При повторном титровании нужно, чтобы скорость добавления раствора из бюретки была по возможности одинаковой, т.е. в одно и тоже время вытекало бы определенное количество жидкости. Определить объем израсходованного реагента с точностью до сотых долей миллилитра.
Перед каждым титрованием колбочку необходимо вымыть и сполоснуть дистиллированной водой, а уровень жидкости в бюретке довести до нуля.
Полученные значения объемов заносят в свой лабораторный журнал и по формуле вычисляют нормальную концентрацию раствора:
Cн1 = Сн2V×V2 ,
1
где Сн1 – нормальная (эквивалентная) концентрация неизвестного раствора, V1 – объем раствора с неизвестной концентрацией, равный объему пипетки,
70
Сн2 – нормальная (эквивалентная) концентрация стандартного (титрованного) раствора, V2 – объем стандартного раствора, израсходованный на титрование и отсчитанный по бюретке.
Рассчитанные значения нормальной концентрации проверьте в препараторской практикума. В отчете отразите наблюдения по ходу титрования, а также приведите расчет доверительного интервала вычисленной нормальной концентрации.
