
- •Глава 1. Аналитический обзор литературных источников 5
- •Глава 2 Расчетная и технологическая часть 18
- •Введение
- •Глава 1. Аналитический обзор литературных источников
- •1.1 Основные виды фосфатного сырья.
- •1.2 Схема производства моноаммонийфосфата с грануляцией и сушкой продукта в аммонизаторе-грануляторе.
- •1.3 Схема производства с самоиспарением пульпы под давлением и сушкой в барабанном грануляторе-сушилке-холодильнике.
- •1.4 Схема производства с сушкой пульпы в распылительной сушилке.
- •1.5 Схема производства с упариванием пульпы в вакуум-выпарных аппаратах и сушкой в аппарате бгс.
- •1.6 Новые разработки в области производства аммофоса.
- •Глава 2 Расчетная и технологическая часть
- •2.1 Характеристика сырья
- •2.2 Характеристика готового продукта
- •2.3 Физико-химические основы процесса
- •2.4 Выбор и описание технологической схемы производства аммофоса
- •2.5 Расчет материального баланса получения аммофоса
- •2.6 Расчет материального баланса стадии сушки
- •2.7 Расчет теплового баланса получения аммофоса
- •Расчет основного и вспомогательного оборудования
- •Заключение
- •Список использованной литературы
2.6 Расчет материального баланса стадии сушки
Конечная влажность готового продукта должна составлять 1%.
Исходя из данного условия произведем расчет.
На данную стадию поступает 7682,9 кг/ч свободной воды в составе аммофосной пульпы.
Аммофоcной пульпы – 35000 кг/ч.
Тогда
составим уравнение :
 ;
X = 7332,9 кг/ч (количество воды, которое
уйдет в процессе сушки)
;
X = 7332,9 кг/ч (количество воды, которое
уйдет в процессе сушки)
Таблица 4 - Материальный баланс стадии сушки аммофосной пульпы
|
Приход |
Расход | |||||
|
Статья прихода |
Масса, кг/ч |
Состав мас.% |
Статья расхода |
Масса, кг/ч |
Состав мас.% | |
|
1. Аммофосная пульпа, в том числе NH4H2PO4 (NH4)2HPO4 H2O |
29776,1 5223,9 7682,9 |
69,76 12,24 18,00 |
1. Аммофос в том числе
NH4H2PO4 (NH4)2HPO4 H2O |
29776,1 5223,9 350 |
69,76 12,24 0,82 | |
|
ВСЕГО |
35350 |
82,82 | ||||
|
2.Пар, H2O |
7332,9
|
17,18
| ||||
|
ИТОГО |
42682,9 |
100 |
ИТОГО |
42682,9 |
100 | |
Вывод: в результате расчета материального баланса были получены значения массы поступающих аммиака и фосфорной кислоты, массы получаемых моно - и диаммонийфосфата а также состав получаемых продуктов в массовых процентах:
NH4H2PO4 = 69,76 % мас.
(NH4)2HPO4=12,24 % мас.
H2O=0,82 % мас.
Таким образом, цель составления материального баланса была достигнута.
Баланс составлен верно, так как приходная и расходная часть практически совпадают.
2.7 Расчет теплового баланса получения аммофоса
Целью расчета теплового баланса является определение всех тепловых потоков, входящих в нейтрализатор и выходящих из него.
Составляем схему тепловых потоков:
Qпр Qпульпы
Н
Qисп
Qр-и Qпот


Запишем уравнение теплового баланса:
Q пр + Q р-и =Q пот. + Q пульпы+ Qисп;
Приходная часть:
Q пр= Q NH3+ Q HNO3;
Q р-и= Q р-и1+ Q р-и2;
Q
NH3=c ;
;
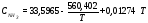
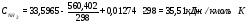
Пересчет в кДж / (кг ∙ К) выполняется по формуле:

CNH3=2,09
 -средняя
удельная теплоемкость аммиака;
-средняя
удельная теплоемкость аммиака;
m=6682,19 кг/ч - масса аммиака, пошедшего на нейтральзацию (см. материальный баланс);
TNH3=25 0С – температура поступающего аммиака;
QNH3=349144,4 КДж;
Q
H3PO4=c
CH3PO4=2,87
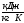 -средняя
удельная теплоемкость фосорной
кислоты;[6]
-средняя
удельная теплоемкость фосорной
кислоты;[6]
m=39987,4 кг/ч - масса фосфорной кислоты, вступившей в реакцию (см. материальный баланс);
TH3PO4=45 0С – температура поступающей фосфорной кислоты;
QH3PO4=5092395 КДж;
NH3 + H3PO4 NH4H2PO4 (1)
2NH3 + H3PO4 (NH4)2HPO4 (2)
Qр-и
1= ,
,
m=29776,1 кг – масса образующегося моноаммонийфосфата;
∆H=147 КДж – тепловой эффект реакции образования моноаммонийфосфата;
M=115Кг/Кмоль;
Qр-и 1=12169321,7 КДж;
Qр-и
2= ,
,
m=5223,9 кг – масса образующегося диаммонийфосфата;
∆H=75,5 КДж – тепловой эффект реакции образования диаммонийфосфата;
M=132 Кг/Кмоль;
Qр-ии2=2987912,5 КДж;
Qр-и=15157234,2 КДж
Qоб.пр.=349144,4+5092395+15157234,2 =20598773,6
Расходная часть:
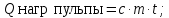
c
= 2,721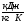 - средняя удельная теплоемкость пульпы;
- средняя удельная теплоемкость пульпы;
m = 42682,9 кг/ч – масса пульпы;
t = 1450С – температура пульпы;
Qнагр.пульпы= 16840324,78 КДж;
Qпот=0,03 ;
;
Qпот
берем равным 3 % от
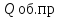
Qпот=617963,2 КДж;
Всего расходуется теплоты: 16840324,78+617963,2=17458288КДж
Избыток теплоты расходуется на испарение воды:
Qисп= 20598773,6-17458288=3140485 КДж
Qобщ. рас.=16840324,78+617963,2+3140485=20598773 КДж
Составим таблицу теплового баланса стадии нейтрализации
Таблица 5 Тепловой баланс стадии нейтрализации фосфорной кислоты
|
Приход |
Расход | |||||
|
Статья прихода |
Q, кДж |
Q,% |
Статья расхода |
Q, кДж |
Q,% | |
|
1. С аммиаком 2. С реакцией образования аммофоса и диаммофоса 3. С фосфорной кислотой
|
349144,4
15157234,2
5092395 |
1,7
73,6
24,7 |
1. C нагретой пульпой 2. C испарением воды 3. Теплопотери |
16840324,78
3140485
617963,2
|
82
15,2
2,8 | |
|
ИТОГО |
20598773,6 |
100,00 |
ИТОГО |
20598773 |
100,00 | |
Qр-и =17479224,53 КДж,
Qнагр.пульпы = 16840324,78 КДж,
Qисп.воды = 3140485 КДж,
Qпотери=617963,2 КДж,
QH3PO4=5092395 КДж,
QNH3=349144,4 КДж.
