
- •Глава 1. Аналитический обзор литературных источников 5
- •Глава 2 Расчетная и технологическая часть 18
- •Введение
- •Глава 1. Аналитический обзор литературных источников
- •1.1 Основные виды фосфатного сырья.
- •1.2 Схема производства моноаммонийфосфата с грануляцией и сушкой продукта в аммонизаторе-грануляторе.
- •1.3 Схема производства с самоиспарением пульпы под давлением и сушкой в барабанном грануляторе-сушилке-холодильнике.
- •1.4 Схема производства с сушкой пульпы в распылительной сушилке.
- •1.5 Схема производства с упариванием пульпы в вакуум-выпарных аппаратах и сушкой в аппарате бгс.
- •1.6 Новые разработки в области производства аммофоса.
- •Глава 2 Расчетная и технологическая часть
- •2.1 Характеристика сырья
- •2.2 Характеристика готового продукта
- •2.3 Физико-химические основы процесса
- •2.4 Выбор и описание технологической схемы производства аммофоса
- •2.5 Расчет материального баланса получения аммофоса
- •2.6 Расчет материального баланса стадии сушки
- •2.7 Расчет теплового баланса получения аммофоса
- •Расчет основного и вспомогательного оборудования
- •Заключение
- •Список использованной литературы
2.5 Расчет материального баланса получения аммофоса
Исходные данные:
Производительность 35 т/ч готового сухого продукта. Нейтрализацию ведут до молярного отношения NH3:H3PO4 = 1,15:1. Кислота, подаваемая на нейтрализацию (H3PO4), содержит 53 мас. % Р2О5. Жидкий аммиак содержит 99 мас. % NH3 и 1 мас. % воды, которая испаряется в ходе реакции нейтрализации. Температура в реакторе 145 С. Температуры, С: поступающей кислоты 45; аммиака 25; пульпы 145. Потери аммиака в процессе нейтрализации 0,1 мас. % от загрузки. Давление в смесителе 0,24 МПа. Получаемая пульпа, имеет следующий состав (мас. %): влага 18, диаммонийфосфат (ДАФ) 12,3; моноаммонийфосфат (МАФ) 69,7. Расчет вести без учета примесей в фосфорной кислоте. Остальные данные, необходимые для расчета, – литературные и цеховые.
Целью составления материального баланса является определение производительности готового продукта и расхода сырья.
Составим схему материальных потоков:


Расчет ведем на 35000 кг/ч готового сухого продукта.
Состав пульпы: вода 18 мас. %; ДАФ 12,3 мас. %; МАФ 69,7 мас. %.
Отсюда следует, что соотношение количества МАФ к ДАФ в готовом продукте составит:

Посчитаем сколько производится МАФ и ДАФ в кг/ч:
Предположим, что ДАФ производится х кг/ч, тогда МАФ производится 5,7х кг/ч.
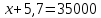 ;
;
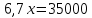 ;
;
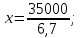
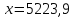 .
.
ДАФ производится 5223,9 кг/ч.
МАФ
производится 5223,9 5,7 = 29776,1 кг/ч.
5,7 = 29776,1 кг/ч.
В результате обработки фосфорной кислоты аммиаком образуется пульпа и испаряется некоторое количество воды. Расчет ведем по следующим реакциям:
NH3 + H3PO4 NH4H2PO4 (1)
2NH3 + H3PO4 (NH4)2HPO4 (2)
Рассчитаем сколько фосфорной кислоты идет на производство МАФ по уравнению (1):

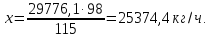
H3PO4(53
мас.%
P2O5)
=
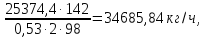
Где
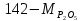 -
молярная масса P2O5,
кг/кмоль, 0,53 - мас.%
P2O5
в
долях,
-
молярная масса P2O5,
кг/кмоль, 0,53 - мас.%
P2O5
в
долях,
98
-
 -
молярная масса фосфорной кислоты,
кг/кмоль.
-
молярная масса фосфорной кислоты,
кг/кмоль.
Содержание воды в кислоте:
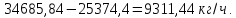
Рассчитаем сколько аммиака идет на производство МАФ:
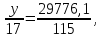
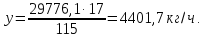
Учитывая потери аммиака в процессе нейтрализации которые составляют 0,001 от загрузки:
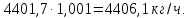
Учитывая содержание воды в аммиаке которое составляет 0,01 :
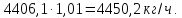
Учитывая мольное отношение NH3: H3PO4 = 1,15: 1 :
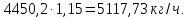
Рассчитаем сколько фосфорной кислоты идет на производство ДАФ по уравнению (2):
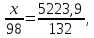
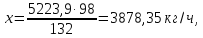
H3PO4
(53 мас.%
P2O5)
=
Содержание воды в кислоте:
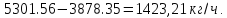
Рассчитаем сколько аммиака идет на производство ДАФ:
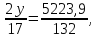

Учитывая потери аммиака в процессе нейтрализации которые составляют 0,001 мас.% от загрузки:
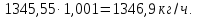
Учитывая содержание воды в аммиаке которое составляет 0,01 мас.%:
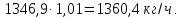
Учитывая мольное отношение NH3: H3PO4 = 1,15: 1 :
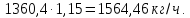
По данным расчета строим таблицу материальных балансов – таблица 3.
Таблица 3 - Материальный баланс стадии нейтрализации фосфорной кислоты
|
Статья прихода |
Масса, кг/ч
|
Состав мас.%
|
Статья расхода |
Масса, кг/ч
|
Состав мас.%
|
|
1.Фосфорная кислота (53 % P2O5), в том числе H3PO4 H2O |
29252,75 10734,65 |
62,68 23,0 |
1. Аммофосная пульпа, в том числе NH4H2PO4 (NH4)2HPO4 H2O |
29776,1 5223,9 7682,9 |
63,80 11,20 16,46 |
|
ВСЕГО |
39987,4 |
85,68 |
ВСЕГО |
42682,9 |
91,46 |
|
2. Аммиак в том числе NH3 H2O |
6615,39 66,8 |
14,18 0,14 |
2. отход. газы в том числе NH3 H2O |
867,14 3118 |
1,86 6,68 |
|
ВСЕГО |
6682,19 |
14,32 |
ВСЕГО |
3985,69 |
8,54 |
|
ИТОГО |
46668,94 |
100 |
ИТОГО |
46668,59 |
100 |
