
- •Кафедра фармацевтической химии
- •Методические указания
- •Тема: Титрованные растворы
- •I. Учебные цели
- •II. Методические указания студентам по подготовке к занятию
- •Вопросы для подготовки к занятию
- •1. Для веществ, вступающих в реакции нейтрализации
- •2. Для веществ, вступающих в реакции двойного обмена
- •3. Для веществ, вступающих в реакции окисления-восстановления
- •4. Для веществ, вступающих в реакцию комплексообразования с натрия эдетатом (трилоном б) (н2Nа2ТрБ)
- •5. Для веществ, вступающих в реакцию электрофильного замещения
- •Тестовые задания для самоконтроля готовности к занятию
- •Литература
- •III. Работа на занятиях
- •IV. Учебно-материальное обеспечение
- •Приложения
- •Титрованные растворы (офс 42-0071-07) Титрованными растворами называются растворы точно известной концентрации, предназначенные для целей титриметрического анализа.
- •Сульфаниловую кислоту перекристаллизовывают из кипящей воды, фильтруют и сушат до постоянной массы при температуре от 100ºС до 105ºС.
- •Титрованные растворы
- •1 М раствор азотной кислоты
- •0,1 М раствор аммония церия нитрата
- •0,01 М раствор аммония церия нитрата
- •0,1 М раствор аммония церия сульфата
- •0,01 М раствор аммония церия сульфата
- •0,05 М раствор бария перхлората
- •0,025 М раствор бария перхлората
- •0,1 М раствор бария хлорида
- •0,004 М раствор бензэтония хлорида
- •0,1 М раствор железа (III) аммония сульфата
- •0,1 М раствор железа (II) сульфата
- •0,033 М раствор калия бромата
- •0,02 М раствор калия бромата
- •0,0083 М раствор калия бромата
- •1 М раствор калия гидроксида
- •0,1 М раствор калия гидроксида
- •0,5 М раствор калия гидроксида в спирте 60 % (об/об)
- •0,01 М раствор калия гидроксида спиртовый
- •0,1 М раствор калия гидрофталата
- •0,05 М раствор калия йодата
- •0,001 М раствор калия йодида
- •0,05 М раствор магния сульфата
- •0,1 М раствор натрия гидроксида этанольный.
- •0,1 М раствор натрия гидроксида в смеси метанола и бензола
- •0,1 М раствор натрия нитрита
- •0,1 М раствор натрия перйодата
- •0,1 М раствор натрия тиосульфата
- •0,005 М раствор натрия тиосульфата
- •0,02 М раствор натрия эдетата
- •0,01 М раствор серебра нитрата
- •0,001 М раствор серебра нитрата
- •0,1 М раствор свинца нитрата
- •0,05 М раствор свинца нитрата
- •0,1 М раствор тетрабутиламмония гидроксида
- •0,1 М раствор тетрабутиламмония гидроксида в 2-пропаноле
- •0,01 М раствор тетрабутиламмония йодида
- •0,1 М раствор тетраэтиламмония гидроксида
- •1 М раствор хлористоводородной кислоты
- •0,5 М раствор хлористоводородной кислоты
- •0,05 М раствор хлорной кислоты
- •0,1 М раствор хлорной кислоты в метаноле
- •0,1 М раствор хлорной кислоты в нитрометане
- •0,1 М раствор уксусной кислоты
- •0,1 М раствор церия (IV) сульфата
- •0,05 М раствор цинка хлорида
- •0,1 М раствор цинка сульфата
- •Фармакопейные статьи Натрия хлорид
4. Для веществ, вступающих в реакцию комплексообразования с натрия эдетатом (трилоном б) (н2Nа2ТрБ)
СаCl2 · 6Н2О – определяемое вещество, Н2Na2ТрБ – титрант, концентрация которого равна 0,05М.
Метод количественного определения кальция хлорида основан на образовании устойчивого комплекса вещества с натрия эдетатом (трилоном Б):
СаCl2
· 6Н2О
+ Н2Na2ТрБ
![]() СаNa2ТрБ
+2НСl + 6Н2О;
СаNa2ТрБ
+2НСl + 6Н2О;
f = 1/z, где z равен 1, потому что на одну молекулу вещества идет одна молекула титранта, с учетом стехиометрических коэффициентов фактор эквивалентности будет равен: f = 1
Mf= М СаCl2 · 6Н2О · f = М СаCl2 · 6Н2О · 1;
Т Н2Na2ТрБ/
СаCl2·6Н2О
=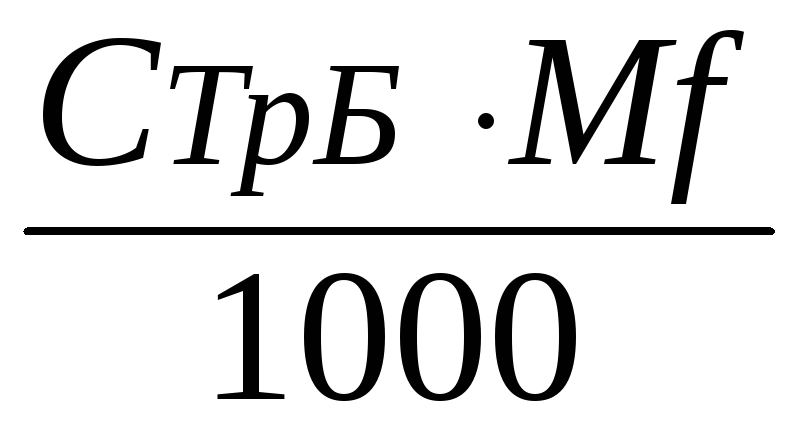
5. Для веществ, вступающих в реакцию электрофильного замещения
Количественное определение тимола броматометрическим методом.
Метод основан на реакции электрофильного замещения.
Тимол – определяемое вещество, калия бромат – титрант с концентрацией равной 0,1М, титрование проводится в присутствии избытка калия бромида в кислой среде:
KBrO3 + 5KBr + 6HCl → 3Br2 + 6KCl + 3H2O
Выделившийся бром расходуется на реакцию электрофильного замещения:

f = 1/z, где z равен числу атомов брома участвующих в реакции электрофильного замещения, с учетом стехиометрических коэффициентов фактор эквивалентности будет равен: f = 1/4;
Mf = М тимола · f = М тимола · 1/4;
Т KBrO3
⁄тимол =![]()
Тестовые задания для самоконтроля готовности к занятию
1. Титр титранта по определяемому веществу это:
А. Количество определяемого вещества, химически равноценное в реакции одному мл титранта;
Б. Количество определяемого вещества, химически равноценное в реакции объему титранта, пошедшего на титрование;
В. Количество титранта, химически равноценное в реакции 0,1 моль/л определяемого вещества.
2. Возможны способы приготовления титрованных растворов:
А. Из фиксаналов;
Б. Из концентратов;
В. Из химически чистых веществ;
Г. Из стандартных образцов.
3. Возможны способы определения концентрации титрованного раствора:
А. По точной навеске химически чистого вещества;
Б. По приблизительной массе химически чистого вещества;
В. По титрованному раствору известной концентрации;
4. Расчетная формула установки титра раствора аммония роданида (0,1М) следующая:
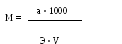
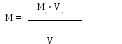
А. Б.
Раствор аммония роданида (0,1 М)
NH4SCN М. м. 76. 12
1 мл раствора содержит 0,007612 г аммония роданида.
Приготовление. 7,7 г аммония роданида растворяют в воде в мерной колбе вместимостью 1 л и доводят объем раствора водой до метки.
Установка титра. К 25 мл раствора серебра нитрата (0,1М) прибавляют 50 мл воды, 2 мл азотной кислоты, 2 мл раствора железоаммониевых квасцов и титруют приготовленным раствором аммония роданида до желто-розового окрашивания раствора.
5. Расчетная формула установки титра раствора натрия нитрита (0,1М) следующая:

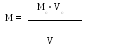
А. Б.
Раствор натрия нитрита (0,1М)
NaNO2 М. м. 69,00
1 мл раствора содержит 0,0069 г натрия нитрита.
Приготовление. 7,3 г натрия нитрита растворяют в воде в мерной колбе вместимостью 1 л и доводят объем раствора водой до метки.
Установка титра. Около 0,2 г (точная навеска) сульфаниловой кислоты, дважды перекристаллизованной из воды и высушенной при температуре 120°С до постоянной массы, помещают в толстостенный стакан, прибавляют 0,1 г натрия гидрокарбоната, растворяют в 10 мл воды, прибавляют 60 мл воды, 10 мл разведенной хлористоводородной кислоты, 1 г калия бромида и далее поступают, как указано в статье «Нитритометрия» (ГФ XI, вып. 1, с. 190). В случае применения внутренних индикаторов используют тропеолин 00 в смеси с метиленовым синим. Если в соответствующей частной статье рекомендуется нейтральный красный, то титр раствора натрия нитрита устанавливают с тем же индикатором. Молярность раствора вычисляют по первому способу.
6. В анализе могут быть использованы титранты с концентрацией:
А. 0,01 М;
Б. 0,02 М;
В. 0,05 М;
Г. 0,1 М;
Д. 10 М.
7. Выраженная в граммах масса растворенного вещества, содержащаяся в 1мл раствора, это:
А. Титр;
Б. Молярность;
В. Титр по определяемому веществу.
8. В случае разбавления титрованных растворов используют следующую формулу расчета:
А. (1-К) • а;
Б. (К-1) • 1000
9. В случае укрепления титрованных растворов используют следующую формулу расчета:
А. (1-К) • а;
Б. (К-1) • 1000.
10. Выраженная в граммах масса определяемого вещества, эквивалентна одному мл титранта, это:
А. Титр;
Б. Молярность;
В. Титр по определяемому веществу.
11. Если вещество для приготовления титрованных растворов нельзя получить в достаточно чистом виде, или его концентрация меняется при хранении раствора, то готовят раствор приблизительной концентрации:
А. Большей, чем необходимо по расчету;
Б. Меньшей, чем необходимо по расчету.
12. Выраженное в молях количество растворенного вещества содержащегося в одном литре раствора, это:
А. Титр;
Б. Молярность;
В. Титр по определяемому веществу.
13. Если титрованный раствор приготовлен из фиксанала, то:
А. Определение поправочного коэффициента проводят по всем правилам;
Б. Определение поправочного коэффициента не проводят.
14. Определили, что поправочный коэффициент к титрованному раствору равен 1,09. Этот раствор нужно:
А. Укрепить;
Б. Разбавить.
15. Определили, что поправочный коэффициент к титрованному раствору равен 0,95. Этот раствор нужно:
А. Укрепить;
Б. Разбавить.
16. Для приготовления титрованных растворов используют:
А. Вещества марки хч;
Б. Вещества марки хч и чда;
В. Вещества марки чда;
17. Размерность фактора эквивалентности:
А. моль/л;
Б. г/мл;
В. Безразмерная величина.
18. По требованиям ГФ ХI коэффициент титрованного раствора К должен находиться в пределах:
А. 0,98 – 1,02;
Б. 0,99 – 1,01.
19. Титрованные растворы применяют:
А. В количественном анализе веществ;
Б. При установлении подлинности веществ;
В. При определении влаги по методу К. Фишера;
2 0.
Формула, по которой рассчитывается
коэффициент титрованного раствора
следующая:
0.
Формула, по которой рассчитывается
коэффициент титрованного раствора
следующая:
А .
.

Б.
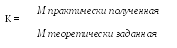
В .
.
Ответы: 1А; 2А,В; 3АВ; 4Б; 5А; 6А,Б,В,Г; 7А; 8Б; 9А; 10В; 11А; 12Б; 13Б; 14Б; 15А; 16Б; 17Б; 18А; 19А; 20В.
