
ВНЕДРЕНИЕ СМК В МЕДИЦИНСКИХ ОРГАНИЗАЦИЯХ
.pdf
При обсуждении подходов к решению практических проблем таблетирования основные доклады были представлены от FDA США, университета г. Базель (Швейцария) и секретаря секции промышленной фармации Т. Сам (MSD, Нидерланды). Рассматривались вопросы влияния различных производственных факторов на стабильность таблетированных лекарственных форм, а также меры предупреждения часто встречающихся дефектов: прилипания, расслоения, растрескивания таблеток в процессе прессования. Некоторые презентации доступны на сайте СПФО (http://spfo.ru).
Значительное внимание было уделено разработке лекарственных форм для детей. Это отражает озабоченность мировой медицинской общественности недостаточным выбором педиатрических препаратов. Здесь можно сослаться на инициативу ВОЗ «Изготовь лекарства детских размеров» (декабрь 2007 г.) и соответствующие документы Евросоюза [2].
При обсуждении проблем, возникающих в процессе таблетирования, рассматривалось использование различных видов пуансонов и матриц: с покрытиями из ванадия и вольфрама повышенной прочности, с тефлоновыми накладками или вставками на рабочей поверхности и др. В этой связи следует подчеркнуть, что речь шла не о сообщениях рекламного характера о преимуществах тех или иных видов технологической оснастки, но о научных подходах к их выбору.
Особый интерес для отечественного фармпрома представляли примеры инновационных подходов к разработке лекарственных форм в соответствии с руководствами ICH Q8, Q9 и Q10: «Фармацевтическая разработка», «Качество через дизайн (QbD)», «Пространство дизайна, его контуры и границы», «Управление знаниями», «Технология анализа процессов (PAT)». Подчеркивалась важность использования методов анализа рисков в отношении качества (диаграммы Ишикавы и др.).
Отмечалась, что использование этих подходов на этапе разработки новых препаратов влечет за собой изменения в стратегии контроля в процессе производства, а также в регуляторных механизмах.В последнее время некоторые компании в США и в Западной Европе получили разрешения на выпуск отдельных препаратов в реальном времени, т.е. по завершении производственного процесса, без дополнительного анализа образцов продукции для целей выходного контроля.
Такие разрешения открывают путь к внедрению непрерывных процессов. Это, в свою очередь, ведет к радикальному изменению не только в организации производства, но также в практику переноса технологии. Как известно, переход к непрерывным процессам позволяет избежать проблем с масштабированием.
Внедрение PAT ведет к коренному изменению подходов к валидации технологических процессов. В этих условиях каждая произведенная серия продукции становится валидационной. Было привлечено внимание слушателей к новому руководству по валидации FDA США [3].
УПРАВЛЕНИЕ КАЧЕСТВОМ В ФАРМАЦИИ
Молодые фармацевты на приеме по случаю открытия конгресса
В регуляторной сфере возрастает число заявок на регистрацию новых препаратов с использованием нового подхода «Качество через дизайн» (QbD). В связи с этим получает новый импульс практика сотрудничества между экспертами, выполняющими оценку регистрационных досье,
иинспекторами по GMP. До настоящего времени такое взаимодействие осуществлялось в форме привлечения инспекторов к экспертизе разделов «Качество» досье. При переходе к заявкам на основе QbD, напротив, эксперты, работающие с заявками, привлекаются к обследованиям предприятий в целях оценки возможности производителя реализовать заявленное им «пространство дизайна».
Внедрение новых подходов не обходится без трудностей. Имеет место распространение ошибочных трактовок новых понятий. Некоторые специалисты, например, полагают, что «Качество через дизайн» и «Пространство дизайна» — одно
ито же. Высказывается мнение о том, что при переходе к выпуску серий в реальном времени становятся ненужными спецификации качества. Для разъяснения новых понятий и преодоления заблуждений в данной сфере сотрудники регуляторных органов выступают со статьями в специализированных журналах, публикуют документы с ответами на часто задаваемые вопросы (FAQ), проводят семинары и т.п.
Заслуживают внимания сообщения об опыте FDA США в сфере инспектирования фармпроизводителей. Инспекторский состав FDA по всей номенклатуре контролируемой продукции (пищевые продукты, лекарственные средства, медтехника и др.) включает 1 700 инспекторов в региональных отделениях, выполняющих обследования на территории США,около 400 инспекторов и 150 химиков-аналитиков, подготовленных для обследований зарубежных предприятий, а также небольшое число инспекторов, работающих исключительно за рубежом.
Помимо инспекторов (дознавателей) к обследованиям привлекаются химики-аналитики, специалисты в области GMP, эксперты, осуществляющие оценку регистрационных досье и другие специалисты.
МЕНЕДЖМЕНТ КАЧЕСТВА В СФЕРЕ ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ № 4 (10)/ 2011 99

УПРАВЛЕНИЕ КАЧЕСТВОМ В ФАРМАЦИИ
К приоритетам программы обследований в 2011 г. отно- |
Иначе говоря, большинство (две трети) нарушений ка- |
||
сятся: |
сались систем качества и работы контрольно- |
||
качество безрецептурных препаратов; |
аналитических лабораторий, тогда как на здания и обору- |
||
своевременность расследования инцидентов (жалобы, |
дование приходилась лишь одна седьмая замечаний. Эти |
||
брак) и устранение корневых причин; |
цифры в очередной раз подтверждают, что не техниче- |
||
системы качества и надежность данных; |
ские средства предприятия, при всей их важности, а орга- |
||
безопасность цепочки снабжения; |
низация и управление играют решающую роль в соблю- |
||
производство по контракту; |
дении правил GMP. |
|
|
программы квалификации поставщиков сырья и исхо- |
|
|
|
дных материалов; |
По тематике, относящейся к борьбе с фальсифицирован- |
||
борьба с предумышленной фальсификацией препаратов |
ными препаратами |
|
|
и ингредиентов; |
Обсуждение проблемы противодействия распростране- |
||
порядок сбора сообщений с рынка о браке; |
нию фальсифицированных препаратов было организовано |
||
порядок сбора сообщений с рынка о неблагоприятных |
в основном сотрудниками Секретариата ВОЗ и фирмы |
||
реакциях. |
Pfizer при участии руководства Администрации по контро- |
||
|
|
лю лекарств Индии и ряда обществен- |
|
|
|
ных организаций. Во вступительном со- |
|
Правительство Российской Федерации |
|
общении кратко излагалось содержа- |
|
|
ние дискуссий по данной проблеме на |
||
предпринимает активные шаги для скорейшего |
|||
ассамблеях ВОЗ последних лет. |
|||
перехода фармотрасли на стандарты GMP. Планами |
Отмечено существенное затрудне- |
||
ние для принятия решений на уровне |
|||
предусмотрены: перевод фармпроизводства на |
|||
ассамблеи в части мер борьбы с фаль- |
|||
инновационные рельсы, внедрение GMP к началу |
сификацией. Речь идет о тенденции де- |
||
2014 г., выпуск конкурентоспособных препаратов, |
легатов ассамблеи — министров здра- |
||
воохранения государств — членов орга- |
|||
8-кратный рост объема экспорта ЛС к 2020 г. |
|||
низации использовать в дискуссиях |
|||
В ряде регионов создаются фармкластеры. |
различные термины применительно к |
||
сомнительным лекарственным сред- |
|||
Минпромторг России намерен в кратчайшие сроки |
|||
ствам: препарат недоброкачественный, |
|||
присоединиться к международной системе |
фальшивый, поддельный, ложно марки- |
||
взаимного признания результатов инспектирования |
рованный, контрафактный и т.п. При |
||
этом каждый из этих терминов может |
|||
по правилам GMP (PIC/S). |
|
||
|
трактоваться различно. |
||
|
|
Подчеркивалось, что стратегически- |
|
|
|
ми направлениями борьбы с распро- |
|
|
|
странением лекарственных фальсифи- |
|
В ходе обследований первостепенное внимание обра- |
катов являются укрепление общей системы обеспечения |
||
щается на годовые отчеты по качеству, исследования по |
качества препаратов, повышение надежности системы фар- |
||
случаям выхода результатов анализа на пределы специфи- |
мацевтического снабжения, а также специальные исследо- |
||
каций (OOS), работу с жалобами. Наряду с этим проверяет- |
вания по выявлению масштабов проблемы и характера |
||
ся документация по сериям, отклоненным по причине де- |
подделок. |
|
|
фектов качества, отчеты о бракованной продукции, ото- |
Обсуждались такие подходы к решению проблемы, как |
||
званной из сети распределения. Также рассматриваются |
методы выявления подозрительных или некачественных |
||
меры по исправлению недостатков за период после преды- |
препаратов при визуальном осмотре, формы уведомления |
||
дущего обследования. |
надзорных органов о выявленных образцах сомнительного |
||
Типичные несоблюдения правил GMP, выявленные в ходе |
качества или происхождения, повышения осведомленности |
||
обследований зарубежных предприятий в 2009 финансо- |
потребителей (пациентов) в отношении признаков фальси- |
||
вом году, можно сгруппировать следующим образом: |
фикации и рисков использования поддельных лекарств, |
||
в системах обеспечения качества — 39%; |
междисциплинарное сотрудничество и взаимодействие. |
||
в организации производства дозированных форм — 10%; |
|
|
|
в системах управления материалами — 4%; |
О секции промышленной фармации |
||
касающиеся зданий и оборудования — 13%; |
Секция провела заседание оргкомитета и общее собра- |
||
в процессах упаковки и маркировки — 5%; |
ние членов секции, участвовавших в конгрессе. Информа- |
||
в организации лабораторной службы — 29%. |
ция о работе секции и частично о FIP уже была опубликова- |
||
100 МЕНЕДЖМЕНТ КАЧЕСТВА В СФЕРЕ ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ № 4 (10)/ 2011

на ранее [4]. На этот раз на заседании оргкомитета обсуждались следующие вопросы:
Подготовка программы секции в рамках следующего (юбилейного) конгресса.
Состояние вопроса с представлением отзывов на проекты рабочих документов ВОЗ.
Организация выборов новых постоянных членов оргкомитета.
Финансовый отчет казначея секции.
Врамках секции инициирован проект подготовки обзора механизмов регулирования лекарственного рынка ряда стран в сравнении с регуляторной системой ICH. На первом этапе планируется включить в обзор страны БРИКС: Бразилию, Россию, Индию, Китай и Южную Африку. Проект раздела по России подготовлен и передан на заключение отдельным членам оргкомитета.
Вэтой связи следует отметить целесообразность привлечения российских специалистов к работе комитета, первоначально в качестве ассоциированных членов. Через непродолжительное время они смогли бы быть избранными в состав полноправных членов оргкомитета, а в дальнейшем и на его руководящие посты: председатель, заместитель председателя, секретарь. Это позволило бы оказывать влияние на работу всей секции.
ДАЛЬНЕЙШАЯ РАБОТА ФЕДЕРАЦИИ
Следующий конгресс FIP намечено провести с 3 по 8 октября 2012 г. в Амстердаме (Нидерланды). Этот конгресс будет необычным. Прежде всего он совпадает со 100летним юбилеем федерации и потому будет проводиться особо торжественно. Кроме того, он увязан с саммитом по здравоохранению, который проводит Правительство Нидерландов в начале октября 2012 г. с приглашением министров здравоохранения всех стран. Тема саммита: преимущества ответственного использования медикаментов.
Подготовка юбилейного конгресса была начата еще в 2010 г. После завершения конгресса в Хайдарабаде она будет интенсифицирована. Ход подготовки программы отражается на сайте федерации (http://fip.org). Конгресс 2013 г. планируется провести в Дублине (Ирландия). При наличии приглашений с российской стороны члены оргкомитета секции промышленной фармации готовы приехать в Россию для консультаций, выступления с докладами и т.п.
НЕКОТОРЫЕ РАЗМЫШЛЕНИЯ ПОСЛЕ КОНГРЕССА
Итоги конгресса дают основание для некоторых размышлений об отечественном фармацевтическом секторе. Как известно, российские специалисты поддерживают контакты с иностранными коллегами. Коммерческие структуры используют мировой опыт в части организации бизнеса. Од-
УПРАВЛЕНИЕ КАЧЕСТВОМ В ФАРМАЦИИ
нако для многих работников сектора освоение зарубежного опыта сводится к заимствованию импортных словечек: дистрибуция (оптовая торговля), ритейл (розничная реализация), реимбурсация (возмещение затрат) и т.п. Очевидно, что их использование не создает дополнительных преимуществ для пациента (особенно при отсутствии этой самой реимбурсации для большинства населения).
Наряду с этим мировой опыт слабо используется для модернизации сектора. Такие общепринятые во всем мире понятия, как фармацевтическая забота, промышленная фармация, промышленный фармацевт, не получили в России официального признания.Правила оптовой и розничной торговли не гармонизированы с руководствами GDP и GPP, национальная фармакопейная программа в зачаточном состоянии. Требование в части непрерывного профессионального развития специалистов фармацевтического профиля отсутствует. Обязательное повышение квалификации принимает форму посещения краткосрочных курсов один раз в 5 лет.
В России нет общенациональной ассоциации специалистов фармацевтического профиля. Это одна из причин, по которым работники отрасли в организованном порядке не представлены в FIP. Не проводится фармацевтических конгрессов, хотя это является обычной практикой во многих странах.
Немало проблем, требующих решения, и в сфере фармпроизводства. Отсутствует утвержденный и пригодный к применению текст руководства по GMP, не создан инспекторат для проверки соблюдения правил. В отечественной регуляторной системе, как ни в одной стране мира, функции регистрации препаратов и инспектирования по GMP разделены между двумя ведомствами.
Лишь в самое последнее время признано, что нехватка высококвалифицированных кадров в фармпромышленности достигает 80% и более. При этом речь, как правило, идет о потребности заводов в технологах, имеющих некоторое представление о GMP. Вместе с тем упускается из виду необходимость повышения квалификации директорского состава предприятий, а также работников руководящих органов. Сообщается о том, что аттестованы некоторые сотрудники, выполняющие функции экспертов. При этом, однако, умалчивается о статусе лиц, осуществлявших аттестацию. Сказанное относится и к намеченной аттестации уполномоченных лиц предприятий отрасли.
Остается низким уровень понимания правил GMP работниками отрасли. Многие из них, например, ставят знак равенства между пригодным для контрактного производства участком и предприятием, выпускающим лекарственные препараты в условиях соблюдения правил GMP. Иначе говоря, смешиваются понятия: GMP-площадка и GMP-процессы. Приходится слышать о том, что правила GMP препятствуют выпуску таблеток в бумажных блистерах, тогда как форма упаковки конкретного препарата определяется интересами пациента, подтверждается исследованиями в рамках фармацевтической разработки и утверждается в процессе регистрации препарата.
МЕНЕДЖМЕНТ КАЧЕСТВА В СФЕРЕ ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ № 4 (10)/ 2011 101

УПРАВЛЕНИЕ КАЧЕСТВОМ В ФАРМАЦИИ
Отдельные инженеры вопреки международному консен- |
тие фармацевтической и медицинской промышленности |
|
сусу навязывают работникам отрасли мнение о ненужности |
Российской Федерации на период до 2020 г. и на дальней- |
|
руководства ICH Q9. В целом не учитываются мировые тен- |
шую перспективу» участие в конгрессе сократилось до ми- |
|
денции, меняющие характер правил GMP. В связи с этим по- |
нимума. |
|
пытки внедрения правил напоминают стрельбу по движу- |
|
Между тем информация о конгрессе своевременно пре- |
щейся цели. |
доставлялась заинтересованным специалистам и организа- |
|
Следует отметить, что Правительство Российской Феде- |
циям. Официальная программа распространялась по линии |
|
рации предпринимает активные шаги для скорейшего ис- |
FIP через публикации и Интернет. Более подробные сведе- |
|
правления неблагополучной ситуации. Планами преду- |
ния были доступны на сайте СПФО, публиковались и дово- |
|
смотрены: перевод фармпроизводства на инновационные |
дились до сведения ответственных сотрудников Минпром- |
|
рельсы, внедрение GMP к началу 2014 г., выпуск конкурен- |
торга России. |
|
тоспособных препаратов, 8-кратный рост объема экспорта |
|
Слабая представленность страны на конгрессе этого |
ЛС к 2020 г. В ряде регионов создаются фармкластеры. |
года вызывает серьезную озабоченность. Планы прави- |
|
Минпромторг России намерен в кратчайшие сроки присо- |
тельства о «большом скачке» в части модернизации фарм- |
|
единиться к международной системе взаимного призна- |
производства должны быть увязаны с реальными мерами, |
|
ния результатов инспектирования по правилам GMP |
могущими содействовать реализации этих планов. Сейчас |
|
(PIC/S). |
ситуация в отечественном фармпроме напоминает тако- |
|
Казалось бы, в этих условиях важной задачей отрасли |
вую в системе Минмедпрома СССР 70-х и 80-х гг. прошло- |
|
должно стать ускоренное освоение зарубежного опыта.Для |
го века. Тогда игнорировалась концепция GMP; в настоя- |
|
того чтобы сократить копившееся десятилетиями отстава- |
щее время то же самое происходит с отраслевыми руко- |
|
ние в данной сфере, необходимо, образно выражаясь, по- |
водствами ICH М4 (Общий технический документ—формат |
|
стараться вскочить в проносящийся мимо платформы поезд |
регистрационного досье), Q8 — Q11. Между тем использо- |
|
(to jump the bandwagon). Большие возможности в этом пла- |
вание этих руководств за рубежом ведет к коренному из- |
|
не предоставляет FIP, конгрессы которой в сочетании с ра- |
менению отраслевых регуляторных механизмов. |
|
ботой секций и групп по специальным интересам позволя- |
|
При этом, однако, имеются существенные различия. В со- |
ют широкому кругу специалистов отрасли общаться с зару- |
ветский период промышленность, в т.ч. фармацевтическая, |
|
бежными коллегами. |
была ориентирована на внутренний рынок и могла обой- |
|
В последние годы в конгрессах федерации участвовало, |
тись без международной гармонизации норм и правил. В |
|
как правило, по несколько российских специалистов. В про- |
настоящий момент отказ от гармонизации в этой сфере по- |
|
шлом году в Лиссабоне их число превысило 20 человек. |
служит существенным тормозом для выполнения федераль- |
|
Российские ученые также посылали свои материалы в виде |
ных целевых программ и расширения экспортного потен- |
|
стендовых сообщений без приезда на конгресс. Однако в |
циала фармпромышленности. |
|
текущем году после принятия правительством ФЦП «Разви- |
|
|
|
|
|
|
|
ЛИТЕРАТУРА |
|
|
1.Joint FIP/WHO guideline on good pharmacy practice: standards for |
|
|
quality of pharmaceutical services. WHO TRS 961, 2011, Annex 8. |
|
|
2. Regulation (EC) №1901/2006 of the European Parliament and of |
|
|
the Council of 12 December 2006 on medicinal products for paedi- |
|
|
atric use and amending Regulation (EEC) № 1768/92, Directive |
|
|
2001/20/EC, Directive 2001/83/EC and Regulation (EC) |
|
|
№726/2004. |
|
|
3. Guidance for Industry. Process Validation: General Principles and |
|
|
Practices. U.S. Department of Health and Human Services. Food and |
|
|
Drug Administration. January 2011. Current Good Manufacturing |
|
|
Practices (CGMP). Revision 1. |
|
|
4. Мешковский А.П. О работе секции промышленной фармации |
|
|
FIP. Менеджмент качества в сфере здравоохранения и социаль- |
|
|
ного развития, №1/2011, С. 94—99. |
|
|
|
102 МЕНЕДЖМЕНТ КАЧЕСТВА В СФЕРЕ ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ № 4 (10)/ 2011

УПРАВЛЕНИЕ КАЧЕСТВОМ В ФАРМАЦИИ
О.А. Каштанова1
Р.С. Сафиуллин2
д.ф.н., проф.
Г.И. Хусаинова2
к.ф.н.
Я.В. Грибова2
к.ф.н.
2367492@mail.ru
РАЗРАБОТКА ИНТЕГРАЛЬНО-БАЛЛЬНОЙ ОЦЕНКИ РЕЗУЛЬТАТОВ АУДИТА СУБЪЕКТОВ ОБРАЩЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ НА ТЕРРИТОРИИ АСТРАХАНСКОЙ ОБЛАСТИ
1 ОГУЗ «Центр качества лекарственных средств», г. Астрахань;
2 ГБОУ ВПО «Казанский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации, г. Казань
Каштанова О.А., Сафиуллин Р.С., Хусаинова Г.И., Грибова Я.В. Разработка интегрально-балльной оценки результатов аудита субъектов обращения лекарственных средств на территории Астраханской области
С целью определения возможных путей оптимизации процессов, происходящих в ходе проведения проверок субъектов обращения ЛС, было проведен хронометраж отдельных операций при проведении проверок.
В результате хронометражных наблюдений операций все проверяемые показатели проранжированы по степени влияния на обеспечение качества и сохранность исходных свойств ЛС в аптеке (X, Y, Z). Для оценки результатов аудита показатели X, Y, Z оцениваются количественно с использованием коэффициентов критичности, разработанных и предлагаемых авторами.
На основе разработанной интегрально-балльной оценки качества деятельности проверяемых был создан компьютерный модуль для оценки результатов аудита субъектов обращения ЛС, который позволяет сократить временные затраты на проведение аудита, ранжировать результаты оценок по степени их влияния на качество ЛС.
Ключевые слова: лекарственные средства, оценка качества, аудит качества, интегрально-балльная оценка результатов аудита.
Kashtanova O.A., Safiullin R.S., Khusainova G.I.,Gribova Ya.V. Development of integrated and numerical score evaluation of the audit results with respect to the subjects of drug circulation in the Astrakhan Region
To determine the possible ways for optimization of processes which occur in the course of inspection of subjects of drug circulation, the individual operation timing in performing checks has been performed.
As a result of the individual operation timing, all indices have been ranked by degree of influence on the assurance of quality and maintenance of original qualities of drugs in the pharmacy (X, Y, Z). In order to evaluate the audit results, X, Y, Z indices are evaluated quantitatively using the criticality factors developed and proposed by the authors.
On the basis of the developed integrated and numerical score evaluation of inspector activity quality was created a computer module for evaluation of the audit results with respect to the subjects of drug circulation which makes it possible to reduce temporal expenses for audit, to rank the evaluation results by degree of influence on drug quality.
Key words: drugs, evaluation of quality, quality audit, integrated and numerical score evaluation of the audit results.
Президент России Д.А. Медведев в своем ежегодном Послании Федеральному собранию Российской Федерации подчеркнул особую важность обеспечения населения качественными, эффективными и безопасными лекарственными средствами (ЛС), а также указал на необходимость модернизации управленческих процессов, регу-
лирующих обращение ЛС и здравоохранение в целом. Несмотря на принимаемые меры, проблемы, связанные с
проникновением недоброкачественных и фальсифицированных ЛС на отечественный фармацевтический рынок, остаются по-прежнему острыми и злободневными. Вопросы их своевременного выявления и оперативного изъятия из обращения находятся в центре внимания органов управления здравоохранением на федеральном и региональном уровнях.
Вторым важным аспектом обеспечения качества ЛС является соблюдение условий их хранения,т.к.под действием неблагоприятных внешних факторов они могут прийти в негодность, потерять эффективность и стать небезопасными.
Ответственность за сохранение качества ЛС лежит и на участниках сферы доведения продукции фармацевтических производителей до конечного потребителя: дистрибьюторах и предприятиях оптовой торговли ЛС, включая систему транспортирования ЛС; розничной сети; лечебнопрофилактических учреждениях, закупающих ЛС для обеспечения лечебного процесса, а также на некоторых учреждениях социальной сферы и сферы образования, оказывающих различные виды медицинской помощи.
В современных условиях социально-экономических реформ, формирования рыночных отношений и жесткого государственного регулирования фармацевтической деятельности необходима рационализация системы контроля за субъектами обращения ЛС, в частности,в виде внешнего аудита.
Вопросы соответствия осуществляемой субъектами фармацевтического рынка деятельности по обеспечению качества ЛС на этапах реализации и применения на уровне региона и выработка предложений по повышению эффектив-
МЕНЕДЖМЕНТ КАЧЕСТВА В СФЕРЕ ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ № 4 (10)/ 2011 103

УПРАВЛЕНИЕ КАЧЕСТВОМ В ФАРМАЦИИ
ности проверок указанной деятельности были положены в |
другие субъекты обращения ЛС, имеющие лицензии на осу- |
||
основу проведенного нами исследования. |
ществление фармацевтической или медицинской деятель- |
||
С целью определения возможных путей оптимизации |
ности: учреждения социальной защиты населения, школь- |
||
процессов, происходящих в ходе проведения проверок ап- |
ные и дошкольные учреждения и др. Поэтому было решено |
||
течных организаций, лечебно-профилактических учрежде- |
в качестве объектов для исследования остановиться на та- |
||
ний и других субъектов обращения ЛС, было проведено |
кой более однородной группе объектов, как аптечные |
||
хронометрическое изучение нормативов времени, затра- |
учреждения. |
|
|
чиваемых на отдельные операции при проведении прове- |
В качестве одного из основных факторов, влияющих на |
||
рок. |
объем проверок, и, следовательно, на время их проведения, |
||
Для реализации поставленной цели предполагалось ре- |
выделены объем товарных запасов и число ассортимент- |
||
шить следующие задачи: |
ных позиций ЛС и других товаров аптечного ассортимента. |
||
изучить временные затраты при проведении отдельных |
Объекты проверок были ранжированы по числу ассорти- |
||
операций в ходе проверок; |
ментных позиций. На аптеки с числом ассортиментных по- |
||
выявить наиболее важные критерии, оказывающие влия- |
зиций менее 5 000, от 5 000 до 10 000 и свыше 10 000 по- |
||
ние на обеспечение качества ЛС; |
зиций. |
|
|
разработать технико-экономическое задание с целью |
В результате хронометражных наблюдений операций, |
||
создания компьютерного модуля для интегрально-балльной |
осуществляемых экспертами при проведении проверок, все |
||
оценки результатов аудита субъектов обращения ЛС. |
проверяемые показатели проранжированы по степени вли- |
||
Изучение затрат времени было проведено с помощью |
яния на обеспечение качества и сохранность исходных |
||
хронометража. Сама процедура хронометражных измере- |
свойств ЛС в аптеке (X, Y, Z), где |
||
ний включала в себя три этапа: подготовка к наблюдению, |
X — показатели, соблюдение которых не оказывает зна- |
||
проведение наблюдения, обработка и анализ результатов |
чительного влияния непосредственно на качество самих |
||
наблюдения. Наблюдение проводили методом непрерыв- |
ЛС; |
|
|
ного хронометража. При этом наблюдатель фиксировал мо- |
Y — показатели, несоблюдение которых может повлиять |
||
мент окончания первой операции и всех последующих без |
на сохранность качества ЛС; |
||
остановки секундомера. |
Z — показатели, несоблюдение которых оказывает непо- |
||
|
|
средственное влияние на обеспечение |
|
|
|
качества ЛС в аптеке. |
|
|
|
Пример хронометражных наблюде- |
|
Ответственность за сохранение качества ЛС лежит |
ний отдельных операций, осуществляе- |
||
мых экспертами при проведении про- |
|||
и на участниках сферы доведения продукции фар- |
верок, приводятся в таблице. |
||
мацевтических производителей до конечного по- |
Далее для оценки результатов аудита |
||
показатели X, Y, Z оцениваются количе- |
|||
требителя. В современных условиях социально- |
|||
ственно с использованием коэффици- |
|||
экономических реформ, формирования рыночных |
ентов критичности, разработанных и |
||
отношений и жесткого государственного регулиро- |
предлагаемых авторами: Кх, КУ, Кz, где |
||
Кх = 0,1 — т.к. степень критичности по- |
|||
вания фармацевтической деятельности необходима |
|||
казателя X не оказывает влияния на ка- |
|||
рационализация системы контроля за субъектами |
чество ЛС; |
||
КУ = 0,3 — т.к. степень критичности по- |
|||
обращения ЛС, в т.ч. в виде внешнего аудита. |
|||
казателя Y может повлиять на качество |
|||
|
|
ЛС; |
|
|
|
Кz = 0,6 — т.к. степень критичности по- |
|
|
|
казателя Z оказывает непосредствен- |
|
Объекты, в которых проводятся проверки обеспечения |
ное влияние на качество ЛС. |
||
качества ЛС, имеют значительные различия между собой. |
Сумма Σ (Кх + КУ + Кz) = 1. |
||
Это могут быть аптечные организации различных |
На следующем этапе разработано технико-экономичес- |
||
организационно-правовых форм собственности, а также с |
кое задание с целью создания компьютерного модуля для |
||
различным характером производственной деятельности; |
интегрально-балльной оценки результатов аудита субъек- |
||
лечебно-профилактические учреждения с различными про- |
тов обращения ЛС. |
|
|
филями медицинской помощи и сильно отличающимся ко- |
Компьютерный модуль предназначен для оценки каче- |
||
ечным составом, наличием или отсутствием функционально |
ства деятельности аптечных организаций, лечебно- |
||
обособленных подразделений и их географическим распо- |
профилактических учреждений здравоохранения, учреж- |
||
ложением, особенно в сельской местности. Это могут быть и |
дений системы образования и социальной защиты населе- |
||
104 МЕНЕДЖМЕНТ КАЧЕСТВА В СФЕРЕ ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ № 4 (10)/ 2011
УПРАВЛЕНИЕ КАЧЕСТВОМ В ФАРМАЦИИ
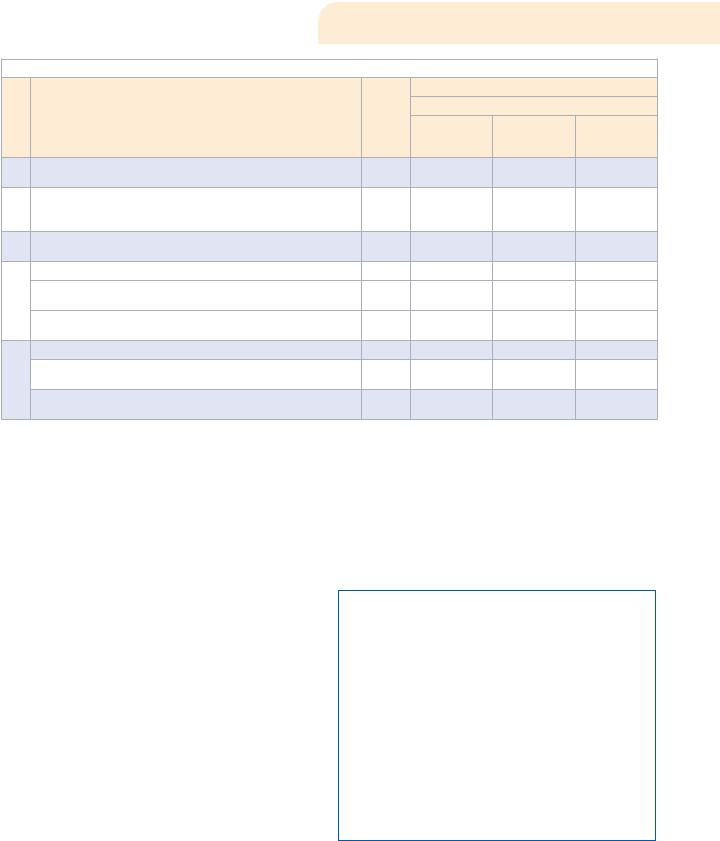
Таблица. Хронометражное наблюдение отдельных операций, осуществляемое экспертами при проведении проверок
№
Характеристика отдельных операций, осуществляемых экспертами при проведении проверок
1.Ознакомление руководителя с целями и объектами при проведении проверки
2.Рассмотрение документов, подтверждающих право на осуществление фармацевтической деятельности и закрепляющих право владения помещениями, в которых осуществляется проверка
3.Осмотр помещений, в которых осуществляется фармацевтическая деятельность с целью установления соответствия их установленным требованиям
4.Проверка наличия приборов и оборудования для хранения ЛС, включая:
—стеллажи, шкафы, кондиционеры, холодильники, торговое оборудование, сейфы и проч.
—приборы для регистрации параметров воздуха и своевременность их поверки
5.Проверка параметров хранения ЛС в аптечном учреждении, включая:
—документальное подтверждение организации ежедневного учета температуры и влажности во всех помещениях хранения ЛС и в торговом зале
определение температуры и влажности в помещениях размещения ЛС на момент проверки
Степень |
критичности |
показателя |
|
Х |
|
|
Х |
|
Х
Z
Z
Y
Z
Z
Z
Время, затрачиваемое на отдельные операции, мин.
Число ассортиментных позиций в аптеке
5 000—10 000 < 5 000 позиций 10 000 позиций
позиций
6,6 |
6,6 |
6,6 |
14,3 |
14,3 |
14,3 |
6,2 |
8,3 |
10,4 |
9,1 |
12,4 |
15,2 |
5,6 |
6,7 |
8,3 |
4,6 |
5,9 |
8,3 |
7,5 |
9,3 |
11,5 |
ния, оказывающих медицинскую помощь населению, связанную с обеспечением качества и сохранности исходных свойств товаров аптечного ассортимента в соответствии с требованиями нормативной документации.
Разработанный нами «Компьютерный модуль для оценки результатов аудита субъектов обращения лекарствен-
ных средств», на который в настоящее время получено свидетельство о государственной регистрации программы для ЭВМ, позволяет сократить временные затраты на проведение аудита, ранжировать результаты оценок по степени их влияния на качество ЛС. Данный модуль является универсальным для всех субъектов Российской Федерации.
ЛИТЕРАТУРА
1.Пархоменко Д.В. Фальсификация лекарственных средств: состояние проблемы и современные подходы к ее решению/Д.В. Пархоменко//Новая аптека.— 2008.— №8.— С. 31—38.
2.Анализ деятельности ОГУЗ «Центр качества лекарственных средств по выявлению фальсифицированных лекарственных средств в Астраханской области/О.А. Каштанова, Р.С. Сафиуллин, А.Р.Умерова, Я.В. Грибова, Г.И. Хусаинова//Астраханский медицинский журнал.— 2010.— Т. 5, №2.— С.122—126.
3.Хачатрян М.М. Модель системы противодействия фальсификации на региональном рынке/М.М. Хачатрян//Новая аптека. — 2010.— №7.— С. 66.
4.Викулова К.А. Организационно—методические рекомендации к проведению аудита фармацевтических организаций (на примере Тюменской области): Автореферат дисс. … канд. фарм. наук/ К.А.Викулова. — Тюмень: Издательский центр ГОУ ВПО ТюмГМА МЗ РФ, 2004.— 26 с.
МЕНЕДЖМЕНТ КАЧЕСТВА В СФЕРЕ ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ № 4 (10)/ 2011 105

КОНТРОЛЬ КАЧЕСТВА
Е.А.Тельнова
д.ф.н., проф. telnovaEA@roszdravnadzor.ru
О ГОСУДАРСТВЕННОЙ СИСТЕМЕ КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ
Федеральная служба по надзору в сфере здравоохранения и социального развития
Тельнова Е.А. О государственной системе контроля качества лекарственных средств
В статье рассматривается система государственного контроля качества фармацевтической продукции, результативность ее функционирования и перспективы развития по обеспечению качества лекарственных средств. Приведены данные по количеству выявленных недоброкачественных и фальсифицированных лекарственных средств, фармаконадзору и контролю за проведением клинических исследований лекарственных препаратов.
Ключевые слова: лекарственные средства, государственный контроль качества, фармаконадзор, клинические исследования.
Telnova E.A. State System for Quality Control of Medicines
The article describes the state system for quality control of pharmaceutical products, effectiveness of its operation and growth prospects in respect of ensuring quality of medicines. The article provides data on quality of detected poor-quality and counterfeit drugs, pharmaceutical supervision and control over clinical drug trials.
Key words: medicines, state control of quality, pharmaceutical supervision, clinical trials.
Наши усилия по повышению качества медицинской помощи должны опираться на мощную технологическую базу, на современную фармацевтическую индустрию… Мы должны достичь стратегической цели — за счет собственного производства обеспечить потребность страны в лекарственных препаратах и медицинской технике.
Председатель Правительства В.В. Путин, 8 декабря 2010 г.
ВВЕДЕНИЕ
Одной из приоритетных задач в области здравоохранения является обеспечение качества лекарственных средств, находящихся в обращении на фармацевтическом рынке. На это в настоящее время выделяются значительные финансовые средства как из бюджета, так и отечественными и зарубежными инвесторами.
Задачи поставлены амбициозные. Но суть их состоит не в том, чтобы просто увеличить объемы фармацевтической продукции, а в том, чтобы создать современные производства, обеспечивающие выпуск качественных, высокоэффективных и инновационных лекарственных средств.
Вопрос качества лекарственных средств нашел свое отражение и в Стратегии национальной безопасности,утвержденной Указом Президента Российской Федерации, в которой отмечено, что к стратегическим целям национальной безопасности в сфере здравоохранения, наряду с совершенствованием стандартов медицинской помощи, относится совершенствование контроля качества, эффективности и безопасности лекарственных средств.
Качество лекарственных средств на фармацевтическом рынке регулируется государством на федеральном уровне. Политика в области обращения лекарственных средств формируется в Минздравсоцразвития России.
Основными нормативными документами, обеспечивающими процесс государственного контроля качества лекарственных средств, являются федеральные законы от 12.04.2010 №61-ФЗ «Об обращении лекарственных средств», от 27.12.2002 (в редакции от 28.09.2005) №184ФЗ «О техническом регулировании», а также ФЗ «Об основах охраны здоровья граждан в Российской Федерации». от 21.11.2011 №323-ФЗ.
СИСТЕМА ГОСУДАРСТВЕННОГО КОНТРОЛЯ КАЧЕСТВА
ФАРМАЦЕВТИЧЕСКОЙ ПРОДУКЦИИ
Начиная с 2004 г. в России сформировалась система контроля и надзора за качеством лекарственных средств (рис. 1). Существующий порядок работы позволяет своевременно выявлять и изымать из обращения лекарственные средства, качество которых не отвечает установленным требованиям, а подлинность вызывает сомнения. Это является серьезным барьером, позволяющим предотвратить попадание на фармацевтический рынок недоброкачественных, фальсифицированных и контрафактных лекарственных средств.
Многоступенчатая система функционирует на всех этапах жизненного цикла лекарственного препарата: от момента его разработки (доклинические исследования), госу-
106 МЕНЕДЖМЕНТ КАЧЕСТВА В СФЕРЕ ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ № 4 (10)/ 2011

|
|
|
|
|
КОНТРОЛЬ КАЧЕСТВА |
|
|
|
|
|
|
Потребитель |
|
|
|
|
|
|
CONSUMER |
|
Доклинические |
Клинические |
Государственная |
|
Оптовая |
|
|
(лабораторные) |
|
Розничная |
||||
исследования |
регистрация |
Производство |
торговля |
|||
исследования |
торговля |
|||||
Clinical |
Clinical |
Manufacturing |
Wholesale |
|||
Laboratory |
Retail trade |
|||||
researches |
researches |
|
trade |
|||
researches |
|
|
||||
|
|
|
|
|
||
|
|
|
|
|
Уничтожение |
|
|
|
|
|
|
некачественных или |
|
|
|
|
|
|
просроченных ЛС |
|
|
|
Оценка условий производства |
Надзор за участниками обращения |
|||
|
|
и надзор за производством |
и ФАРМАКОНАДЗОР |
|||
Рисунок 1. Система обеспечения качества |
|
СТАНДАРТИЗАЦИЯ |
|
|||
|
Standardization |
|
||||
фармацевтических продуктов |
|
|
||||
Рисунок 2. Система государственного контроля качества лекарственных средств |
|
|
||||
|
СИСТЕМА ГОСУДАРСТВЕННОГО КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ |
|||||
Оценка эффективности |
|
Мониторинг качества, |
|
|
безопасности и качества |
Экспертиза качества ЛС, |
|
||
эффективности |
|
|||
на ЛС при регистрации |
находящихся |
Инспекционный |
||
и безопасности |
||||
(на опытно-промышленных |
в гражданском обороте |
контроль |
||
лекарственных средств, |
||||
или промышленных |
(проводится выборочно) |
|
||
находящихся в обращении |
|
|||
образцах) |
|
|
||
|
|
|
Инструментами данной системы, помимо центрального аппарата Росздравнадзора, являются:
территориальные управления Росздравнадзора;
испытательные лаборатории;
единая информационная система;
система качества в организациях — производителях лекарственных средств, розничных и оптовых фармацевтических организациях
дарственной регистрации или допуска лекарственного пре- |
гистрации; |
парата на рынок до оценки условий производства и |
выборочную экспертизу качества лекарственных средств, |
надзора за производством лекарственных средств. |
находящихся в гражданском обороте; |
После попадания лекарственного препарата на рынок |
мониторинг качества, эффективности и безопасности ле- |
осуществляется надзор за его обращением в условиях опто- |
карственных средств; |
вой и розничной торговли и мониторинг его безопасности. |
инспекционный контроль. |
Система государственного контроля качества лекар- |
Инструментами данной системы, помимо центрального |
ственных средств в Российской Федерации (рис. 2) включа- |
аппарата Росздравнадзора, являются: |
ет в себя: |
территориальные управления Росздравнадзора; |
оценку эффективности, безопасности и утверждение |
аккредитованные Ростехрегулированием испытательные |
стандартов качества на лекарственные средства при их ре- |
лаборатории; |
МЕНЕДЖМЕНТ КАЧЕСТВА В СФЕРЕ ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ № 4 (10)/ 2011 107

КОНТРОЛЬ КАЧЕСТВА |
|
|
||
Рисунок 3. Основные составляющие государственной системы контроля качества лекарственных средств |
||||
|
|
1 |
|
|
|
|
КОНТРОЛЬ ПРОВЕДЕНИЯ |
|
|
|
|
КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ |
|
|
|
|
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ |
|
|
8 |
ВЗАИМОДЕЙСТВИЕ |
|
2 |
|
|
|
|
||
С ОБЩЕСТВЕННЫМИ ОРГАНИЗАЦИЯМИ |
|
|
||
|
В СФЕРЕ ОБРАЩЕНИЯ |
|
КОНТРОЛЬ ПРОИЗВОДСТВА |
|
|
ЛЕКАРСТВЕННЫХ СРЕДСТВ |
|
ЛЕКАРСТВЕННЫХ СРЕДСТВ |
|
|
(АССОЦИАЦИЯМИ ПРОИЗВОДИТЕЛЕЙ, |
|
|
|
АПТЕЧНЫМИ ОРГАНИЗАЦИЯМИЙ И ДР.) |
|
|
||
7 |
|
ОСНОВНЫЕ СОСТАВЛЯЮЩИЕ |
3 |
|
ВЗАИМОДЕЙСТВИЕ |
СИСТЕМЫ |
ВЫЯВЛЕНИЕ НЕДОБРО |
||
КАЧЕСТВЕННЫХ И ФАЛЬСИФИЦИРО |
||||
С ПРАВООХРАНИТЕЛЬНЫМИ |
ГОСУДАРСТВЕННОГО |
|||
ВАННЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ |
||||
ОРГАНАМИ |
КОНТРОЛЯ КАЧЕСТВА |
|||
В РАМКАХ МОНИТОРИНГА КАЧЕСТВА |
||||
|
|
ЛЕКАРСТВЕННЫХ СРЕДСТВ |
|
|
6 |
|
|
4 |
|
|
МОНИТОРИНГ БЕЗОПАСНОСТИ |
|
ВЫБОРОЧНЫЙ |
|
|
|
КОНТРОЛЬ КАЧЕСТВА |
||
|
ЛЕКАРСТВЕННЫХ СРЕДСТВ |
|
ЛЕКАРСТВЕННЫХ СРЕДСТВ |
|
|
|
5 |
|
|
|
|
КОНТРОЛЬ ЗА КАЧЕСТВОМ |
|
|
|
|
И ДОСТОВЕРНОСТЬЮ ИСПЫТАНИЙ |
|
|
|
|
ЛЕКАРСТВЕННЫХ СРЕДСТВ |
|
|
единая информационная система Росздравнадзора; |
|
система качества в организациях-производителях лекар- |
ВЫЯВЛЕНИЕ НЕДОБРОКАЧЕСТВЕННОЙ И |
ственных средств, розничных и оптовых фармацевтических |
ФАЛЬСИФИЦИРОВАННОЙ ФАРМАЦЕВТИЧЕСКОЙ ПРОДУКЦИИ |
организациях. |
|
На сегодняшний день в Российской Федерации функцио- |
Работоспособность системы контроля качества под- |
нируют 94 испытательные лаборатории, аккредитованные |
тверждается тем, что ежегодно выявляется и пресекается |
на техническую компетентность и независимость, в т.ч. 54 |
обращение более 1 000 серий недоброкачественных ле- |
центра контроля качества лекарственных средств субъек- |
карственных средств отечественного и зарубежного произ- |
тов Российской Федерации и 40 ведомственных испыта- |
водства. Динамика их выявления за период 2005—2011 гг. |
тельных лабораторий. |
представлена на рисунках 4, 5. |
Главным инструментом системы государственного кон- |
Анализ показывает, что среди основных показателей не- |
троля является Росздравнадзор, его центральный аппарат и |
соответствия изъятых из обращения лекарств чаще других |
территориальные управления, которые посредством кон- |
встречается описание, упаковка и маркировка (рис. 6), а в |
троля и надзора обеспечивают соблюдение законности в |
структуре недоброкачественных лекарственных средств |
сфере здравоохранения, реализуют государственную поли- |
лидируют жидкие лекарственные формы (рис. 7). |
тику в сфере обеспечения доступности и качества медицин- |
Серьезную угрозу жизни и здоровью граждан представля- |
ской помощи, в т.ч. лекарственного обеспечения. |
ют фальсифицированные лекарственные препараты. Работа |
Основные составляющие государственной системы кон- |
по предотвращению поступления на фармацевтический ры- |
троля качества лекарственных средств представлены на ри- |
нок фальсифицированных препаратов была начата практи- |
сунке 3 — от контроля за клиническими исследованиями ле- |
чески с момента организации Росздравнадзора (рис. 8, 9). |
карственных препаратов, контроля производства лекар- |
Благодаря комплексу мер, в т.ч. межведомственному взаи- |
ственных средств, фармаконадзора до взаимодействия с |
модействию с правоохранительными органами, Таможен- |
правоохранительными органами и общественными органи- |
ной службой, в Российской Федерации за период с 2005 г. |
зациями. |
оборот фальсифицированных препаратов снизился практи- |
108 МЕНЕДЖМЕНТ КАЧЕСТВА В СФЕРЕ ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ № 4 (10)/ 2011
