
Методич.для заочн.(Химия)
.pdfВВЕДЕНИЕ
Химия – одна из фундаментальных естественных наук, изучающая химическую форму движения материи, наука о веществах
иих превращениях. Глубокое понимание законов химии и их применение позволяет не только формировать научное мировоззрение, но и совершенствовать существующие и создавать новые процессы, машины, установки, приборы. Разработанный практикум отражает все основные разделы и понятия курса химии и адаптирован для студентов заочного отделения.
Цель данного методического пособия – углубление знаний по курсу химии для более осмысленного их применения в условиях производства. Выполнение заданий, изложенных в практикуме, позволяет понять важность теоретических основ курса для оценки свойств химических веществ на различных уровнях организации системы: на уровне атома, молекулы, вещества, и более сложных, таких как растворы, электрохимические системы. Программа методического пособия способствует усвоению методов оценки вероятности различных химических реакций и создает базу для понимания особенностей физико-химических процессов, протекающих при обработке металлов и сплавов, в химических источниках тока, коррозионных процессах.
Основной задачей практикума является формирование умений
инавыков выполнения различных упражнений и решения расчетных задач по курсу химии. Алгоритм решения включает в себя осмысление всех химических терминов, заложенных в условие, постановку задачи в конкретных терминах, последовательность расчетов и выбор необходимых параметров из справочной литературы.
Методология практикума учитывает специфику заочного отделения. По каждому разделу курса химии определяется конкретное задание. Дается определение и анализ физического смысла понятий, требуемого для выполнения упражнений или расчетов. Подробно рассматривается последовательный переход от одной стадии решения задачи к другой с введением дополнительных объяснений, восполняющих пробел знаний, связанных с большим разрывом по времени между обучением в средней школе и ВУЗе.
6

Выполнение задания поясняется на конкретном примере, аналогичном тому, которое требуется для выполнения студентом.
Для выполнения заданий практикума студент должен прежде всего ознакомиться с теоретическим курсом химии.
Контрольную работу по химии следует выполнять в отдельной тетради с оформлением титульного листа, включающего название учебного заведения, номера варианта, Ф.И.О. студента, номера группы.
Для выполнения работы необходимо выписать номера заданий по темам, соответствующих варианту, которые указаны в конце практикума.
При оформлении задания отмечается тема раздела, записывается условие задачи и ход решения. Последовательность всех записей должна соответствовать приведенным в практикуме примерам с включением определений, реакций и объяснением деталей расчетов.
Таблицы с заданием по вариантам приводятся в конце каждого раздела. Справочные данные прилагаются в конце практикума.
Контрольная работа регистрируется в деканате и сдается преподавателю на проверку. При обнаружении ошибок студентом вводятся поправки. Далее предусматривается защита контрольной работы с объяснением всего объема выполненной работы.
7
Содержание
|
стр. |
Введение |
4 |
Тема I. СТРОЕНИЕ АТОМА |
6 |
Тема II. ХИМИЧЕСКАЯ СВЯЗЬ |
15 |
Тема III. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА |
28 |
Тема IV. ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ |
33 |
РАВНОВЕСИЕ |
|
Тема V. ДИСПЕРСНЫЕ СИСТЕМЫ |
39 |
Тема VI. ОСНОВЫ ЭЛЕКТРОХИМИИ |
52 |
ПРИЛОЖЕНИЕ 1 |
64 |
ПРИЛОЖЕНИЕ 2 |
65 |
ПРИЛОЖЕНИЕ 3 |
67 |
Список литературы |
69 |
Распределение заданий по вариантам |
70 |
8
Тема I. СТРОЕНИЕ АТОМА
Задание 1.1. Для приведенных в варианте (табл. I.1) 4-х химических элементов определить:
1.1.1.группу и период, в которых находится данный элемент
впериодической таблице Д.И. Менделеева;
1.1.2.электронную формулу атома элемента и указать, к какому семейству относится данный элемент;
1.1.3.валентные электроны, перечислить все теоретически возможные степени окисления для нормального и возбужденного состояния атома и привести примеры соединений, в которых данный элемент имеет разные степени окисления;
1.1.4.как изменяются радиус атома, энергия ионизации, электроотрицательность, окислительные и восстановительные свойства по периодам и группам таблицы Д.И. Менделеева.
Пример решения 1.1
|
|
Элемент 34Se (Селен) |
|
1.1.1. |
Исходя |
из положения данного элемента в |
таблице |
Д.И. Менделеева (Приложение I) определяем, что селен, имеющий |
|||
порядковый номер 34, находится в 4 периоде и VI A группе. |
|
||
1.1.2. |
Чтобы |
записать электронную формулу атома |
селена |
воспользуемся общей формулой распределения электронов по
энергетическим уровням и подуровням:
1s22s22p63s23p64s23d104p65s24d105p66s25d14f145d2-106p67s26d15f146d2-10 ...,
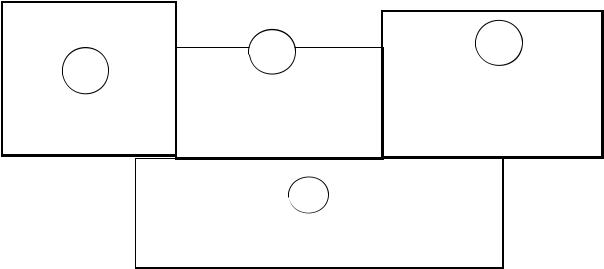
и представленной ниже схемой (рис. 1.1), на которой показаны валентные электроны, т. е. электроны, участвующие в связи. Записываем электронную формулу, валентные электроны и
определяем, к какому семейству относится данный элемент. Электронная формула селена: 1s22s22p63s23p64s23d104p4.
Валентные электроны находятся на 4-м энергетическом уровне: 4s24p4. Так как последний электрон на р-подуровне, то селен относится к элементам р-семейства.
9
|
|
|
p |
s |
|
d |
|
|
|
||
|
|
|
|
ns |
1-2 |
ns2(n-1)d1-10 |
ns2np1-6 |
|
|
||
|
|
|
|
f
ns2(n-1)d1(n-2)f1-14
Рис. 1.1. Схема распределения валентных электронов для атомов элементов в семействах (s, p, d, f):
n – номер периода, цифрами указано возможное количество валентных электронов
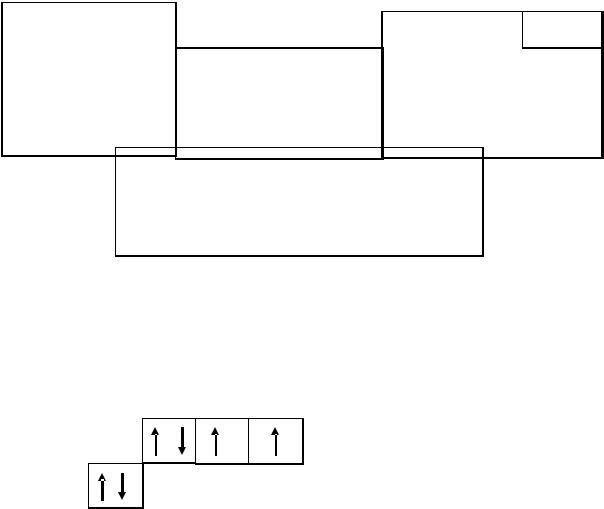
1.1.3. Чтобы записать степени окисления элемента, нужно иметь ввиду, что степень окисления – это условный заряд атома в соединении, указывающий сколько электронов оттянуто или притянуто к атому элемента. Все металлы способны только отдавать электроны, они находятся слева от границы Цинтля, проходящей по линии, соединяющей элементы 5В и 85At. Отдавая электроны, атом элемента приобретает положительный заряд. Все металлы являются восстановителями. Справа от границы Цинтля находятся элементы, которые являются окислителями.
Самый электроотрицательный элемент – 9F. Это самый сильный окислитель. Фтор способен только принимать электроны и, кроме степени окисления, равной "0" (в соединении F2) может иметь степень окисления 1-. Остальные элементы, расположенные между границей Цинтля и фтором, несмотря на преимущественные окислительные свойства могут как отдавать, так и принимать электроны и имеют степени окисления как со знаком "+", так и со знаком "-" в зависимости от атома элемента, вступающего с ним в связь. Знаки при степенях окисления показаны на схеме (рис. 1.2).
10
|
|
|
|
|
В |
|
|
|
|
F0, 1- |
|
|
|
|
|
|
|
|
|
|
|
||
0 + |
|
|
|
|
|
|
|
|
– 0 + |
||
|
|
|
|
|
|
|
|
||||
|
0 |
+ |
|
0 |
+ |
|
|||||
|
|
|
|
|
At |
||||||
|
|
|
|
|
|
||||||
|
|
0 |
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 1.2. Знаки степеней окисления элементов в таблице Д.И. Менделеева
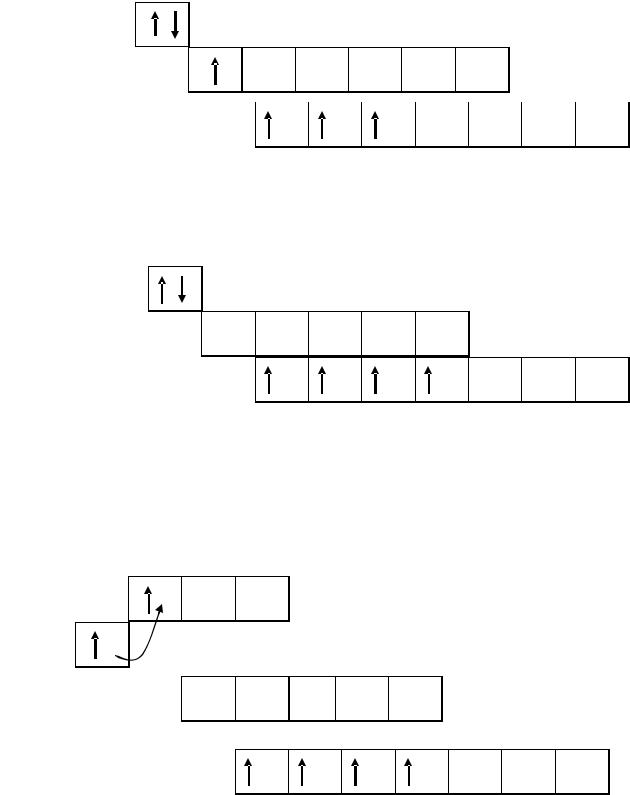
Чтобы определить степени окисления селена записываем валентные электроны для селена в нормальном состоянии.
4р
4s
Согласно схеме (рис. 1.2), селен может не только принимать, но и отдавать электроны.
Учитывая число "посадочных мест", определяем, что селен может принять 1 или 2 электрона, а имея в виду, что неспаренных электронов также 2, делаем вывод, что селен может отдать 1 или 2 электрона. Селен в нормальном состоянии имеет следующие степени окисления: 2–, 1–, 0, 1+, 2+, устойчивыми из них являются 2–, 0, 2+.
Далее записываем валентные электроны для селена в возбужденном состоянии. При получении дополнительной энергии происходит распаривание неподеленных пар электронов. Электроны переходят в более высокое энергетическое состояние. Следует отметить, что переход электронов происходит только в пределах внешнего уровня, в данном случае четвертого.
11
4d 

4p
4s
Ввозбужденном состоянии увеличиваются возможности селена
котдаче электронов, поэтому теоретически возможные степени окисления Se в возбужденном состоянии атома следующие: 2-, 1-, 0, 1+, 2+, 3+, 4+, 5+, 6+. Однако устойчивыми степенями окисления являются: 2-, 0, 2+, 4+, 6+.
Приведем примеры соединений, в которых селен имеет различные степени окисления (табл. 1.1). В случае затруднений при ответе на данный вопрос следует воспользоваться учебниками по химии для ВУЗов.
|
|
Таблица 1.1 |
|
|
|
|
|
Степень окисления |
Формула соединения |
Название |
|
0 |
Se |
Селен |
|
2- |
H2Se |
Селенистый водород |
|
4+ |
H2SeO3 |
Селенистая кислота |
|
6+ |
H2SeO4 |
Селеновая кислота |
|
1.1.4. В справочной литературе приводятся разные выражения для радиуса атома (металлический, орбитальный, эффективный и др.). За эффективный радиус атома принимают половину расстояния между ядрами атомов, связанных в молекулу в ее устойчивом состоянии.
Потенциал ионизации, I (эВ/атом) – это потенциал, который надо приложить к одиночному атому или иону, чтобы оторвать от него электрон. Энергия ионизации имеет аналогичный смысл и выражается в размерности энергии: кДж/моль.
12
Энергия сродства к электрону, F,(кДж/моль) –
энергетический эффект присоединения электрона к нейтральному атому или иону.
Электроотрицательность, (Э.О.) характеризует способность атома, как принимать, так и отдавать электроны.
Все свойства атома определяются силами взаимодействия между положительно заряженным ядром и отрицательно заряженными электронами. При движении по периодам и группам таблицы Д.И. Менделеева (сверху вниз) заряд ядра и суммарный заряд электронов увеличиваются, и силы притяжения между ними возрастают. Однако следует иметь ввиду, что, если заряд ядра можно условно рассматривать как точечный, то электроны распределяются по энергетическим уровням. С увеличением числа уровней (слоев) электроны удаляются от ядра, и силы притяжения между ядром и электронами ослабляются. Далее надо учесть, что каждый уровень "расщепляется" на подуровни. Среди подуровней появляются d- и f-подуровни, наиболее плотно заполненные электронами. Начинает действовать эффект d- и f-сжатия, конкурирующий с удалением электронов от ядра.
Рассмотрим изменение свойств атомов элементов по периоду слева направо:
1)заряд ядра и суммарный заряд электронов увеличиваются – сила притяжения между ядром и электронами возрастает;
2)число энергетических уровней остается постоянным;
3)у элементов больших периодов заполняется d-подуровень (а начиная с 6 периода и f-подуровень) – действует эффект d- и f-сжатия.
В конечном итоге: сила притяжения между ядром и электронами возрастает, радиус атома уменьшается, потенциал ионизации увеличивается, восстановительная активность снижается, усиливаются окислительные свойства и электроотрицательность.
Рассмотрим изменение свойств атомов s- и p-элементов (по группам сверху вниз):
1)заряд ядра и суммарный заряд электронов возрастают;
2)число энергетических уровней увеличивается, электроны удаляются от ядра, и сила притяжения уменьшается;
3)d- и f-сжатие действует слабо, так как эти электроны остаются во внутренних оболочках.
13
Таким образом, по группе сверху вниз: радиус атома увеличивается; потенциал ионизации уменьшается, восстановительная активность возрастает, а окислительные свойства и электроотрицательность уменьшаются.
Проанализируем изменение свойств атомов d-элементов по группе сверху вниз (правая часть d-семейства):
1)заряд ядра и суммарный заряд электронов возрастают;
2)число энергетических уровней увеличивается, но незначи-
тельно;
3)очень сильно действует эффект d и f-cжатия, так как d- и f- подуровни все более близки к заполнению.
В результате – радиус атома уменьшается, потенциал ионизации возрастает, восстановительная активность уменьшается, электроотрицательность также уменьшается.
Следует иметь в виду, что, если элемент находится в левой части d-семейства, эффект d- и f-сжатия действует слабо, так как на d- и f- подуровнях еще мало электронов. Поэтому сохраняются закономерности, характерные для изменения по группам свойств s- и p-элементов.
Данный элемент (селен) относится к семейству р-элементов. По периоду слева направо от калия до криптона сила взаимодействия между ядром и электронами увеличивается, радиус атома уменьшается, потенциал ионизации возрастает, восстановительная активность уменьшается, электроотрицательность возрастает.
По группе сверху вниз от кислорода до полония сила взаимодействия между ядром и электронами возрастает, радиус атома уменьшается, восстановительная активность уменьшается, электроотрицательность уменьшается.
Рассмотрим следующий элемент.
Элемент 92U (Уран)
1.1.1.Уран в таблице Д.И. Менделеева находится в 7 периоде, относится к актиноидам и включен в III В группу длиннопериодного варианта таблицы Д.И. Менделеева.
1.1.2.Распределение электронов по энергетическим уровням и подуровням следующее:
14
1s22s22p63s23p64s23d104p65s24d105p66s25d14f145d2-106p67s26d15f3. Так как
последний электрон находится на f-подуровне, то уран относится к f-семейству.
1.1.3. Валентные электроны U: 7s26d15f3.
7s
6d
нормальное состояние 5f
Электрон 6d может "провалиться" на 5f, так как при этом формируется более устойчивое состояние. Эти состояния являются равновероятными.
7s
6d
5f
Так как число неспаренных электронов равно 4 и уран находится слева от границы Цинтля, то теоретически возможные степени окисления имеют следующие значения: 0, 1+, 2+, 3+, 4+, при этом наиболее устойчивыми являются: 0, 2+. 3+. 4+.
При возбуждении происходит распаривание 7s электронов и переход на 7p подуровень.
7p
7s
6d
5f
15
