
Методич.для заочн.(Химия)
.pdf
(Cr2O7)2- → 2Cr3+;
окислитель
2Ti3+ → 2Ti4+.
восстановитель
5) Отметим число принятых электронов в полуреакции восстановления и число отданных электронов в полуреакции окисления.
2- |
|
|
|
|
восстановление |
3+ |
|
+ 6е |
|||||||
(Cr2O7) |
→ |
2Cr ; |
|||||
3+ |
|
|
|
|
окисление |
4+ |
|
е |
|||||||
2Ti – 2 |
→ |
2Ti . |
|||||
6) Проводим в каждой строчке ионное уравнивание. Баланс по кислороду проводим в виде H2O, а по водороду – в виде Н+.
Вданном случае в верхней полуреакции справа вводим 7H2O, а
влевую часть – добавляем 14 Н+. Во второй полуреакции изменений нет. Получаем следующее:
14Н+ +(Cr2O7)2- + 6е → 2Cr3+ + 7H2O; 2Ti3+ – 2е → 2Ti4+.
7) Проводим электронный баланс, принимая во внимание, что число отданных восстановителем электронов всегда равно числу электронов, принятых окислителем. Справа ставим вертикальную черту, находим наименьшее общее кратное и проставляем
соответствующие коэффициенты. |
|
|
|
|
|
|
|||
14Н+ +(Cr2O7)2- + 6 |
|
→ 2Cr3+ + 7H2O; |
|
|
|
1 |
|||
е |
6 |
||||||||
|
|
||||||||
2Ti3+ – 2 |
|
|
|
→ 2Ti4+. |
|
|
3 |
||
е |
|
|
|
|
|
||||
8) Складываем левые и правые части полуреакций, умножив на соответствующие коэффициенты:
14H+ + (Cr2O7)2- + 6Ti3+ = 2Cr3+ + 7H2O + 6Ti4+.
9) Теперь под знаком равенства поставим короткую вертикальную черту и для элементов, стоящих слева, добавим
связанные с ними частицы, которые раньше мы не учитывали. Как видно из 3): для (Cr2O7)2- это 2К+, для 2Ti3+ – это 3(SO4)2-, а для 2Н+ –
56
это (SO4)2-. Те же самые частицы записываем справа от черты. Получаем следующее:
14H+ + (Cr2O7)2- + 6Ti3+ |
= 2Cr3+ + 7H2O + 6Ti4+; |
7(SO4)2- + 2K+ + 9(SO4)2- |
| 7(SO4)2- + 2K+ + 9(SO4)2-. |
10) Учитывая добавленные ионы, составляем полное уравнение со всеми стехиометрическими коэффициентами:
K2Cr2O7 +3Ti2(SO4)3 +7H2SO4 = Cr2(SO4)3 +6Ti(SO4)2 + 7H2O+K2SO4.
Теперь определим термодинамическую вероятность протекания данной окислительно-восстановительной реакции. Как показано в теме III, для этого необходимо провести расчет убыли свободной энергии ( G0298 химической реакции).
Записываем из 7) полуреакции окисления и восстановления и, пользуясь данными Приложения 3, приводим для них справа значения электродных потенциалов (φ0):
+ |
2- |
+6е |
3+ |
+7H2O; φок0 |
|
0 |
|
|
|
|
14Н |
+(Cr2O7) |
→ 2Cr |
. = φCr O2- |
+14H+ |
/ Cr3+ |
= +1,33 В; |
||||
|
|
−2е |
|
|
|
2 |
7 |
|
|
|
|
3+ |
4+ |
φ0 |
|
= φ0 |
|
|
= –0,04 В. |
||
|
2Ti |
→ 2Ti |
|
|
|
|
||||
|
|
|
|
восст. |
|
Ti4+ / Ti3+ |
|
|||
Рассчитываем ЭДС протекающего процесса (ε0):
ε0 = φ0окислителя – φ0восстановителя = 1,33 - (-0,04) = 1,37 В.
Далее рассчитываем G0298 химической реакции:
G0298 = – zFε0,
где z – число электронов, переданных от восстановителя к окислителю. С учетом электронного баланса z = 6;
F – число Фарадея, равное 96500 Кл/моль.
Чтобы ответ получить в кДж, вводим множитель 10-3:
G0298 = -6×96500×1,37×10-3 = -793,2 кДж.
Так как G0298 < 0, то данная реакция термодинамически вероятна, т.е. может протекать в прямом направлении.
57
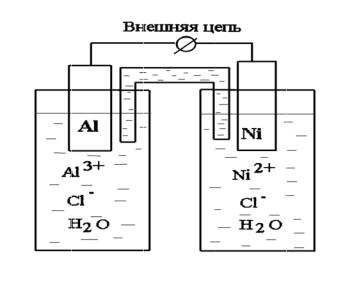
Задание 6 .2. Для двух металлов (табл. VI.2), находя щихся в растворах сво их солей с опре деленной концентрацией:
6. 2.1. Составьте схему гальванического элемента.
6. 2.2. Запи шите реакции, протекающие на катоде и аноде. 6. 2.3. Рассчитайте ЭДС (ε0) гальванического элемента и
G0298 протекающей реакции.
Пример решения 6.2
Гальванический элемент состоит из двух |
электродов и ионного |
||||||||
проводника между ними. |
В |
качестве |
электродов |
используются |
|||||
металл ы, |
уголь |
и |
другие |
|
вещества, |
обладающие |
электронной |
||
проводимостью |
(проводники |
I рода). |
Ионным |
пров дником |
|||||
(проводником II рода) служат растворы или |
расплав ы элект олитов. |
||||||||
Для обеспечения |
работы |
гальванического |
элеме нта, |
электроды |
|||||
соединяют друг с другом мет аллическим проводником, |
называемым |
||||||||
внешней |
цепью. |
В |
качеств е ионного |
проводника |
используется |
||||
«солян ый |
мостик», |
заполненный, |
например, |
насыщенным |
|||||
раствором KCl.
6. 2.1. Рас смотрим гальванический элемент, состоящий из двух металл ов, например, A l и Ni, погруженные в растворы собственных солей. Заданны й гальванический элемент может быть представлен схемой:
58

Схема гальванического элемента также может быть записана в
виде:
ze
анод (–) Al │ AlCl3 ║ NiCl2 │Ni (+) катод
Одинарной вертикальной чертой показана граница между
металлом и электролитом, а двойной – |
граница между |
электролитами. |
|
Пользуясь данными Приложения 3, выписываем значения стандартных электродных потенциалов для каждого электрода:
ϕ 0 3+ |
/ Al |
= –1,66 В; ϕ 0 |
2+ |
= –0,25 В. |
Al |
Ni |
|
/ Ni |
Сопоставление значений электродных потенциалов показывает, что большее количество электронов находится на поверхности алюминиевого электрода, поэтому на схеме гальванического элемента слева ставим знак (–), а никелевый электрод по сравнению с алюминиевым является более положительным, поэтому справа ставим знак (+). При замыкании внешней цепи электроны начинают переходить от алюминиевого электрода к никелевому, что на схеме указывается в виде стрелки сверху.
6.2.2. Учитывая, что электроны по внешней цепи движутся от восстановителя к окислителю и процесс отдачи электронов приводит к окислению, а приём электронов – к восстановлению, записываем реакции на электродах:
(–) анод: Al0 - 3е → Al3+ (окисление);
(+) катод: Ni2+ + 2е → Ni0 (восстановление).
Данные реакции протекают во внутренней цепи гальванического элемента.
Далее проводим расчет электродных потенциалов с учетом заданных концентраций растворов, например 0,001 моль/л.
59
Для этого используем уравнение Нернста для металлического электрода:
ϕ |
Меz+ / Me |
= ϕ 0 |
+ |
0,059 |
lg [Mez+], |
||
|
|||||||
|
|
Mez+ / Me |
|
z |
|||
где ϕ 0 |
z+ |
– стандартный электродный потенциал, |
|||||
Me |
/ Me |
|
|
|
|
||
|
|
|
|
|
|
||
z – количество электронов, участвующих в элементарном акте окисления или восстановления;
[Mez+] – концентрация ионов металла в растворе.
|
ϕ 3+ |
|
= -1,66 + |
0,059 |
|
lg (0,001) = -1,66 + |
0,059 |
|
(-3) = -1,72 В. |
|||
|
|
3 |
3 |
|
||||||||
|
Al |
|
/ Al |
|
|
|
|
|
||||
|
ϕ |
2+ |
|
= -0,25 + |
|
0,059 |
lg (0,001) = -0,25 + |
|
0,059 |
(-3) = -0,34 В. |
||
|
|
|
|
2 |
|
|||||||
|
Ni |
|
/ Ni |
|
2 |
|
|
|
|
|||
0 |
6.2.3. Проводим расчет ЭДС (ε) гальванического элемента и G |
|||||||||||
протекающей в нем реакции, помня, что z берется с учетом |
||||||||||||
298 |
|
|
|
|
|
|
|
|
|
|
|
|
электронного баланса:
ε = φок. - φвосст. = -0,34 - (-1,72) = 1,38 В.
G0298,х.р. = -zFε = -6×96500×1,38×10-3 = -799 кДж.
Так как значение G0298,х.р. < 0, то процесс в данном гальваническом элементе термодинамически вероятен.
Задание 6.3. Составьте схемы электролиза и рассчитайте массу металла, выделяющегося на катоде по приведенным данным (табл. VI.3) при 3-х разных условиях его проведения:
6.3.1.Из раствора соли металла, при использовании растворимого анода.
6.3.2.Из раствора соли металла, при использовании нерастворимого анода.
6.3.3.Из расплава соли металла, при использовании растворимого анода.
60
Пример решения 6.3
6.3.1.Пусть электролиз происходит в растворе Fe(NO3)2; I = 2 A;
τ= 40 мин; BТ = 35 %; анод – растворимый из железа.
Чтобы определить наличие в растворе заряженных частиц, записываем уравнение диссоциации соли и уравнение реакции гидролиза:
Fe(NO3)2 = Fe2+ + 2(NO3)− ;
Fe(NO3)2 + 2H2O = Fe(OH)2 + 2HNO3; Fe2+ + 2H2O = Fe(OH)2 + 2H+, pH < 7.
На катоде происходит восстановление, т.е. принятие электронов. Так как электроны это отрицательно заряженные частицы, то из записанных выше реакций принять электроны могут Fe2+ и Н+.
На аноде происходит окисление, т.е. отдача электронов. Отдавать электроны могут частицы (NO3) − , полярные молекулы Н2О, а также сам материал анода – Fe. Бóльшей способностью к отдаче электронов обладает металл (Fe). Металлы являются восстановителями, так как в их кристаллической решетке содержится большое количество свободных электронов.
Исходя из рассмотренного, укажем молекулы и ионы, которые могут разряжаться на аноде и катоде. Следует при этом учитывать, что число принятых и отданных электронов должно быть одинаковым.
(–) Катод |
(+) Анод |
||||||
← Fe2+ |
→ H2O |
||||||
← H+ |
→ (NO3)− |
||||||
Fe2+ + 2 |
|
|
= Fe0 |
→ Fe0 |
|||
e |
|
|
|
||||
2H+ + 2 |
|
= H2 |
2Fe0 - 4 |
|
= 2Fe2+. |
||
e |
e |
||||||
6.3.2. Водный раствор Fe(NO3)2 (нерастворимый анод, например
Pt).
Проанализируем, какие изменения произошли в системе. В вышеприведенном перечне элементов для катода и анода теперь отсутствует Fe0, а Pt как нерастворимый электрод только пропускает
61

через себя электроны. Следовательно, катодные реакции сохраняются прежними, а на аноде конкурируют Н2О и (NO3)− . Для простейшего объяснения следует иметь в виду, что частица (NO3)− имеет более сложную структуру, чем Н2О, поэтому на аноде электроны будет отдавать кислород воды. То же самое будет происходить, если в вашем варианте задания окажется не нитратная соль, а сульфат,
например, FeSO4, то в этом случае тоже разрядке подвергается Н2О, а
не (SO4)2-.
Если в предложенном варианте используются галогениды, то учитывая, что Н2О по структуре сложнее, в анодной реакции отдавать
электроны будут галогениды, например: 2Cl− – 2e → Cl02 .
Записываем реакции на аноде и катоде для раствора Fe(NO3)2 с нерастворимым анодом:
(–) Катод |
(+) Анод (нерастворимый) |
||||||
← Fe2+ |
→ H2O |
||||||
← H+ |
→ (NO3)− |
||||||
Fe2+ + 2 |
|
|
= Fe0 |
|
|
|
|
e |
|
|
|
||||
2H+ + 2 |
|
= H2 |
2H2O - 4 |
|
= O2 + 4H+. |
||
e |
e |
||||||
На катоде восстановление водорода возможно при малых значениях перенапряжения (η) на данном металле. При необходимости используются табличные данные.
6.3.3. Расплав Fe(NO3)2 (растворимый анод Fe0). В расплаве происходит диссоциация:
Fe(NO3)2 = Fe2+ + 2(NO3) − .
Ввиду отсутствия воды гидролиз не происходит и ионы Н+ не образуются.
(–) Катод |
(+) Анод |
||||
← Fe2+ |
→ (NO3)− |
||||
|
|
|
→ Fe0 |
||
Fe2+ + 2 |
|
→ Fe0 |
Fe0 - 2 |
|
→ Fe2+. |
e |
e |
||||
62

Таким образом, при электролизе следует учитывать следующие закономерности:
а) на аноде происходит процесс окисления, поэтому в первую очередь должны реагировать более сильные восстановители – вещества, имеющие наиболее отрицательные значения потенциалов; б) на катоде происходит процесс восстановления, поэтому в первую очередь должны реагировать более сильные окислители – вещества, имеющие наиболее положительные значения потенциалов. Расчет массы Fe (m), выделившегося на катоде, проводим по
формуле, отражающей закон Фарадея: m (Fe) = α · I ·τ · BТ,
A
α = zF ,
где α – электрохимический эквивалент вещества, А – атомная масса металла;
z – его валентность;
F – число Фарадея (96500 Кл/моль); I – сила тока,
τ – время электролиза в секундах; ВТ – выход по току вещества,
ВТ = mпрактическое 100 %.
Тогда масса железа, выделившегося на катоде, рассчитывается следующим образом:
m (Fe) = |
|
55,85 |
× |
2 40 60 35 |
= 0,486 г. |
|
2 |
96500 |
100 |
||||
|
|
|
Таким образом, выделяется 0,486 г железа.
63

|
|
|
|
|
Таблица VI.1 |
|
Схемы окислительно-восстановительных реакций |
||||
Номер |
|||||
варианта |
MnSO4 + Na2SO4 + H2O + Cl2 → MnO2 + NaCl + H2SO4 |
||||
1 |
|||||
2 |
HMnO4 + Pb(NO3)2 + H2O → PbO2 + Mn(NO3)2 + HNO3 |
||||
3 |
MnSO4+Br2+К2SO4+K2SO4 + H2O → KMnO4 + КBr + H2SO4 |
||||
4 |
K2SO4 + I2 + NO2 + H2O → KI + HNO3 + H2SO4 |
||||
5 |
K2SO4 + Cr2(SO4)3 + H2O → K2Cr2O7 + H2SO4 + SO2 |
||||
6 |
Al +K2Cr2O7 + H2SO4 |
→ Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O |
|||
7 |
KClO3 + FeSO4 + H2SO4 → KCl + Fe2(SO4)3 + H2O |
||||
8 |
K2Cr2O7 + KI + H2SO4 |
→ Cr2(SO4)3 + I2 + K2SO4 + H2O |
|||
9 |
KMnO4 + HCl → KCl + Cl2 + MnCl2 + H2O |
||||
10 |
K2Cr2O7 + H2S + H2SO4 → Cr2(SO4)3 + S + K2SO4 + H2O |
||||
11 |
FeCl2 + KMnO4 + HCl → FeCl3 + MnCl2 + KCl + H2O |
||||
12 |
K2Cr2O7 + H2SO4 + FeSO4 →K2SO4 + Cr2(SO4)3 + Fe2(SO4)3 + H2O |
||||
13 |
Ti2(SO4)3+ KMnO4+ H2SO4 → Ti(SO4)2 + MnSO4 + K2SO4 + H2O |
||||
14 |
|
|
|
|
→ Fe2(SO4)3 +NO+ H2O |
15 |
NaNO2 + NaI + H2SO4 |
→ NO + I2 + Na2SO4 + H2O |
|||
16 |
KI + KNO2 |
+ H2SO4 → I2 + K2SO4 + NO + H2O |
|||
17 |
Cu + HNO3 |
→ Cu(NO3)2 + NO + H2O |
|||
18 |
K2Cr2O7 + HCl → Cl2 + CrCl3 + KCl + H2O |
||||
19 |
CuS + HNO3 |
→ S + NO + Cu(NO3)2 + H2O |
|||
20 |
Mg + H2SO4 |
→ H2S + MgSO4 + H2O |
|||
21 |
K2S + KMnO4 |
+ H2SO4 → S + MnSO4 + K2SO4 + H2O |
|||
22 |
I2 + Cl2 + H2O |
→ HCl + HIO3 |
|||
23 |
KBr + K2Cr2O7 + HCl → Br2 + CrCl3 + KCl + H2O |
||||
24 |
Zn + KMnO4 + H2SO4 |
→ ZnSO4 + MnSO4 + K2SO4 + H2O |
|||
25 |
K2Cr2O7 + KI + H2SO4 |
→ Cr2(SO4)3 + I2 + K2SO4 + H2O |
|||
26 |
MnO2 + HCl → MnCl2 + Cl2 + 2H2O |
||||
27 |
K2Cr2O7 + NaNO2 + H2SO4 →Cr2(SO4)3+NaNO3+H2O+K2SO4 |
||||
28 |
Ag + HNO3 |
→ AgNO3 + H2O + NO2 |
|||
29 |
PbS + HNO3 |
→ S + NO + Pb(NO3)2 + H2O |
|||
30 |
NaNO2 + NaI + H2SO4 |
→ I2 + NO↑ + H2O |
|||
64
|
|
Таблица VI.2 |
|
|
|
Номер |
Металлы |
Концентрация ионов |
варианта |
|
металла, моль/л |
1 |
Cu,Ag |
0,01 |
2 |
Cu,Au |
0,1 |
3 |
Cu,Al |
0,001 |
4 |
Cu,Zn |
0,01 |
5 |
Cu,Ni |
0,1 |
6 |
Mg,Al |
0,001 |
7 |
Mg,Fe |
0,01 |
8 |
Mg,Zn |
0,1 |
9 |
Mg,Co |
0,001 |
10 |
Mg,Au |
0,01 |
11 |
Ni,Fe |
0,1 |
12 |
Ni,Co |
0,001 |
13 |
Ni,Al |
0,01 |
14 |
Ni,Sn |
0,1 |
15 |
Ni,Cd |
0,001 |
16 |
Fe,Co |
0,01 |
17 |
Fe,Al |
0,1 |
18 |
Fe,Pb |
0,001 |
19 |
Fe,Sn |
0,01 |
20 |
Fe,Au |
0,1 |
21 |
Co,Al |
0,001 |
22 |
Co,Au |
0,01 |
23 |
Al,Zn |
0,1 |
24 |
Sn,Mg |
0,001 |
25 |
Pb,Cu |
0,01 |
26 |
Mn,Al |
0,1 |
27 |
Mn,Cr |
0,001 |
28 |
Sb,Pd |
0,01 |
29 |
In,Sn |
0,1 |
30 |
In,Zn |
0,001 |
65
