
Методич.для заочн.(Химия)
.pdfНаиболее устойчивые степени окисления: 0, 1+,2+,3+,4+,5+,6+. Некоторые соединения урана приведены в табл. 1.2.
|
|
Таблица 1.2 |
|
|
|
Степени окисления |
Формула соединения |
Название |
0 |
U |
Уран |
3+ |
UCl3 |
Хлорид урана |
4+ |
UO2 |
Оксид урана |
5+ |
UF5 |
Фторид урана |
1.1.4. По периоду слева направо сила взаимодействия между ядром и электронами увеличивается, радиус атома уменьшается, потенциал ионизации возрастает, восстановительная активность уменьшается, окислительная способность возрастает, электроотрицательность возрастает.
По группе сверху вниз значительно увеличивается число энергетических уровней, электроны удаляются от ядра, что ослабляет силу притяжения между ядром и электронами. Поэтому, несмотря на d- и f-сжатие, которое в левой части d- и f-семейств действует слабо, сила притяжения электронов к ядру уменьшается, радиус атомов возрастает, потенциал ионизации и восстановительная активность увеличиваются, электроотрицательность уменьшается.
Далее по аналогии даем описание еще 2-х элементов, соответствующих Вашему варианту (табл. I.1).
16

|
|
|
|
|
|
Таблица I.1 |
|
|
Символы химических элементов |
|
|||
Номер |
|
|
||||
|
|
|
|
|
|
|
варианта |
s- |
|
p- |
d- |
|
f- |
1 |
87Fr |
|
5B |
80Hg |
|
71Lu |
2 |
88Ra |
|
6C |
79Au |
|
70Yb |
3 |
56Ba |
|
7N |
78Pt |
|
69Tm |
4 |
55Cs |
|
8O |
77Ir |
|
68Er |
5 |
38Sr |
|
9F |
76Os |
|
67Ho |
6 |
37Rb |
|
13Al |
75Re |
|
66Dy |
7 |
55Cs |
|
14Si |
74W |
|
65Tb |
8 |
56Ba |
|
15P |
73Ta |
|
64Gd |
9 |
87Fr |
|
16S |
72Hf |
|
63Eu |
10 |
88Ra |
|
17Cl |
57La |
|
62Sm |
11 |
56Ba |
|
31Ga |
89Ac |
|
61Pm |
12 |
55Cs |
|
32Ge |
104Rf |
|
60Nd |
13 |
87Fr |
|
33As |
105Db |
|
59Pr |
14 |
88Ra |
|
34Se |
106Sg |
|
58Ce |
15 |
20Ca |
|
35Br |
48Cd |
|
90Th |
16 |
4Be |
|
50Sn |
47Ag |
|
91Pa |
17 |
3Li |
|
51Sb |
46Pd |
|
92U |
18 |
38Sr |
|
52Te |
45Rh |
|
93Np |
19 |
20Ca |
|
53I |
44Ru |
|
94Pu |
20 |
37Rb |
|
49In |
43Tc |
|
95Am |
21 |
19K |
|
81Tl |
42Mo |
|
96Cm |
22 |
12Mg |
|
82Pb |
41Nb |
|
97Bk |
23 |
11Na |
|
83Bi |
40Zr |
|
98Cf |
24 |
4Be |
|
84Po |
39Y |
|
99Es |
25 |
3Li |
|
85At |
30Zn |
|
100Fm |
26 |
19K |
|
81Tl |
29Cu |
|
101Md |
27 |
20Ca |
|
82Pb |
28Ni |
|
102No |
28 |
11Na |
|
83Bi |
27Co |
|
103Lr |
29 |
12Mg |
|
84Po |
26Fe |
|
98Cf |
30 |
38Sr |
|
85At |
25Mn |
|
99Es |
17
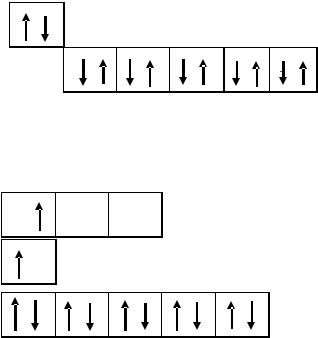
Тема II. ХИМИЧЕСКАЯ СВЯЗЬ
Задание 2.1. Для двух, указанных по варианту молекул (табл.
II.1), с позиций метода валентных связей показать образование молекул и ответить на следующие вопросы:
2.1.1.Каков тип гибридизации центрального атома в молекуле и валентный угол между связями?
2.1.2.Какова пространственная структура молекулы?
2.1.3.Сколько σ- и π-связей содержит молекула?
2.1.4.Определить полярность связей и полярность молекулы
вцелом.
Пример решения 2.1
Для ответа на вопросы задания рассмотрим молекулу CdI2. 2.1.1. Сначала определяем тип гибридизации центрального
атома. Для этого выписываем валентные электроны центрального атома 48Cd.
5s
4d
Затем 5s электроны переводим в возбужденное состояние.
5p
5s
4d
Таким образом, Cd предоставляет на связь два неспаренных электрона.
Далее выписываем валентные электроны йода.
18
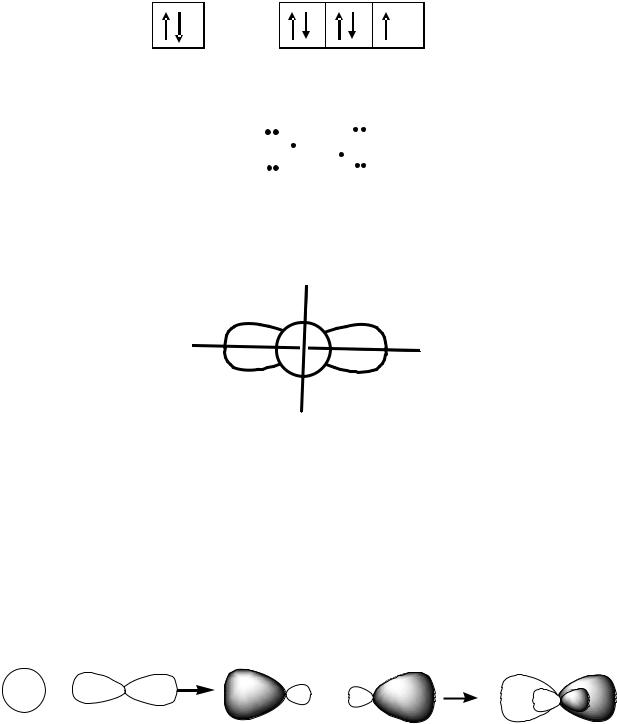
5s 5p
У йода имеется один неспаренный электрон. Следовательно, согласно Льюису молекула CdI2 выглядит следующим образом:
 I x Cd x I
I x Cd x I  .
.
Далее изображаем молекулу CdI2 с использованием представлений о гибридизации орбиталей центрального атома.
Отмечаем, что у Cd имеются две внешние орбитали: s и р. Представим s- и р-орбитали на рис. 2.1.
Рис. 2.1
Таким образом, с одной р-орбиталью йода кадмий связывается с помощью s-орбитали, а с другой – с помощью р-орбитали. Так как связи отличаются по форме и энергии, то такая молекула не будет устойчивой. Для образования устойчивой молекулы в центральном атоме происходит процесс гибридизации валентных орбиталей, который показан на рис. 2.2.
+ |
|
+ |
|
|
sp |
|
|
s+p |
sp |
2sp |
Рис. 2.2
Гибридизация – процесс, в результате которого происходит перестройка валентных орбиталей центрального атома и образование смешанных гибридных орбиталей, одинаковых по форме и энергии.
Таким образом, при гибридизации s- и p-орбиталей образуются две равноценные sp-гибридные орбитали (s + p = 2sp). По аналогии:
19
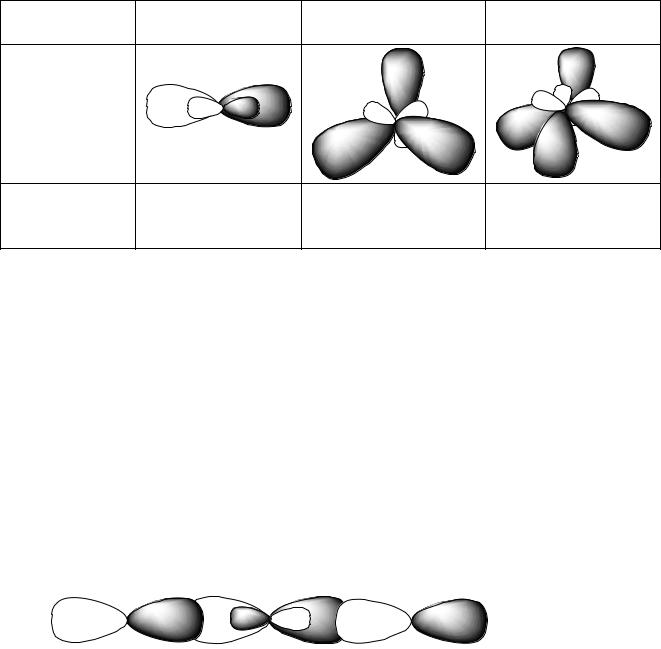
s + p + p = 3sp2, образуются три равноценные sp2-гибридные орбитали; s + p + p + p = 4sp3, образуются четыре равноценные sp3- гибридные орбитали.
Гибридные орбитали центрального атома располагаются под определенным углом (валентный угол), чтобы образовалась устойчивая молекула: при гибридизации типа sp валентный угол составляет 180 о; sp2 – 120 о; sp3 – 109 о. Расположение гибридных орбиталей под определенным углом показано в табл. 2.1.
|
|
|
|
Таблица 2.1 |
Тип |
|
sp |
sp2 |
sp3 |
гибридизации: |
|
|
|
|
Расположение |
|
|
|
|
гибридных |
|
|
|
|
орбиталей |
|
|
|
|
в |
простран- |
|
|
|
стве |
|
|
|
|
Теоретический |
180 о |
120 о |
109 о |
|
валентный |
||||
угол |
|
|
|
|
В соответствии с данными табл. 2.1 в молекуле CdI2 реализуется sp-гибридизация, и валентный угол составляет 180 о.
Чтобы изобразить молекулу в целом, остается показать перекрывание полученных гибридных орбиталей центрального атома с валентными орбиталями боковых атомов. В случае рассматриваемой молекулы CdI2 боковым атомом является 53I. Так как это р-элемент, то его валентные наружные электроны имеют орбиталь в виде гантели. В случае, если это будет s-элемент, то форма орбитали в виде шара.
"Подводя" валентные орбитали йода к гибридным орбиталям кадмия, получаем схему молекулы CdI2 (рис. 2.3).
I |
Cd |
I |
Рис. 2.3
20
2.1.2. Разберем вопрос о пространственной структуре молекулы.
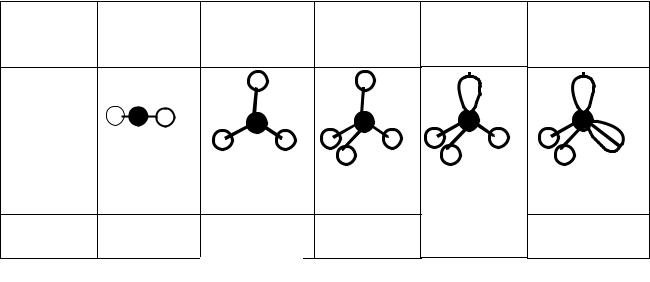
Пространственная структура молекулы связана с типом гибридизации и расположением боковых атомов вокруг центрального атома (табл. 2.2).
|
|
|
|
|
Таблица 2.2 |
Тип |
sp |
sp2 |
sp3 |
sp3 |
sp3 |
гибри- |
|
|
|
|
|
дизации |
|
|
|
|
|
Простран- |
|
|
|
|
|
ственная |
|
|
|
|
|
структура |
|
треугольная |
|
|
|
|
|
|
|
угловая |
|
|
|
|
тетраэдри- |
пирами- |
|
|
|
|
|
||
|
|
|
ческая |
дальная |
|
Форма |
линейная |
треугольная |
тетраэдри- |
пирами- |
угловая |
молекулы |
|
|
ческая |
дальная |
|
Как видно из табл. 2.2, при sp3 гибридизации может реализоваться тетраэдрическая форма, пирамидальная или угловая в зависимости от числа боковых атомов (4, 3, 2 – соответственно). В данном типе гибридизации могут оставаться неиспользованные орбитали, которые влияют на величину валентного угла.
Из рис. 2.3 следует, что рассматриваемая молекула CdI2 имеет линейную форму.
2.1.3. Теперь отметим наличие σ и π связей в молекуле. Если область перекрывания находится на оси связи, такая связь σ - типа (сигма тип), если область перекрывания расположена по обе стороны от оси связи – это π-тип (пи тип) ( рис. 2.4).
21
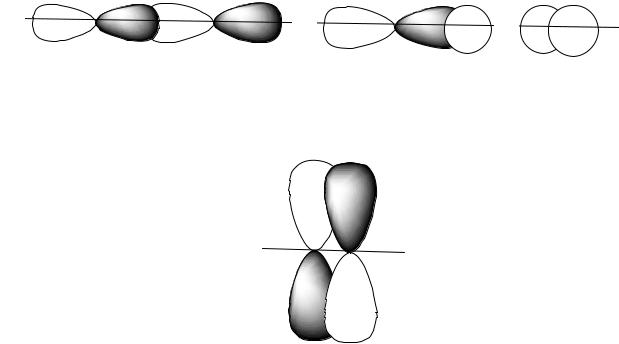
a) |
b) |
|
c) |
|
|
||
|
а) |
б) |
в) |
σ - тип
π - тип
Рис. 2.4. Типы связей
Исходя из рисунка 2.3. делаем вывод, что в молекуле CdI2 две ковалентные связи σ-типа.
2.1.4. Определим полярность связи и молекулы в целом. Полярность связи обусловлена наличием диполя, образованного за счет оттягивания валентных электронов в сторону более электроотрицательного атома (Приложение 1). В связи Cd–I в молекуле CdI2 более электроотрицательным элементом является йод. Поэтому связь Cd–I является полярной.
Для определения полярности молекулы необходимо учитывать: а) полярность связи; б) пространственную структуру молекулы.
Молекула CdI2 неполярна, так как при наличии двух диполей оттягивание электронов идет в обе стороны одинаково, и дипольные моменты взаимно компенсируются.
22
Рассмотрим молекулу OF2.
Выписываем валентные электроны центрального атома – кислорода.
2р
2s
Далее надо перевести электроны в возбужденное состояние. Однако, на втором энергетическом уровне свободных орбиталей нет, поэтому распаривание электронов невозможно. Если в качестве центрального атома будет похожий элемент, но находящийся в третьем периоде, то для таких простых молекул, которые предлагаются в задании не следует при возбуждении переводить электроны с 3s и 3р на 3d, так как на это необходимы большие затраты энергии.
Так как у атома кислорода имеется два неспаренных электрона,
то он может образовать две связи. Выписываем валентные электроны фтора: 2s22p5
2p
2s
У фтора имеется один неспаренный электрон. По представлениям Льюиса молекула OF2 может быть изображена следующим образом:
 F
F  O
O  F
F  .
.
Далее определяем тип гибридизации центрального атома – кислорода. Для этого производим "сложение": s + p + p + p = 4sp3. При этом не следует писать 2s или 2р, так как речь идет не об электронах (например, на 2s- подуровне), а их действительно 2, а об орбиталях, т.е. пространстве вероятного нахождения электронов. Рисуем четыре оси и гибридные облака. Подводим валентные
23
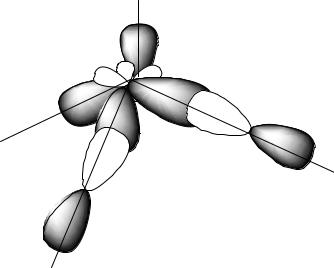
орбитали F (это р-элемент). Получаем угловую молекулу с теоретическим валентным углом 109 о (рис. 2.5).
O
F
F
Рис. 2.5
Связи О–F – полярные, молекула в целом тоже полярна, так как в вершине угла заряд со знаком "+", а в противоположной стороне "-". Происходит оттягивание электронов в сторону F, т.е. образуется диполь. Две связи О–F – ковалентные, σ-типа.
Задание 2.2. Для двух приведенных комплексных соединений (табл. II. 3): определить степени окисления всех составляющих и указать комплексообразователь, лиганды, ионы внешней и внутренней сферы и координационное число.
Записать уравнение диссоциации комплексного соединения.
Пример решения 2.2
Решение данного задания рассмотрим на примере 2-х
комплексных соединений: Na[Co(SCN)4(H2O)2] и [Fe(NH3)5(NO2)]Cl2.
Сначала проанализируем состав комплексного соединения. В комплексном соединении содержится сложный комплексный ион, который показан в квадратных скобках. Комплексный ион состоит из
комплексообразователя и лигандов. Комплексообразователь записывается первым в квадратной скобке, а далее следуют лиганды.
24
Лигандами могут быть как заряженные частицы: I − , Cl − , F − , NO3−, NO−2 , OH − , CN − , SCN− , так и нейтральные молекулы: Н2О, NH3.
Количество лигандов вокруг комплексообразователя называется его
координационным числом.
Комплексообразователь и лиганды связаны прочной ковалентной связью донорно-акцепторного типа. Комплексный ион является ионом внутренней сферы. Снаружи располагаются ионы внешней сферы. Ионы внешней и внутренней сферы связаны ионной связью.
Если сложный комплексный ион заряжен отрицательно, т.е. является анионом, то ион внешней сферы записывается слева, и комплекс называется анионным. Если комплексный ион заряжен положительно, т.е. представляет из себя катионный комплекс, то ион внешней сферы записывается справа. В некоторых соединениях ионы внешней сферы отсутствуют, тогда внутренняя сфера имеет нулевой заряд, такие комплексы называются нейтральными.
Учитывая степень окисления комплексных ионов (в первом соединении – [Co(SCN)4(H2O)2]1-, а во втором – [Fe(NH3)5NO2]2+,
определяем, что первое соединение содержит анионный, а второе – катионный комплекс. Вокруг комплексообразователя Со3+ расположены лиганды: (SCN)− и (Н2О)0, их число равно 6, а вокруг Fe3+ – лиганды (NH3)0 и (NO2)–, их число также равно 6. Ионами внешней сферы в указанных соединениях являются ионы Na+ и Cl− соответственно. Исходя из вышесказанного данные комплексные соединения могут быть представлены следующими схемами
(рис. 2.6 а, 2.6 б):
25
