
Химия
.pdf
Этот процесс обратимый: при подкислении осадок растворяется и может снова выпадать при разбавлении раствора.
Аналогично идет и гидролиз солей висмута.
В солях SbOCl и BiOCl группировки SbO+ и BiO+ играют роль одновалентного металла и называются соответственно антимонилом и висмутилом.
Висмут типичным для металла образом ведет себя при действии на него неорганических кислот. Имея положительное значение стандартного электродного потенциала, он не растворяется в соляной и разбавленной серной кислотах и окисляется азотной кислотой невысокой концентрации и горячей концетрированной серной кислотой:
Bi +4HNO3 = Bi(NO3)3 + NO +H2O
Для висмута наиболее характерна степень окисления +3.
Оксид и гидроксид висмута (III) – основные, легко взаимодействуют с кислотами, со щелочами не реагируют.
Соединения висмута (V) - сильные окислители, восстанавливаются до производных висмута (III).
Задачи
241. Осуществите следующие превращения:
азот аммиак оксид азота (II) оксид азота (IV) азотная кислота 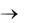 оксид азота (IV)
оксид азота (IV)
242. Каково электронное строение элементов подгруппы азота Какие степени окисления проявляют в соединениях азот, фосфор, висмут Почему азот и фосфор являются типичными неметаллами, а у висмута преобладают металлические свойства
243. Осуществите превращения и определите неизвестные вещества:
Mg |
NaOH, t |
O2,kat |
O2 |
NaOH |
KMnO4 |
|
HNO3(оч.разб) |
A |
Б |
B |
Г |
Д |
E NaNO2 |
244. Осуществите превращения и определите неизвестные вещества:
NaOH
Ca3(PO4)2 A P2O5 H3PO4 Na2HPO4 Б Ca3(PO4)2
245. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства Составьте уравнения реакций HNO2 :
а) с бромной водой; б) с HI; в) с KMnO4 . Какую функцию выполняет азотистая кислота в этих реакциях 246. Какие из оксидов азота взаимодействуют с водой и щелочами
246. Какие из оксидов азота взаимодействуют с водой и щелочами Запишите
Запишите
соотвествующие уравнения реакций, укажите, к какому типу относится каждая из них.
247. Как получают азотную кислоту в промышленности Приведите реакции, лежащие в основе ее производства.
Приведите реакции, лежащие в основе ее производства.

248. Осуществите превращения и определите неизвестные вещества:
HCl
A NH3 Б Mg3N2 B NH4Cl
249.Как действует азотная кислота на металлы Каковы могут быть продукты ее восстановления; от чего это зависит Приведите уравнения соответствуюших реакций.
250.Как различаются по кислотно-основным свойствам оксиды азота,
фосфора, сурьмы, висмута Подтвердите это соответствующими реакциями. Чем обусловлено такое различие
Подтвердите это соответствующими реакциями. Чем обусловлено такое различие
251.На примере соли сурьмы покажите обратимость реакции гидролиза.
252.Кратко охарактеризуйте свойства висмута и его соединений. В чем их сходство и отличие от других элементов этой подгруппы и их соединений.
XXII. Элементы VIа подгруппы. Кислород. Сера
Элементы этой подгруппы имеют электронные конфигурации внешнего валентного уровня типа ns2np4, что обусловливает, прежде всего, окислительные свойства этих элементов.
Наибольшей окислительной способностью в виде простых веществ обладают кислород и сера – типичные неметаллы.
Для всех элементов подгруппы характерно проявление степени окисления –2. Все элементы, кроме кислорода, образуют также соединения со степенью окисления +4 или +6, что связано с существованием на внешнем уровне свободного d-подуровня.
Кислород почти всегда (кроме его соединений с фтором, где степень его окисления +2, и пероксидов со степенью окисления -1) имеет степень окисления -2.
Кислород уже при комнатной температуре реагирует с большинством металлов; с неметаллами реагирует, как правило, при нагревании.
Также уже при комнатной температуре кислород взаимодействует со многими сложными соединениями, например:
2NO + O2 = 2NO2
С сероводородом при нагревании в зависимости от соотношения реагентов протекают реакции
2H2S + O2 = 2S + 2H2O
2H2S + 3O2 = 2SO2 + 2H2O
В большинстве реакций окисления с участием кислорода выделяются тепло и свет – такие процессы называются горением.
Еще более сильным окислителем, чем O2 , является озон O3. Так, при взаимодействии озона с раствором иодида калия выделяется иод

2KI + O3 + H2O = I2 + 2KOH + O2,
тогда как с кислородом эта реакция не идет.
В промышленности кислород получают перегонкой жидкого воздуха или электролизом воды; в лабораторных условиях – разложением ряда солей, таких как KClO3, KMnO4, KNO3, K2Cr2O7, оксида ртути.
Особенно легко кислород выделяется из пероксида водорода H2O2. Это очень непрочное вещество, способное разлагаться со взрывом (особенно в присутствии катализаторов) с выделением большого количества тепла:
2H2O2 = 2H2 + O2 + Q
Свойства пероксида водорода определяются наличием одинарной связи между атомами кислорода – О – О -. Находясь при этом в промежуточной степени окисления –1, кислород может проявлять как окислительные, так и восстановительные свойства.
Например, в реакции с хорошим восстановителем – иодид-ионом – H2O2 – окислитель:
H2O2 + 2KI + H2SO4 = I2 + 2H2O + K2SO4,
а в реакции с сильным окислителем – перманганатом калия – восстановитель:
5H2O2 + 2KMnO4 + 3H2SO4 = 5O2 + 2MnSO4+ 8H2O + K2SO4
Сера при комнатной температуре реагирует с фтором хлором и концентрированными кислотами – окислителями (HNO3, H2SO4):
S + 2H2SO4 (к.) = 3SO2 + 2H2O
На воздухе сера горит, образуя SO2. Во всех этих реакциях сера является восстановителем.
При нагревании сера реагирует с углеродом, фосфором, водородом и большинством металлов, проявляя окислительные свойства.
Соединение серы с водородом – сероводород H2S – бесцветный газ с характерным запахом гниющего белка.
Раствор H2S в воде – это очень слабая сероводородная кислота. Ее соли называются сульфидами.
Сероводород – типичный восстановитель и окисляется не только сильными, но и относительно слабыми окислителями, например ионами трехвалентного железа:
2FeCl3 + H2S = 2FeCl2 + S + 2HCl
Оксиды серы (IV) и (VI) SO2 и SO3 являются ангидридами соответственно сернистой и серной кислот.
Сернистая кислота H2SO3 малоустойчива, легко распадается на SO2 и H2O. По способности к диссоциации, относится к слабым кислотам. В водном растворе существуют равновесия, аналогичные существующим в растворе угольной кислоты.
На воздухе сернистая кислота медленно окисляется в серную.
Диоксид серы, сернистая кислота и ее соли вступают в обменные реакции и реакции присоединения, идущие без изменения степеней окисления, а также в окислительно-восстановительные реакции, где вследствие

промежуточной степени окисления серы +4 проявляют окислительновосстановительную двойственность.
При нагревании соли сернистой кислоты - сульфиты разлагаются на сульфиды и сульфаты (соли серной кислоты).
Оксид серы (VI) SO3 –бесцветная жидкость при комнатной температуре; энергично соединяется с водой с образованием серной кислоты H2SO4 .
SO3 очень хорошо растворяется в 100%-ной серной кислоте. Этот раствор называется олеумом.
Концентрированная серная кислота, особенно горячая, – энергичный окислитель за счет серы в максимальной степени окисления +6. Малоактивные металлы, металлы средней активности и неметаллы, обычно восстанавливают ее до SO2:
Cu +2H2SO4 (к.) = CuSO4 + SO2 + 2H2O
2 Fe + 6H2SO4 (к.) = Fe(SO4)3 + 3SO2 + 6H2O
C + 2H2SO4 (к.) = 2SO2 |
+ CO2 + 2H2O |
2P + 5H2SO4 (к.) = 5SO2 |
+ 2H3PO4 + 2H2O |
При взаимодействии с активными металлами в зависимости от условий реакции (температура, концентрация кислоты, длительность реакции) продуктами восстановления могут быть как SO2 , так и свободная сера и сероводород.
Разбавленная серная кислота окисляет за счет ионов H+, поэтому в ней растворяются только металлы, стоящие в ряду напряжений до водорода, например:
Fe+ 2H2SO4 = FeSO4 + H2 
Серная кислота – сильная двухосновная кислота. По первой ступени в растворах невысокой концентрации она диссоциирует практически нацело:
H2SO4 H+ + HSO4-.
Диссоциация по второй ступени протекает в меньшей степени.
Как двухосновная, серная кислота образует два ряда солей – средние (сульфаты) и кислые (гидросульфаты). Большинство их хорошо растворяется в воде. К практически нерастворимым относятся сульфаты бария, стронция и свинца.
При сильном нагревании многие сульфаты разлагаются до оксида металла и SO3 или SO2 и О2.
Сульфаты меди, железа, цинка и некоторых других металлов, содержащие кристаллизационную воду, называются купаросами.
Промышленное производство серной кислоты основано на так называемом контактном методе. Процесс можно разбить на 3 этапа:
1) получение SO2 обжигом пирита (FeS2); 2) каталитическое окисление SO2 до SO3; 3) поглощение SO3 96% -ной серной кислотой.
Задачи
253. Запишите электронные формулы кислорода и серы в нормальном и возбужденном состоянии. Каковы возможные степени окисления этих элементов
254.Как можно получить кислород в лаборатории; как его получают в промышленности Приведите уравнения реакций.
255.Какими свойствами обладает кислород Приведите примеры его взаимодействия с простыми и сложными веществами.
Приведите примеры его взаимодействия с простыми и сложными веществами.
256. Что такое озон Каково строение молекулы O3 Какими свойствами он обладает
257.Определите степень окисления серы в ионах S2-, SO32-, SO42-, S2O72-. Как называются кислоты, анионами которых являются приведенные ионы Изобразите графически строение этих кислот.
Изобразите графически строение этих кислот.
258.Приведите примеры ОВР (молекулярные и электронные) с участием
сероводорода. Какую функцию он в них выполняет, почему
259.Как может проявить себя диоксид серы, соли сернистой кислоты в
ОВР; почему Составьте молекулярные и электронные уравнения реакций, протекающих при пропускании SO2 через растворы: а) сероводорода; б) бихромата калия в кислой среде.
Составьте молекулярные и электронные уравнения реакций, протекающих при пропускании SO2 через растворы: а) сероводорода; б) бихромата калия в кислой среде.
260.Чем определяются свойства пероксида водорода Составьте молекулярные и электронные уравнения реакций H2O2 :с KNO2 , Ag2O, PbS. Охарактеризуйте роль пероксида водорода в этих реакциях.
Составьте молекулярные и электронные уравнения реакций H2O2 :с KNO2 , Ag2O, PbS. Охарактеризуйте роль пероксида водорода в этих реакциях.
261.Чем объясняется различие окислительной способности разбавленной и
концентрированной серной кислоты Приведите соотвествующие примеры (молекулярные и электронные уравнения) взаимодействия H2SO4 с металлами и неметаллами.
Приведите соотвествующие примеры (молекулярные и электронные уравнения) взаимодействия H2SO4 с металлами и неметаллами.
262. Осуществите превращения и определите неизвестные вещества:
kat |
S KMnO4 |
t |
|
H2O2 |
A Б |
B SO2 |
K2SO3 Г+Д |
263.Как получают серную кислоту в промышленности Приведите уравнения реакций, лежащих в основе контактного метода ее производства.
Приведите уравнения реакций, лежащих в основе контактного метода ее производства.
264.Осуществите превращения и определите неизвестные вещества:
H2O |
Cu |
H2S |
Fe |
HCl |
Ag,O2 |
SO3 |
Б |
В |
Г |
Д Е |
Ag2S |
265. Какую массу оксида серы (VI) нужно растворить в 100 г 91% -ного раствора серной кислоты для получения 30% -ного олеума
XXIII. Элементы VIIа подгруппы
Все элементы подгруппы галогенов обладают электронной конфигурацией ns2np5, что обусловливает характерную степень окисления всех элементов –1. Фтор – наиболее электроотрицательный элемент, он не образует
соединений, в которых проявлялась бы положительная степень окисления. Для хлора, брома и иода известны степени окисления +1,+3,+5,+7.
Все галогены в виде простых веществ проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к иоду. Фтор реагирует со всеми металлами без исключения, многие их них в атмосфере фтора самовоспламеняются, выделяя большое количество тепла, например:
2Al + 3F2 = 2AlF3 + 3000 кДж
Без нагревания фтор реагирует и со многими неметаллами (H2 ,S, C, Si, P) –все реакции сильно экзотермичны.
При нагревании фтор окисляет все другие галогены, например:
F2 + Cl2 = 2Cl +1F-1 ,
а при облучении реагирует даже с инертными газами, например:
2F2 + Xe = XeF4
Взаимодействие фтора со сложными веществами также протекает очень энергично. Например, в атмосфере фтора горит вода:
2F2 + 2H2O = 4HF + O2 
Хлор также очень реакционноспособен, реагирует почти со всеми простыми и многими сложными веществами. Так, при нагревании, вытесняет бром или иод из их соединений с водородом или металлами:
Cl2 + 2KBr = 2KCl + Br2
Химическая активность брома также достаточно высока. Со многими веществами он реагирует аналогично хлору, хотя реакции протекают менее активно.
Хлор и бром взаимодействуют и с органическими соединениями, бром при этом, будучи химически менее активным, используется как ―мягкий‖ реагент.
Промышленное получение фтора и хлора осуществляется электролизом расплавов их солей. Бром и иод, как правило, получают химическим способом, обычно окислением галогенидов металлов или галогенводородов.
Все галогенводороды при обычных условиях газообразны. Полярность и прочность связи при переходе от HF к HI падает. При растворении в воде HI, HBr и HCl диссоциируют почти полностью, поэтому образующиеся кислоты относятся к числу сильных. В отличие от них фтороводородная (плавиковая) кислота является слабой, что объясняется ассоциацией молекул HF вследствие возникновения между ними водородных связей.
При взаимодействии галогенводородных кислот с металлами окисление последних может происходить только за счет ионов H+, поэтому эти кислоты реагируют только с металлами, стоящими в ряду напряжений левее водорода.
В отличие от других галогенводородных кислот плавиковая кислота реагирует с оксидом кремния (IV):
SiO2 + 4HF = SiF4 + 2H2O,
поэтому она разъедает стекло.

HF и HCl можно получать в лаборатории действием концентрированной серной кислоты на твердые фторид и хлорид калия при нагревании:
KF + H2SO4 |
(к) = HF |
+ KHSO4 |
KCl + H2SO4 |
(к) = HCl |
+ KHSO4 |
Все галогены, кроме фтора, образуют соединения, в которых они обладают положительной степенью окисления. Наиболее важными из них являются кислородсодержащие кислоты и соотвествующие им соли и ангидриды. Такие соединения наиболее характерны для хлора, для которого известны четыре кислоты:
HCl+1O, HCl+3O2, HCl+5O3, HCl+7O4 .
Сила кислот существенно возрастает в ряду HCl +1O – HCl+7O4 (HClO – очень слабая кислота, HClO4 – самая сильная кислота из всех известных). Такая закономерность – усиление кислотных свойств с возрастанием степени окисления центрального атома характерна не только для хлора, но и для других элементов. Также общей закономерностью является ослабление кислотных свойств с возрастанием радиуса иона центрального атома (при неизменном его
заряде). Так, константа кислотной диссоциации HI+1O в 250 раз меньше таковой для HCl+1O.
Окислительная способность в ряду HClO – HClO4 ослабевает при обычных условиях (свет, комнатная температура) и усиливается в темноте и при более низких температурах. Из солей кислородсодержащих кислот широко известны бертолетова соль (хлорат калия) KClO3 и хлорная ―белильная ‖ известь.
Бертолетову соль можно получать, пропуская хлор в горячий раствор KOH с последующим его охлаждением:
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
При нагревании бертолетова соль легко разлагается: в присутствии катализатора (MnO2) – в основном согласно уравнению:
2KClO3 = 2KCl + 3O2 ,
а без катализатора при осторожном нагревании – в основном согласно схеме
4KClO3 = 3KClO4 + KCl
Бертолетова соль и другие хлораты – сильные окислители. Окисляют, например, оксид марганца (IV) до манганата, оксид хрома (III) до хромата, железо (II) переводят в железо (III) и т.п. Cl+5 при этом восстанавливается до иона Cl-1.
Действием хлора на гидроксид кальция получают смесь солей, называемую хлорной известью:
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(OCl)2 + 2H2O
Формально ее состав можно выразить формулой CaOCl2 (хлорид – гипохлорит натрия).
В отличие от хлора фтор взаимодействует со щелочным раствором согласно уравнению
2F2 + 2NaOH = 2NaF + H2O + O+2F2 (+ O2 + O3 + H2O2)

При обычных условиях фторид кислорода – бесцветный газ; очень ядовит. Проявляет сильные окислительные свойства.
Задачи
266.Как и почему изменяется сила галогеноводородных кислот по подгруппе сверху вниз
267.Что такое бертолетова соль Изобразите ее графически. Каково ее нетривиальное название
Изобразите ее графически. Каково ее нетривиальное название Как ее можно получить; каковы ее свойства (поведение в ОВР, отношение к нагреванию)
Как ее можно получить; каковы ее свойства (поведение в ОВР, отношение к нагреванию) Приведите уравнения соответствующих реакций.
Приведите уравнения соответствующих реакций.
268.Как и почему изменяется восстановительная способность галогенводородных кислот и их солей по подгруппе сверху вниз? Объясните, почему в приведенных ниже реакциях продукты восстановления окислителя разные.
2KBr + 2H2SO4 (K) = Br2 +SO2 |
+ K2SO4 + 2H2O |
8KI + 5H2SO4 (K) = 4I2 +H2S |
+ 4K2SO4 + 4H2O |
Cоставьте электронные уравнения и подберите коэффициенты.
269.Из всех галогенидов натрия только один подвергается гидролизу. Составьте ионное и молекулярное уравнения гидролиза этого вещества. Дайте обоснование своему выбору.
270.Осуществите превращения:
HCl |
Cl2 HCl |
NaCl |
AgCl |
271. Оксид серы (IV) растворили в воде |
при повышенном давлении. К |
||
раствору прилили |
бромную |
воду, а |
затем избыток хлорида бария. |
Отфильтрованный и высушенный осадок имел массу 23,3 г. Сколько граммов брома вступило в реакцию
272. Как называются кислородсодержащие кислоты хлора и их соли Изобразите графически эти кислоты. Получите их из соответствующих ангидридов. Как изменяется их сила и окислительная способность с увеличением степени окисления хлора
Изобразите графически эти кислоты. Получите их из соответствующих ангидридов. Как изменяется их сила и окислительная способность с увеличением степени окисления хлора
273.Напишите электронную формулу фтора. Какова его степень окисления в
соединениях Опишите кратко химические свойства фтора, их особенности, отличия от свойств других галогенов. Запишите соответствующие реакции.
Опишите кратко химические свойства фтора, их особенности, отличия от свойств других галогенов. Запишите соответствующие реакции.
274.Осуществите превращения и определите неизвестные вещества:
|
|
FeSO4 |
|
Сl2 |
KOH |
Б |
В |
NaBr А |
Cl2 |
H2SO4 |
|
|
|
CaOCl2 |
|
275. Напишите электронные формулы хлора и фтора в нормальном и возбужденном состоянии. Какие степени окисления могут иметь эти элементы Приведите примеры соответствуюих соединений.
XXIV. Водород
Порядковый номер 1. Атомная масса 1,008. Число известных изотопов 4, из которых протий (относительная атомная масса 1), дейтерий (относительная атомная масса 2), тритий (относительная атомная масса 3) обнаружены в природе, а четвертый (относительная атомная масса 4) получен искусственно.
Во Вселенной водород является самым распространенным элементом - он составляет до 90% массы Солнца и многих звезд. В земной коре содержание водорода составляет 1%. В природе он встречается как в свободном состоянии (вулканические газы, газы нефтяных скважин, верхние слои атмосферы), Так и в виде соединений. Наиболее распространенным соединением является вода, где содержание водорода составляет 11,11%.
Ядро атома содержит один протон, вокруг которого один электрон, занимающий S-орбиталь 1S1. Такая простая структура обусловливает множество уникальных свойств водорода. Во-первых, атом водорода имеет лишь валентную электронную оболочку. Поэтому ее единственный электрон не экранирован от действия заряда ядра внутренними электронами. Во-вторых, этой внешней электронной оболочке достаточно приобрести или потерять лишь один электрон, чтобы достичь устойчивой электронной конфигурации. Наконец, поскольку атом водорода состоит из одного электрона и одного протона, он имеет очень малые размеры, его ковалентный радиус (0,03 нм) имеет минимальное значение среди всех элементов. Эти особенности объясняют многие отличительные свойства водорода и его особое положение в периодической таблице.
Электронная структура единственной оболочки водорода аналогична внешней оболочке щелочных металлов. Подобно щелочным металлам водород имеет высшую степень окисления +1 однозарядного иона Н+. Эти основные причины позволяют рассматривать водород как представителя I группы, но все они являются в достаточной степени формальными. Так, энергия ионизации атома водорода намного больше, чем у атомов щелочных металлов. Другое важное различие: для щелочных металлов невозможно существование отрицательно заряженных ионов, тогда как для водорода степень окисления -1 достаточно характерна (например, Na+1H-1). Радиус иона Н+ несравненно меньше радиусов ионов щелочных металлов, а последние, как известно, характеризуются наибольшими радиусами из всех прочих положительных ионов. Таким образом, между водородом и щелочными металлами наблюдается лишь некоторое формальное сходство.
Водород также включается в главную подгруппу седьмой группы. У него до завершения внешней оболочки благородного газа гелия не достает одного

электрона. То же самое наблюдается у галогенов, у которых до образования оболочки соответствующего благородного газа тоже не хватает одного электрона. В соединениях с металлами водород, как и галогены, образует отрицательный ион Н- (Na+1H-1 и Na+1Cl-1 ). Они по своему характеру напоминают типичные соли, похожие на соответствующие производные фтора и хлора. Водород, как и галогены, характеризуется высоким значением энергии ионизации. Именно эти особенности позволяют помещать водород в подгруппу галогенов.
Все отмеченные факты говорят о том, что водород следует рассматривать как особый химический элемент, не имеющий полных аналогов.
Химические свойства. Для водорода характерны три типа электронных процессов:
1)потеря электрона с образованием протона Н0 – e = Н+ ; здесь проявляются его восстановительные свойства
2)присоединение электрона, приводящее к образованию гидрид-иона
Н0 + e=Н- , существующего только в кристаллических гидридах самых электро-положительных металлов (NaH, CaH2 ); окислительные свойства;
3) формирование двухэлектронных связей (ковалентные связи), происходящих при образовании молекулы водорода и его взаимодействии с неметаллами.
Энергия связи в молекуле велика, что объясняет сравнительно малую активность молекулярного водорода при обычных условиях.
Так, при обычной температуре водород реагирует лишь с фтором (даже в темноте) и с хлором (при освещении).
H2 + F2 = 2HF
H2 + Cl2 = 2HCl
При нагревании обратимо реагирует с бромом, иодом, а также с серой и азотом:
H2 + S = H2S
3H2 + N2 = 2NH3
(катализатор, высокое давление)
С кислородом при повышенной температуре водород реагирует с образованием овды с выделением большого количества тепла:
2H2 + О2 = 2H2О
Реагирует также со сложными веществами при нагревании, например:
CuO + H2 = Cu + H2O
CH2=CH2 + H2 CH3 CH3
