
Химия
.pdf
при 8500С равна 1. Вычислить равновесные концентрации веществ, если исходные концентрации : СО 0=3 моль/л, Н2О 0=2 моль/л.
Решение Выражение константы равновесия данной реакции
К= СО2 р Н2 р / СО р Н2О р Пусть к моменту равновесия концентрация СО2 р= х моль/л. Согласно
уравнению реакции число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х) СО и Н2О расходуется для образования х молей СО2 и Н2. Следовательно, равновесные концентрации всех веществ:
СО2 р= Н2 р= х моль/л; СО р=(3-х) моль/л; Н2О р=(2-х) моль/л Тогда
1=х2 / (3-х)(2-х); х2=6-2х-3х+х2; 5х=6; х=1,2 моль/л.
Искомые равновесные концентрации: СО2 р=1,2 моль/л
Н2 р=1,2 моль/л
СО р=3-1,2=1,8 моль/л Н2О р=2-1,2=0,8 моль/л
4. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастет скорость реакции при повышении температуры от 20 до 750С ?
Решение
Отношение скоростей реакции при температурах 750(Vt+ t) и 200(Vt) равно
Vt+ t / Vt= |
t/10 |
|
t = 75-20 =550; Vt+ t / Vt = 2,8 5,5 = 287
Скорость реакции увеличится в 287 раз.
Задачи
81. Во сколько раз изменится скорость химической реакции N2 (г)+ 3H2 (г) = 2NH3 (г), если: а) увеличить давление в 2 раза; б) увеличить концетрацию N2 в 3 раза; в) понизить температуру на 40 С (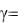 )
)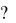
82.Во сколько раз надо увеличить концентрацию CO2 ,чтобы скорость реакции CO2 (г)+C(г) = 2CO (г) увеличилась в 4 раза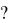
83.Во сколько раз надо увеличить давление, чтобы скорость реакции CaO
(т) +CO2 (г) = CaCO3 (г) увеличилась в 12 раз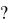
84. При 1300 К константа равновесия реакции FeO (т) + CO (г)= Fe (т) + CO2 (г) равна 0,5. Вычислить равновесные концентрации CO и CO2, если исходные концентрации [CO]исх = 0,05 моль/л и [CO2]исх = 0. В какую сторону сместится равновесие при увеличении концентрации СО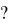
85. При установлении равновесия: ZnO (т) + CO (г) = Zn (т) + CO2 (г) концентрация [СО]=1моль/л, [СО2]=1моль/л. Вычислите исходную концентрацию [СО]исх , если исходная концентрация [CO2]исх равна нулю.

86.При установлении равновесия N2 (г) + 3H2 (г) = 2NH3 (г) концентрация [N2] = 0.02 моль/л, [H2] = 7,2 моль/л и [NH3] = 0,8 моль/л. Вычислите исходную концентрацию азота и водорода, если начальная концентрация аммиака равна нулю. В какую сторону сместится равновесие при увеличении давления.
87.При установлении равновесия 2CO () + O2 () = 2CO2 () + 566,2 кДж концентрация [CO](г) = 2 моль/л, [О2](г) = 0,5 моль/л, и [CO2](г) = 2моль/л. Вычислите исходную концентрацию CO и O2 , если начальная концентрация CO2 равна нулю. В какую сторону сместится равновесие при повышении
температуры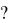
88.При установлении равновесия Fe2O3 (т) + 3CO (г) = 2Fe (т) + 3CO2 (г) концентрация [CO] = 1моль/л и [CO2] = 2моль/л. Вычислите исходную концентрацию [СО]исх, если начальная концентрация CO2 равна нулю.
89.Вычислите исходную концентрацию водорода: ZnO(т) + H2 (г) =
= Zn(т) +H2O (г), если константа равновесия при некоторой температуре равна 0,5, а равновесная концентрация [H2O] = 0,6 моль/л. В какую сторону сместится равновесие при увеличении концентрации H2O 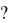
90. В какую сторону сместится равновесие: а) при понижении давления;
б) при повышени температуры? |
|
FeО (т) + H2 (г) |
Fe (т) + H2O (г) –23кДж |
Fe2O3 (т) +3SO3 (г) |
Fe2(SO4)3 (т) – 1081кДж |
TiO2 (т) + 2C (т) + 2Cl2 (г) TiCl4 (г) + 2CO (г) + 32,7 кДж
IX. Растворы. Способы выражения содержания
растворенного вещества в растворе
Растворы - это гомогенные химические системы переменного состава, образованные двумя или несколькими веществами.
Состав раствора определяется количествами растворенного вещества и растворителя.
Существует несколько способов количественного выражения состава растворов в виде различных долей либо в виде различных концентраций растворенного вещества. Концентрацией раствора называется количество растворенного вещества, содержащееся в единице массы или объема раствора или растворителя.
Наиболее часто употребляемые в химии способы выражения содержания растворенного вещества в растворе следующие:
1) массовая доля - отношение массы растворенного вещества к общей массе раствора
= (mв / mр-ра ) 100% (в долях или %);
100% (в долях или %);

2) мольная доля N - отношение количества растворенного вещества (в молях) к сумме количеств всех веществ, составляющих раствор:
N1=n1 / (n1+n2+n3+...) (в долях);
3) моляльность m - отношение количества растворенного вещества (в молях) к массе растворителя:
m=n / mр-ля (моль/кг р-ля);
4) молярность См или М - отношение количества растворенного вещества (в молях) к объему раствора:
См=n / V (моль/ л);
5) эквивалентная концентрация или нормальность Сн - отношение числа эквивалентов растворенного вещества к объему раствора:
Сн=nэкв / V (экв/л или н)
6) титр (Т) - количество граммов растворенного вещества в 1см3 (мл) раствора
Т=mв / V(мл) (г/мл).
Первые три вида концентраций - массовые, вторые три вида - объемные. Пересчет массовых концентраций в объемные и наоборот можно произвести только зная плотность раствора.
Примеры решения задач
Пример 1. Вычислите: массовую, моляльную, молярную, нормальную концентрации, мольную долю, титр раствора Н3РО4, полученного при растворении 18г кислоты в 282 мл воды, если его плотность 1,031 г/см3.
Решение
Масса раствора 282+18=300г. Тогда массовая доля =mв / mp-pa=18 / 300 = 0,06 (6%).
Для нахождения моляльности сначала вычисляем количество растворенного вещества n=mв / М=18 / 98=0,184 моль. Тогда моляльность m=0,184 / 0,282=0,65
моль/кгН2О.
Для определения мольной доли кислоты сначала вычисляем количества растворенного вещества (n1) и растворителя (n2):
n1=18 / 98=0,184 моль n2=282 / 18=15,67 моль. Отсюда мольная доля N=0,184 / (0,184+15,67) =0,012.
При нахождении молярности используем уже найденное количество растворенного вещества n1=0,184 моль в 300г раствора. Определяем объем раствора V=300 / 1,031 = 290,98 мл = 0,291 л; следовательно, молярность СМ=0,184/0,291=0,63 моль/л.
Для вычисления нормальности сначала определяем эквивалент Н3РО4
Э=1 / (1 3) = 0,33 моль и находим число эквивалентов растворенного вещества в известном объеме раствора (0,291 л):
0,33 моль - 1экв

0,184 моль - х экв х=0,56 экв.
Отсюда нормальность Сн = 0,56 / 0,291 = 1,92 н.
Определяем титр раствора. Так как в 291 мл раствора содержится 18г кислоты, то
Т=18 / 291=0,0618 г/мл.
Пример 2. На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5 н. раствора щелочи. Чему равна нормальность кислоты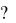
Решение Так как вещества взаимодействуют между собой в эквивалентных
количествах, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.:
V1 / V2 = Cн,2 / Cн,1, или V1Cн,1 = V2 Cн,2,
50 Cн,1 = 25 0,5, откуда Cн,1= 25 0,5/50=0,25 н.
Пример 3. К 1 л 10% - ного раствора KOH (плотность 1,092 г/см3) прибавили 0,5 л 5% -ного раствора KOH (плотность 1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Решение В 1 л 10%-го раствора содержится
1092 10/100 = 109,2 г KOH.
Масса 0,5 л 5% - ного раствора 1045 0,5 = 522,5 г. В этом растворе содержится
522,5 5/100 = 26,125 г KOH.
В общем объеме полученного раствора (2 л ) масса KOH составляет 109,2 + 26,125 = 135,325 г. Отсюда молярность этого раствора Cm = 135,325/(2 56,1) = 1,2 М, где 56,1 – молекулярный вес KOH.
Пример 4. Какой объем 96% - ной кислоты, плотность которой 1,84 г/см3 , потребуется для приготовления 3 л 0,4 н. раствора 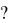
Решение
Эквивалентная масса H2SO4 = М/2 = 98,08/2 = 49,04 г. Для приготовления 3 л 0,4 н. раствора требуется 49,04 0,4 3 = 58,848 г H2SO4. Масса 1 см3 96%- ной кислоты 1,84 г. В этом растворе содержится
1,84 96/100 = 1,766 г H2SO4
Следовательно, для приготовления 3 л 0,4 н. раствора надо взять 58,848 / 1,766 = 33,32 см3 этой кислоты.
Задачи
91.Сколько мл 60% -ного раствора азотной кислоты (плотность 1,367 г/см3)
иводы нужно для приготовления 1 л 10% -ного раствора азотной кислоты (плотность 1,054 г/см3).
92.Определить процентную концентрацию раствора, полученного при прибавлении 300 г воды к 250 г 15% -ного раствора едкого натра.
93.Вычислите молярную, нормальную, моляльную концентрацию и титр 20%-ного раствора хлорида натрия (плотность 1,148 г/см3).
94.Вычислите молярную и нормальную концентрацию раствора серной кислоты, в 200 мл которого содержится 9 г H2SO4.
95.До какого объема нужно довести раствор, содержащий 20 г NaOH, чтобы его концентрация была равна 0,2 М, 0,5 н.
96.Вычислите молярную, нормальную, моляльную концентрации 10%-ного раствора, азотной кислоты (плотность 1,056 г/см3).
97.Сколько мл 30%-ного раствора едкого кали (плотность 1,29 г/см3)
необходимо для приготовления 3 л 0,54 М раствора 98. Вычислите молярную, нормальную, моляльную концентрации и титр
98. Вычислите молярную, нормальную, моляльную концентрации и титр
раствора, содержащего 2 г глюкозы (C2H12O6) в 60 г воды (плотность 1,01 г/см3).
99.Для нейтрализации 20 мл 0,1 н. раствора кислоты потребовалось 6 мл раствора едкого натра. Определить нормальную концентрацию раствора едкого натра и его титр.
100.Определить нормальную концентрацию раствора, полученного при
смешении 800 мл 3,0 н раствора едкого кали и 1,2 л 12% -ного раствора едкого кали (плотность 1,10 г/см3).
Х. Свойства разбавленных растворов неэлектролитов
Неэлектролиты - это вещества, растворение которых не сопровождается распадом на ионы.
Разбавленные растворы неэлектролитов обладают рядом свойств, количественное выражение которых зависит только от числа находящихся в растворе частиц растворенного вещества.
1. Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества (закон Рауля).
(р0-р1 )/ р0=N2=n2 / (n1+n2), p1 = p0N1,
где р0- давление насыщенного пара над чистым растворителем; р1- парциальное давление насыщенного пара растворителя над раствором; n1- количество растворителя (в молях);
n2- количество растворенного вещества (в молях); N1- мольная доля растворителя;
N2- мольная доля растворенного вещества.

2. Повышение температуры кипения и понижение температуры кристаллизации раствора пропорциональны его моляльной концентрации.
tкип = Е |
m, |
tкрист = К |
m, |
где Е- эбуллиоскопическая постоянная растворителя; |
|
К- криоскопическая постоянная растворителя; |
|
m- моляльность раствора. |
|
3. Осмотическое давление раствора пропорционально его молярной |
|
концентрации: |
|
Р = СмRT (закон Вант-Гоффа), |
|
где См- молярность раствора; |
R- газовая постоянная; Т- температура, К. |
Примеры решения задач
Пример 1. Вычислить температуры кристаллизации и кипения 2%- ного раствора глюкозы C6H12O6.
Решение |
|
|
|
|
|
|
|
|
|
||||
tкип. = E m |
|
|
|
|
|
|
|
|
|
||||
tкр. |
= K m |
|
|
|
|
|
|
|
|
|
|||
Моляльность раствора (см. тему IX) равна: |
|
|
|
||||||||||
|
|
n |
2/180 |
|
моль |
|
|
|
|
||||
m = |
|
|
= |
|
( |
|
|
) |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
m р-ля |
0,098 |
|
кг р-ля |
|
|
|
|
||||||
(180 г/моль – молярная масса глюкозы). |
|
|
|
|
|||||||||
Эбуллиоскопическая постоянная для воды 0,52. |
|
|
|
||||||||||
Криоскопическая постоянная для воды 1,86. |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
2/180 |
|
|
|
Тогда повышение температуры кипения |
tкип. = 0,52 |
|
|
= 0,06 С. |
|||||||||
0,098 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
2/180 |
|
|
|
Понижение температуры кристаллизации |
tкр. = 1,86 |
|
|
= 0,21 С. |
|||||||||
|
|
||||||||||||
0,098
Вода кипит при 100 С, следовательно, температура кипения раствора 100 + + 0,06 = 100,06 С; вода кристаллизуется при 0 С, следовательно, температура кристаллизации раствора 0 - 0,21 = - 0,21 С.
Пример 2. Раствор, содержащей 11,04 г глицерина в 800 г воды, кристаллизуется при – 0,279 С. Вычислить молярную массу глицерина.
Решение Температура кристаллизации чистой воды 0 С. Значит, понижение
температуры кристаллизации |
t = 0-(-0,279) = 0,279 С: |
n |
11,04/М |

tкр. = K m = K |
|
|
= 1,86 |
|
= 0,279 |
|
|||||
|
|
|
|||
m р-ля |
|
0,8 |
|
||
(М – молярная масса глицерина).
Отсюда M = (186 11,04) / (0,279 0,8) = 92 г/ моль.
Пример 3.Осмотическое давление раствора, в 250 мл которого содержится 3 г сахара, при 12 С равно 83,14 кПа. Определите относительную молекулярную массу сахара.
Решение
По закону Вант-Гоффа Росмт. = СМRT. Молярность раствора (см. тему IX) равна:
СМ = n/V (моль/л).
Тогда Росмт. = (n/V) RT = [(3/M) / 0.25] 8,314 (273 + 12) = 83,14 (M – молярная масса сахара).
3 8,314 |
(273+12) |
|
|
Отсюда М = |
|
|
= 342 г / моль; |
|
|
||
83,14  0,25
0,25
относительная молекулярная масса сахара равна 342.
Пример 4. Давление насыщенного пара воды при 100 С равно 101,325 кПа. Определить давление пара воды над 10%-ным раствором глицерина.
Решение Из закона Рауля следует, что давление насыщенного пара растворителя над
раствором пропорционально мольной доле растворителя:
p1 = p0 N1
Мольная доля (см. тему IX) растворителя равна
N1 = n1 / (n1 + n2).
900/18
Тогда p1 = 101,325  = 100,74 кПа
= 100,74 кПа
900/18 + 100/342 (342 – молярная масса глицерина, 18 – молярная масса воды).
Задачи
101.Определить температуру замерзания раствора, полученного при раство-
рении 300 г сахара (C12H22O11) в 1500 г воды 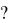 Криоскопическая постоянная воды равна 1,86 град.
Криоскопическая постоянная воды равна 1,86 град.
102.Давление насыщенного пара воды при 100 С равно 101,325 кПа (760
ммрт.ст.). Определить давление пара воды над 4%-ным раствором мочевины CO(NH2)2 при этой температуре.

103.Вычислить осмотическое давление при 0 С раствора, содержащего 3,72
ганилина C6H5NH2 в 1л раствора.
104.Вычислить, сколько глицерина C3H5 (OH)3 нужно растворить в 200 г
воды, чтобы раствор замерзал при -5 С. Криоскопическая постоянная воды 1,86 град.
105.Раствор, содержащий 2,05 г растворенного вещества в 650 г воды, замерзает при –0,93 С. Вычислить относительную молекулярную массу растворенного вещества. Криоскопическая постоянная воды 1,86 град.
106.Вычислить температуру замерзания водного 30%-ного раствора C2H5OH. Криоскопическая постоянная воды 1,86 град.
107.Определить температуру кипения раствора, содержащего 3,46 г
мочевины CO(NH2)2 в 100 г воды. Эбуллиосопическая постоянная воды равна
0,52 град.
108.Вычислить, при какой температуре замерзает водный 35%-ный раствор
глицерина C3H5 (OH)3 Криоскопическая постоянная воды 1,86 град.
109. Осмотическое давление раствора, содержащего 0,4 г растворенного вещества в 660 мл раствора, при 27 С равно 24,91 кПа. Вычислите относительную молекулярную массу растворенного вещества.
110. Осмотическое давление раствора, содержащего 3 г сахара в 250 мл раствора, равно 83,08 кПа при 12 С. Определите относительную молекулярную массу сахара.
XI. Электролитическая диссоциация. Ионное произведение воды.
Водородный показатель
По способности проводить электрический ток в растворе или расплаве вещества делятся на электролиты и неэлектролиты. Электропроводность растворов и расплавов объясняется процессом распада электролитов на ионы, который называется электролитической диссоциацией.
В водных растворах одни электролиты полностью распадаются на ионы, другие - частично, т.е. часть молекул электролита остается в растворе в недиссоциированном виде.
Число , показывающее, какая часть молекул растворенного вещества распалось на ионы, называется степенью электролитической диссоциации:
Степень диссоциации зависит от природы растворяемого вещества и растворителя, температуры (с ее ростом , как правило, увеличивается), концентрации раствора (при разбавлении раствора возрастает).
В зависимости от степени диссоциации электролиты делятся на сильные (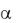 30 % при концентрации раствора 0,1 моль/л) и слабые (
30 % при концентрации раствора 0,1 моль/л) и слабые (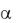 3 % при концентрации 0,1 моль/л).
3 % при концентрации 0,1 моль/л).
К сильным электролитам относятся:

-почти все соли;
-из важнейших кислот: HCl, HBr, HJ, H2SO4, HNO3, HClO4;
-щелочи - гидроксиды металлов IА и IIА групп, кроме Mg и Be. Слабые электролиты и электролиты средней силы:
-почти все органические вещества;
-из кислот: H2CO3, H2S, HCN, H2SiO3, H3PO4, H2SO3, H2C2O4;
-гидроксиды, кроме щелочей, а также NH4OH;
-многие бинарные соединения (Н2О, оксиды и др.).
Врастворах слабых электролитов устанавливается равновесие между недиссоциированными молекулами и ионами, например:
СН3СООН ↔ Н+ + СН3СОО-, к которому применим закон действия масс, и можно определить константу
равновесия, называемую в таких случаях константой диссоциации:
|
К= Н+ СН3СОО- |
/ |
СН3СООН недисс |
|||
В случае электролита АX, диссоциирующего на ионы А+ и Х-, К и |
||||||
связаны соотношением |
|
|
|
|
|
|
|
К= 2См(1- ) |
(Закон разбавления Оствальда). |
||||
Если |
1, то 1- |
1. Тогда выражение закона разбавления упрощается: |
||||
|
|
К= 2 См, откуда |
= |
(К / См )1/2. |
||
Концентрации ионов А+ и X- составляют: |
||||||
|
А+ |
= X- = |
См или А+ |
= X- = (К См)1/2 |
||
Вода, будучи очень слабым электролитом, диссоциирует в |
||||||
незначительной степени: |
|
|
|
|
|
|
|
|
|
Н2О |
|
Н+ + ОН- |
|
Этому процессу соответствует константа диссоциации |
||||||
|
|
|
К= Н+ |
ОН- / Н2О |
||
Поскольку |
очень |
мала, |
|
то |
равновесная концентрация |
|
недиссоциированных молекул воды [ 2О] практически равна общей концентрации воды, т.е. 1000/18=55,55 моль/л, и выражение для константы диссоции воды можно преобразовать:
[H+] [OH-]=K[H2O] =KH2O
KН2О- постоянная при данной температуре величина, называется ионным произведением воды; она зависит только от температуры.
В чистой воде при 25 С [Н+]=[ОН-]=10-7 моль/л, следовательно, КН2О=10-14.
Эта величина справедлива и для разбавленных водных растворов. Концентрации [H+] и [ОН-] взаимосвязаны: чем больше одна величина,
тем меньше другая, и наоборот. Но их произведение при данной температуре
остается постоянным. |
|
|
Растворы, в которых |
[Н+]=[ОН-], |
называются нейтральными, если |
[H+] [OH-], -кислыми, если [OH-] [H+], - щелочными. |
||
Вместо концентрации |
ионов Н+ |
и ОН- удобнее пользоваться их |
обратными десятичными логарифмами; эти величины обозначаются символами

и |
и называются соответственно водородным и гидроксильным |
||
показателями: |
|
|
|
|
|
lg [H+] и |
lg [OH-] |
|
При 25 С |
При этой температуре в нейтральных растворах |
|
|
в кислых |
в щелочных |
|
Примеры решения задач
Пример 1. Вычислить степень диссоциации и концентрацию ионов водорода в 0,1 М растворе HClO .
Константа диссоциации HClO равна |
-8 . |
||||
Решение. [H+]= |
К См |
= 5 10-8 0,1=7 10-5 моль/л. |
|||
[H+]= Cм |
, |
[H+]/CM=7 |
/0,1=7 |
моль/л |
|
или |
|
|
|
|
|
К/См |
= |
|
/0,1 = 7 10-4 моль/л, |
||
[Н+]= См=7 10-4 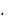 0,1=7 10-5 моль/л.
0,1=7 10-5 моль/л.
Пример 2. При какой массовой доле муравьиной кислоты в растворе
(плотность 1 г/мл) 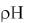
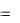 ? Константа диссоциации кислоты при 25 С равна 1,8
? Константа диссоциации кислоты при 25 С равна 1,8
10-4.
Решение
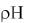
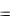 lg[H+]=2, отсюда [H+]=10-2 моль/л. Находим молярность раствора.
lg[H+]=2, отсюда [H+]=10-2 моль/л. Находим молярность раствора.
[H+]= K Cм |
, тогда См= [H+]2/K=(10-2)2/1,8 10-4=0,55 моль/л. |
Пересчитываем молярную концентрацию в массовую долю. |
|
MНСООН=46 г/моль |
|
=mВ/mР-РА=См М/V |
=0,55 46/1000 1=0,025 (2,5 ) |
Пример 3. [OH-]=10-3 моль/л. Вычислить 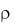 . Решение
. Решение
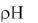
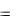 lg[H+] [OH-][H+]=10-14,
lg[H+] [OH-][H+]=10-14,
следовательно, [H+]=10-14/[OH-]=10-14/10-3=10-11 моль/л; 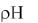
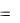 lg 10-11=11.
lg 10-11=11.
Пример 4.Определить |
раствора а(OH)2 при 25 С, имеющего |
||
концентрацию 0,012 моль/л. |
|
||
Решение |
|
|
|
а |
2 |
а2+ |
- |
