
Химия
.pdf
атомами типичных металлов и неметаллов (CsF, BaCl2, Na2O). Например, образование молекулы NaCl можно представить следующим образом:
Na0 - 1e |
Na+ , Cl0 + 1e |
Cl-, Na+ + Cl- = NaCl |
Ионы Na+ и Cl- имеют завершенные (8-электронные) внешние оболочки. Молекул с чисто ионной связью нет. Даже в молекуле CsF электронная
пара лишь на 89% принадлежит фтору, а на 11% - цезию. Поэтому говорят о степени ионности связи.
В отличие от ковалентной ионная связь является ненаправленной и ненасыщенной. Каждый ион способен притягивать, координировать вокруг себя равноценно по всем направлениям ионы противоположного знака. Например, координационное число в кристалле NaCl равно 6, т.е. каждый ион Na+ связан с 6 ионами Cl- и наоборот.
Металлической называется связь, осуществляемая между всеми атомами в кристаллической решетке металла совокупностью обобществленных валентных электронов.
Атомы металлов имеют на внешнем уровне много свободных орбиталей и мало валентных электронов. Валентные электроны имеют возможность беспрепятственно переходить от атома к атому, становятся общими для всех атомов, образующих кристаллическую решетку металла. Совокупность хаотически движущихся обобществленных валентных электронов называют электронным газом. Его высокой подвижностью объясняются такие характерные свойства металлов, как тепло - и электропроводность; отсутствием локализованных химических связей - пластичность и ковкость.
Энергия (прочность) металлической связи растет с увеличением числа валентных электронов и заряда ядра.
Примеры решения задач
Пример 1. Какую валентность, обусловленную неспаренными электронами, может проявлять фосфор в нормальном и возбужденном состояниях ?
Решение
Распределение электронов внешнего энергетического уровня фосфора
3s23p3:
3d0
3p3 3s2 
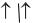

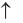

15P
Атомы фосфора имеют свободные d-орбитали, поэтому возможен переход одного S-электрона на 3d-подуровень:
3d1

3p3
3s1
15P
Следовательно, в соответствии с числом неспаренных электронов, валентность фосфора в нормальном состоянии равна трем (например, РН3), а в возбужденном - пяти (например, РСl5).
Пример 2. Как изменяется прочность связи Н-Э в ряду Н2О - Н2S - H2Se -
H2Te ?
Решение В указанном ряду размеры валентных электронных облаков элементов
(O,S,Se,Te) возрастают, что приводит к уменьшению степени их перекрывания с электронным облаком атома водорода и к возрастающему удалению области перекрывания от ядра атома соответствующего элемента. Это вызывает ослабление притяжения ядер взаимодействующих атомов к области перекрывания электронных облаков, т.е. ослабление связи. Таким образом, при переходе от кислорода к теллуру прочность связи Н-Э уменьшается.
Пример 3. Что такое гибридизация валентных орбиталей ? Какое строение имеют молекулы типа АВn, если связь в них образуется за счет sp-,sp2-,sp3- гибридизации орбиталей атома А?
Решение Теория валентных связей предполагает участие в образовании
ковалентных связей не только «чистых» атомных орбиталей, но и «смешанных», так называемых гибридных атомных орбиталей. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и одинаковой энергии. Число гибридных орбиталей равно числу исходных.
Гибридизация орбиталей и пространственная конфигурация молекул
Тип |
Исходные |
Тип гиб- |
Число гиб- |
Пространствен- |
Валентный |
молекулы |
орбитали |
ридизации |
ридных ор- |
ная конфигу- |
угол* |
|
атома А |
|
биталей |
рация молекул |
|
|
|
|
атома А |
|
|
АВ2 |
S+P |
SP |
2 |
линейная |
1800 |
АВ3 |
S+P+P |
SP2 |
3 |
треугольная |
1200 |
АВ4 |
S+P+P+P |
SP3 |
4 |
тетраэдрическая |
109028 |
|
|
|
|
|
|
Валентным называется угол между двумя ближайшими связями в молекуле.

Задачи
61. Какова современная формулировка периодического закона В чем причина периодической зависимости свойств элементов и образуемых ими соединений от заряда ядра атомов
В чем причина периодической зависимости свойств элементов и образуемых ими соединений от заряда ядра атомов
62.Что такое ковалентность элементов Напишите электронные формулы кислорода и серы, распределите электроны по энергетическим ячейкам в нормальном и возбужденном состояниях, определите возможные ковалентности этих элементов.
Напишите электронные формулы кислорода и серы, распределите электроны по энергетическим ячейкам в нормальном и возбужденном состояниях, определите возможные ковалентности этих элементов.
63.Какая химическая связь называется ковалентной Как она образуется и каковы ее свойства
Как она образуется и каковы ее свойства
64.Какая химическая связь называется ионной Как она образуется и каковы ее свойства
Как она образуется и каковы ее свойства
65. Что такое - и - связь Напишите электронную формулу азота, распределите электроны по энергетическим ячейкам, определите его ковалентность. Какие связи в молекуле азота
Напишите электронную формулу азота, распределите электроны по энергетическим ячейкам, определите его ковалентность. Какие связи в молекуле азота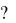
66.Определите характер связей в молекулах LiF, HF, F2 . Укажите смещение электронного облака связи с учетом величин электроотрицательностей (ЭО).
67.Что такое гибридизация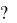 Определите тип гибридизации валентных орбиталей бериллия при образовании молекулы BeCl2 и ее форму.
Определите тип гибридизации валентных орбиталей бериллия при образовании молекулы BeCl2 и ее форму.
68.Определите направление связей в молекуле аммиака и ее форму. Укажите смещение электронного облака связи с учетом величин ЭО.
69.Определите форму молекул H2O, H2Se. Как изменяется величина
валентного угла в молекулах этих соединений
70. Что такое допорно-акценторная связь Объясните механизм образования ионов BF4- ; [Zn(NH3)4]2+.
VII. Термохимия и термодинамика
К важнейшим величинам, характеризующим химические системы, относятся внутренняя энергия U, энтальпия, энтропия S и энергия Гиббса. Все эти величины представляют собой функции состояния и не зависят от способа, которым это состояние, достигнуто.
Химические реакции чаще осуществляются при постоянном давлении (изобарный процесс). В подобных случаях для энергетической характеристики процесса удобнее пользоваться не внутренней энергией U, а энтальпией
H(кДж).
В результате реакции энтальпия системы либо возврастает ( Н 0), т.е. система поглощает энергию из внешней среды (эндотермическая реакция), либо уменьшается ( Н 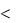 0), т.е. система выделяет энергию (экзотермическая реакция).
0), т.е. система выделяет энергию (экзотермическая реакция).

В основе расчетов, связанных с изменением энтальпии или внутренней энергии системы в результате реакции, лежит закон Гесса:
Тепловой эффект химической реакции зависит только от начального и конечного состояний участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
Упрощает многие термохимические расчеты следствие из закона Гесса: Стандартное изменение энтальпии химической реакции равно разности
между суммами стандартных |
энтальпий образования продуктов реакции и |
|
исходных веществ: |
Н= Нпрод |
Нисх. |
Стандартными в термодинамике приняты следующие условия: давление |
||
101,3 кПа (1 атмосфера); температура 298 К (250С). |
||
Стандартной |
энтальпией |
образования сложного вещества (кДж/моль) |
называется стандартное изменение энтальпии при химической реакции (или, короче, стандартная энтальпия реакции) образования 1 моля данного вещества из простых веществ.
Энтальпии образования простых веществ принимаются равными нулю. Направление, в котором самопроизвольно протекает химическая реакция,
определяется совместным действием двух факторов:
1) тенденцией к переходу системы в состояние с наименьшей внутренней энергией (энтальпией) и 2) тенденцией к достижению наиболее вероятного состояния, т.е. состояния, которое может быть реализовано наибольшим числом равновероятных способов (микросостояний).
Мерой вероятности состояния системы является энтропия S(Дж/моль.К) - величина, пропорциональная числу равновероятных микросостояний, которыми может быть реализована данное макросостояние.
Энтропия возрастает при переходе вещества из кристаллического состояния в жидкое, из жидкого в газообразное, при расширении газов, растворении вещества и т.п. Во всех этих случаях упорядоченность системы понижается, беспорядок возрастает, поэтому можно говорить, что энтропия является мерой беспорядка системы.
Влияние обеих тенденций на направление протекание процесса отражает функция состояния, называемая энергией Гиббса; она связана с энтальпией и энтропией соотношением
G = H TS
Как и в случае Н и S, изменение энергии Гиббса G (KДж) в результате химической реакции (или, короче, энергия Гиббса реакции) равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ:
G = |
Gпрод |
Gисх |
Изменение энергии Гиббса |
G является мерой самопроизвольного |
|
протекания химической реакции: при постоянных температуре и давлении реакция может протекать самопроизвольно в сторону уменьшения энергии Гиббса ( G=G2-G1 0).

Из анализа выражения G= H-T S видно, что наиболее вероятно самопроизвольное протекание экзотермических реакций, протекающих с повышением энтропии и, с другой стороны, самопроизвольное протекание эндотермических реакций, идущих с уменьшением энтропии, невозможно. При низких температурах наиболее вероятно протекание экзотермических реакций, при высоких - реакций, сопровождающихся возрастанием энтропии.
Примеры решения задач Пример 1. Могут ли в стандартных условиях самопроизвольно протекать в
прямом направлении при 298 К реакции |
|
|
|
Cl2 (г.) + 2HJ(г.)=J2(K.)+2HCl(г.) , |
|
(1) |
|
J2(K.)+H2S(г.)=2HJ(г.)+S(K.) ? |
|
|
(2) |
Как скажется рост температуры на направлении протекания этих реакций? |
|||
Решение |
|
|
|
Находим знаки G0298 для этих реакций. Используем |
справочные данные |
||
G0 образования (кДж/моль) для HJ (1,8), HCl (-95,2) и H2S (-33,8). |
|||
Тогда для реакций (1) и (2) соответственно: |
|
|
|
G= Gпрод- |
Gисх |
|
|
G01=-95,2 2 - 1,8 2= -194,0 |
кДж |
|
|
G02=1,8 2- (-33,8)=37,4 кДж |
|
||
Отрицательный знак G01, указывает на возможность самопроизвольного |
|||
протекания реакции (1); положительный знак |
G02 означает, что реакция (2) в |
||
указанных условиях протекать не может. |
|
|
|
Ответ на второй вопрос определяется знаком |
S0 |
данных реакций. В |
|
реакции (1) число молей веществ в газообразном состоянии уменьшается, в
реакции (2) - возрастает. Следовательно, |
S01 0 |
и S02 0, т.е. в уравнении |
G= H0-T S второй член для реакции (1) |
положителен, а для реакции (2) - |
|
отрицателен. Значит, с возрастанием Т значение |
G01 будет возрастать (т.е. |
|
становиться менее отрицательным), а G02 |
- уменьшаться (становиться менее |
|
положительным). Это означает, что повышение температуры будет препятствовать протеканию реакции (1) и благоприятствовать протеканию реакции (2) в прямом направлении.
Пример 2. Установить, возможно ли при температурах 298 и 2500 К восстановление диоксида титана до свободного металла по реакции
восстановление диоксида титана до свободного металла по реакции
TiO2(k)+2C(k) = Ti(k)+2CO(г)
Зависимостью Н0 и S0 от температуры пренебречь. Решение
Используем справочные данные по величинам Gобр (кДж/моль) при 298К для TiO2 (-888,6) и СО (-137,1). Тогда для данной реакции:
G= Gпрод-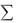 Gисх
Gисх
G0298=-137,1 2-(-888,6)=614,4кДж

Поскольку |
G |
восстановление TiO при 2980К невозможно. |
Для расчета |
G |
воспользуемся уравнением G = H T S . При этом, в |
соответствии с указанием в условии задачи, используем справочные значения
Н и S |
при 298 К |
|
Н обр(кДж/моль) TiO =-943,9; CO=-110,5; S (Дж/моль К) |
|
TiO =50,3; C=5,7; Ti=30,6 и СО=197,5 |
||||
Тогда для рассматриваемой реакции |
||||
|
|
|
|
Н =-110,5 2-(-943,9)=722,9 кДж , |
|
|
|
S =30,6+197,5 2-50,3-5,7 2=363,9 Дж/К . |
|
Находим |
G |
реакции (выражая S0 в кДж/К): |
||
G |
= H |
-T |
S |
=722,9-2500 363,9/1000=-186,9кДж. |
Таким образом, |
G |
0, так что восстановление TiO2 графитом при |
||
2500 К возможно.
Задачи
71. Вычислите энергию Гиббса и определите возможность протекания
реакции |
|
|
|
|
|
|
Fe2O3 (т) + 3CO (г) = 2Fe (т) + 3CO2 (г) |
|
|||
∆H298, кДж/моль |
-823 |
-110,6 |
0 |
-393,8 |
|
S298, Дж/ (моль • град) |
87,5 |
197,7 |
27,2 |
213,8 |
|
при температурах 1000 и 2000 К. |
|
|
|
|
|
72.* |
|
|
|
|
|
|
Fe2O3 (т) + 3H2 (г) = 2Fe (т) + 3H 2O (г) |
|
|||
∆H298, кДж/моль |
-823 |
0 |
0 |
-242 |
|
S298, Дж/ (моль • град) |
87,5 |
130,7 |
27,2 |
189 |
|
при температурах 500 и 2000 К. |
|
|
|
|
|
73.* |
|
|
|
|
|
|
WO3 (т) + 3H2 (г) = W (т) + 3H 2O (г) |
|
|||
∆H298, кДж/моль |
-843 |
0 |
0 |
-242 |
|
S298, Дж/ (моль • град) |
75,9 |
130,7 |
32,6 |
189 |
|
при температурах 600 и 1500 К. |
|
|
|
|
|
74.* |
|
|
|
|
|
|
TiCl4 (г) + 2Mg (т) = Ti (т) + 2MgCl2 (г) |
||||
∆H298, кДж/моль |
-763 |
0 |
0 |
-641 |
|
S298, Дж/ (моль • град) |
352 |
32,7 |
30,6 |
90 |
|
при температурах 400 и 1600 К. |
|
|
|
|
|
75.* |
|
|
|
|
|
|
TiO2 (г) + 2C (т) + 2Cl2 (г) = TiСl4 (г) + 2СО (г) |
||||
∆H298, кДж/моль |
-943,5 |
0 |
0 |
-763 |
-110,6 |
S298, Дж/ (моль • град) |
50,2 |
5,7 |
223 |
|
352 |
197,7 |
при температурах 800 и 1500 К |
|
|
|
|
|
|
76.* |
|
|
|
|
|
|
|
MgO (г) + C (т) = Mg (т) + СО (г) |
|
||||
∆H298, кДж/моль |
-691,8 |
0 |
0 |
-110,6 |
|
|
S298, Дж/ (моль • град) |
26,9 |
5,7 |
32,7 |
|
197,7 |
|
при температурах 1000 и 3000 К. |
|
|
|
|
|
|
77.* |
|
|
|
|
|
|
|
3V2O5 (т) + 10Al (г) = 6V (г) + 5Al2O3 (т) |
|||||
∆H298, кДж/моль |
-1573 |
0 |
0 |
|
-1677 |
|
S298, Дж/ (моль • град) |
131 |
28,4 |
28,9 |
|
50,9 |
|
при температурах 500 и 1500 К. |
|
|
|
|
|
|
78.* |
|
|
|
|
|
|
|
4Fe(OH)2 (т) + O2 (г) + 2H2O (ж) = Fe(OH)3 (т) |
|||||
∆G298, кДж/моль |
-480 |
0 |
-237 |
-700 |
||
при стандартных условиях. |
|
|
|
|
|
|
79.* |
|
|
|
|
|
|
|
Cr2O3 (т) + 3C (т) = 2Cr (т) + 3СO (г) |
|
||||
∆H298, кДж/моль |
-1141 |
0 |
0 |
|
-110,6 |
|
S298, Дж/ (моль • град) |
81,2 |
5,7 |
23,6 |
|
197,7 |
|
при температурах 1000 и 3000 К. |
|
|
|
|
|
|
80.* |
|
|
|
|
|
|
|
NiO (т) + CO (г) = Ni (т) + СO2 (г) |
|
||||
∆H298, кДж/моль |
-239,7 |
-110,6 |
0 |
|
-393,8 |
|
S298, Дж/ (моль • град) |
37,9 |
197,7 |
29,9 |
|
213,8 |
|
при температурах 800 и 1500 К. * См. условие задачи 71.
VIII. Скорость химической реакции. Химическое равновесие
Скорость химической реакции измеряется качеством вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема системы (для гомогенной, т.е. однофазной реакции) или на единице площади поверхности раздела фаз (для гетерогенной, т.е. двухфазной реакции).

Для гомогенной реакции, протекающей при постоянном объеме,
Vгомог = С/ t ( С - изменение мольной концентрации какого-либо из веществисходных или конечных).
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и присутствия в системе катализаторов.
Согласно закону действия масс при постоянной температуре скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам. Например, для реакции
2NO + O2 = 2NO2
выражение скорости по закону действия масс будет следующим:
V = k NO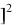 O2
O2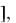
где k - константа скорости реакции, ее значение зависит от природы реагирующих веществ.
При гетерогенных реакциях концентрации веществ в твердой фазе обычно не изменяются в ходе реакции и поэтому не включаются в уравнение закона действия масс:
3Fe(T) + 2CO(г) = Fe3C(T) + CO2 (г) V = k CO 2
Зависимость скорости (или константы скорости) от температуры может быть выражена уравнением
Vt+ t = Vt |
t |
, |
|
выражающим эмпирическое правило Вант-Гоффа: повышение температуры на каждые 100С увеличивает скорость реакции в 2-4 раза. Здесь Vt- скорость реакции при температуре t, Vt+ t - скорость реакции при повышенной температуре, -температурный коэффициент скорости реакции.
Для обратимых реакций характерно состояние, называемое химическим равновесием, при котором скорости прямой и обратной реакций одинаковы и изменения концентраций реагирующих веществ, называемых равновесными, не происходит.
Так, для реакции А+2В C+D по закону действия масс имеем:
V = k A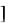 B , V = k C D
B , V = k C D
В состоянии химического равновесия V = V, т.е. k A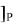 B
B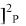 = k C
= k C D . Отсюда
D . Отсюда
k / k = C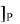 D
D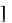 /( A
/( A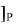 B
B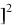 )= Kр,
)= Kр,
где Кр 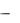 константа равновесия реакции. Численное значение константы равновесия характеризует выход данной реакции. Так, Кр
константа равновесия реакции. Численное значение константы равновесия характеризует выход данной реакции. Так, Кр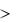 1 при значительном превышении концентраций продуктов реакции над концентрациями исходных
1 при значительном превышении концентраций продуктов реакции над концентрациями исходных

веществ, а это значит, что выход реакции велик. При Кр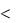 1 (по аналогичной причине) выход реакции мал.
1 (по аналогичной причине) выход реакции мал.
Константа зависит от природы реагирующих веществ, от температуры и не зависит от концентраций веществ. Независима она и от присутствия катализаторов. Изменение концентраций любого из веществ, составляющих равновесную систему, влечет за собой изменение концентраций всех остальных веществ, в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
Процесс перехода от одного равновесного состояния к новому равновесию называется смещением химического равновесия. Направление этого смещения подчиняется принципу Ле Шателье:
Если на систему, находящуюся в состоянии равновесия, оказать какоелибо воздействие, то равновесие сместится в таком направлении, что оказанное воздействие будет ослаблено.
Константа равновесия химической реакции связана со стандартным изменением энергии Гиббса этой реакции уравнением
G = - 2,3RTlgK
Анализ уравнения показывает, что при отрицательных значениях G равновесие смещено в направлении прямой реакции, и выход продуктов сравнительно велик, при положительном знаке G0 равновесие смещено в сторону обратной реакции, и выход продуктов прямой реакции сравнительно мал.
Примеры решения задач
Пример 1. Сместится ли равновесие системы
4HCl(г)+O2(г) |
2Cl2(г)+2H2O(г)+Q |
|
если повысить давление в 2 раза; если повысить температуру ? |
||
Решение. По закону действия масс имеем |
|
|
V0 = k HCl 4 |
O2 , V0 = k Cl2 |
2 H2O 2 |
Для веществ в газовой фазе |
повышение давления в системе означает |
|
увеличение их концентраций в соответствующее число раз. |
||
Тогда |
|
|
V = k 2HCl 4 2O2 , V = k 2Cl2 |
2 2H2O 2 |
|
или |
|
|
V = 24 2 k HCl 4 O2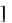 = 32V0, V = 22 22 k Cl2
= 32V0, V = 22 22 k Cl2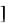 H2O
H2O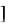 = 16V0
= 16V0
То есть, скорость прямой реакции возрастет в 32 раза, а скорость обратной - в 16 раз.
Таким образом, равновесие системы нарушится и сместится в сторону прямой реакции.
На этот же вопрос можно ответить, используя принцип Ле Шателье . Равновесие системы при повышении давления сместится так, чтобы
ослабить это воздействие, т.е. в сторону реакции, идущей с понижением давления. А понижается давление по прямой реакции, т.к. она протекает с уменьшением числа газообразных молекул (обратная реакция идет, соответственно, с повышением давления). Следовательно, повышение давления в данной равновесной системе приведет к смещению равновесия в сторону прямой реакции.
Принцип Ле Шателье дает ответ и на второй вопрос задачи. При повышении температуры равновесие системы сместится так, чтобы ослабить это воздействие, т.е. в сторону реакции, идущей с поглощением тепла. По условию задачи прямая реакция - экзотермическая, идет с выделением тепла, значит, обратная - эндотермическая, идет с поглощением тепла. Следовательно, повышение температуры приведет к смещению равновесия в сторону обратной реакции.
В реальности закон действия масс неприменим к данной реакции в целом, поскольку одновременное столкновение более чем трех частиц крайне маловероятно. Реакции, в уравнения которых входит большее число частиц, протекают в несколько стадий, и закон действия масс применим лишь к отдельным стадиям процесса.
Пример 2. В системе А(г) + 2В(г) |
С(г) равновесные концентрации равны: |
А = 0,06 моль/л; В = 0,12 моль/л; |
С = 0,216 моль/л. Найти константу |
равновесия и исходные концентрации веществ А и В. Решение
Подставляем данные задачи в выражение константы равновесия:
К= С р / ( А р В 2р) = 0,216 / (0,06 0,122) = 250
Для нахождения исходных концентраций веществ А и В учтем, что, если известно изменение концентрации одного из веществ, то по уравнению реакции можно найти изменения концентраций всех других веществ, составляющих реакционную систему. Согласно уравнению реакции, из 1 моля А и 2 молей В образуется 1 моль С. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моля вещества С, то при этом было израсходовано 0,216 моля А и 0,216  2=0,432 моля В. Таким образом, искомые исходные концентрации равны:
2=0,432 моля В. Таким образом, искомые исходные концентрации равны:
А 0 = 0,06+0,216 = 0,276 моль/л В 0 = 0,12+0,432 = 0,552 моль/л
Пример 3. Константа равновесия гомогенной системы
СО(г)+Н2О(г) СО2(г)+Н2(г)
