
Химия
.pdf
При нахождении эквивалентов О2 и Н2 учтем, что валентность кислорода
равна 2, водорода -1. |
|
1 |
1 |
ЭО2 = —— = 0,25 моль, |
ЭН2 = —— = 0,5 моль |
2 ×2 |
2×1 |
Эквивалентные объемы соответственно VЭО2 = 22,4 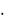 0,25 = 5,6 л, VЭН2 =
0,25 = 5,6 л, VЭН2 =
22,4 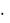 0,5 = 11,2 л.
0,5 = 11,2 л.
При нахождении эквивалента H2SO4 в приведенных реакциях примем во внимание, что число атомов Н, замещенных в первой реакции, равно 1, а во второй -2. Поэтому в формуле Э = 1 / (z 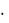 n) в первом случае n=1, а во втором n=2. Значит,
n) в первом случае n=1, а во втором n=2. Значит,
ЭH2SO4=1 /(1 1) =1 моль и Э.М. H2SO4= М H2SO4=98 г - для реакции с КОН и
ЭH2SO4=1/(1 2) =0,5 моль и Э.М. H2SO4= М H2SO4 /2= 98/2 = 49 г - для реакции
сметаллическим магнием.
Пример 2. При соединении 1,5 г натрия с избытком хлора образовалось 3,81 г хлорида натрия. Найти эквивалентную массу натрия и его эквивалент, если известно, что эквивалентная масса хлора равна 35,45 г.
Решение. Из условия следует, что в хлориде натрия на 1,5 г натрия приходится 3,81-1,50 =2,31 г хлора. Следовательно,
1,5 г натрия эквивалентны 2,31 г хлора.
Э.М.Na |
— ― — |
35,45 г хлора. |
Отсюда Э.М.Na = (1,5 |
35,45) / 2,31 = 23 г. |
|
Молярная масса атомов натрия также равна 23 г/моль. Следовательно, эквивалент натрия равен 1 моль.
Пример 3. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода при н.у. Вычислить эквивалент оксида и эквивалент металла. Чему равен атомный вес металла?
Решение. По закону эквивалентов:
mMeO m H2
——— = ———
Э.М.MeO Э.М. H2
Для газообразного вещества - водорода массовое отношение заменим равным ему объемным отношением V H2 : VЭ H2:
mMeO |
V H2 |
7,09 2,24 |
7,09 11,2 |
——— = ——— , —— = —— , |
Э.М.MeO = ———— = 35,45 г |
||
Э.М.MeO |
VЭ H2 |
Э.М.MeO 11,2 |
2,24 |
По закону эквивалентов Э.М.MeO = Э.М.Me + Э.М. O2, отсюда Э.М.Me =
Э.М.MeO - Э.М. O2 = 35,45 - 8 = 27,45 г.
Атомный вес металла определяем из соотношения Э.М. = А/В, где А - атомный вес, В - валентность элемента.

А = Э.М. 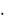 В = 27,45
В = 27,45 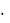 2 = 54,9
2 = 54,9
Задачи
31. Сколько граммов металла, эквивалент которого 12,16, взаимодействует с
310 см3 кислорода, измеренного при н.у.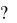
32.При восстановлении водородом 10,17 г оксида двухвалентного металла образовалось 2,25 г воды. Вычислите эквивалент оксида и эквивалент
металла. Чему равен атомный вес металла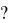
33.В 2,48 г оксида одновалентного металла содержится 1,84 металла. Вычислите эквиваленты металла и его оксида.
34.Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34 г металла окисляются 0,680 л кислорода (условия нормальные).
35.Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определить массу металла.
36.Вычислите эквивалентную массу ортофосфорой кислоты, если при нейтрализации 9,797 г израсходовано 7,998 гидроксида натрия.
37.На нейтрализацию 1,8 г кислоты идет 2,0 г гидроксида натрия. Определите эквивалентную массу кислоты.
38.Вычислить эквивалентную массу Cu (OH)2 в реакциях:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O ; |
Cu (OH)2 + HCl = CuOHCl + H2O |
39.На восстановление 1,80 г оксида металла израсходовано 0,838 л водорода, измеренного при н.у. Вычислите эквивалентную массу металла.
40.Вычислите эквивалентную массу алюминия, если 0,5 г его вытесняют из раствора кислоты 0,056 г водорода.
IV. Состояние электрона в атоме
Химические свойства элементов определяются электронным строением их атомов.
Электрон можно представить как некое ―облако‖, не имеющее четких границ, ―размазанное‖ по всему объему атома и имеющее разную ―плотность‖ на различном расстоянии от ядра.
Особенно важное значение для характеристики состояния электрона имеет волновая функция . Чем больше значение 2 в данной области пространства, тем выше вероятность того, что электрон проявит здесь свое действие, т.е. что его существование будет обнаружено в каком-либо физическом процессе. Вероятность обнаружения электрона в некотором конкретном малом объеме V выражается произведением 2 V.
Энергия электрона в атоме может принимать только определенные значения, т.е. она квантована. Возможные энергетические состояния электрона

в атоме определяются величиной главного квантового числа n (n=1,2,3... ). Принято говорить, что n характеризует определенный энергетический уровень электрона в атоме: при n=1 электрон находится на первом энергетическом уровне, при n=2 - на втором и т.д.
Главное квантовое число определяет и размеры электронного облака. Электроны, имеющие одно и то же значение n, образуют электронные облака приблизительно одинаковых размеров, поэтому можно говорить о существовании в атоме электронных слоев или оболочек, отвечающих определенным значениям главного квантового числа. Чем n, тем энергия e, тем ближе к ядру он находится, тем прочнее он с ним связан, и наоборот.
Форма электронного облака также не может быть произвольной. Она определяется орбитальным (побочным) квантовым числом L (L=0...n-1). Это связано с тем, что электрон в атоме не только притягивается ядром, но и испытывает отталкивание со стороны электронов, расположенных между данным e- и ядром. Внутренние электронные слои как бы образуют своеобразный экран, ослабляющий притяжение электрона к ядру, или, как принято говорить, экранируют внешний электрон от ядерного заряда. При этом для электронов, различающихся значением L, экранирование оказывается неодинаковым.
В многоэлектронных атомах энергия электрона зависит и от значения L. Поэтому состояния электрона, характеризующиеся различными значениями L, называются энергетическими подуровнями электрона в атоме. Им присвоены буквенные обозначения: L=0-s-подуровень(s-электрон), L=1-p-подуровень(p- электрон), L=2-d-подуровень(d-электрон), L=3-f-подуровень(f-электрон).
Ориентация электронного облака в пространстве определяется значением третьего квантового числа, называемого магнитным (m=-l...0..+l). Число значений m для данного l и есть число возможных пространственных ориентаций данного типа электрона. Состояние электрона в атоме, характеризующееся определенными значениями квантовых чисел n, l, и m, т.е. определенными размерами, формой и ориентацией в пространстве, получило название атомной электронной орбитали. Электрон с вероятностью 90-95% находится внутри области пространства, охватываемого атомной орбиталью.
Электрон характеризуется еще одной квантовой величиной, не связанной с его движением вокруг ядра, а определяющей его собственное состояние. Она называется спиновым квантовым числом (S= 1/2). Упрощенно спин электрона можно рассматривать как результат его вращения вокруг собственной оси.
Принцип Паули: в атоме не может быть двух электронов, у которых все 4 квантовых числа были бы одинаковыми. Следовательно, каждая орбиталь может быть занята не более чем двумя электронами с противоположными спинами (спаренные электроны).
Правило Гунда: устойчивому состоянию атома соответствует распределение электронов с максимальным абсолютным значением суммарного спина в пределах подуровня.
В любом атоме число орбиталей бесконечно. С увеличением заряда число электронов в атоме увеличивается , причем заполнение орбиталей электронами происходит в определенной последовательности по принципу наименьшего запаса энергии, согласно которому наиболее устойчиво такое состояние атома, при котором его электроны имеют наименьшую энергию, а наименьшей энергией обладают подуровни с самыми низкими значениями n и l. Таким образом, заполнение орбиталей идет в порядке возрастания суммы n+l ( первое правило Клечковского). При одинаковых значениях суммы n+l в первую очередь заполняется орбиталь с меньшим значением n (второе правило Клечковского).
Примеры решения задач
Пример 1. Какой подуровень будет заполняться вслед за подуровнем 4s ? Решение. Подуровню 4s соответствует сумма n+l=4+0=4. Такую же сумму имеет 3p подуровень, но он заполняется раньше, т.к. имеет меньшее значение главного квантового числа. Значит, после подуровня 4s будет заполняться подуровень с суммой n+l=5, причем из всех возможных комбинаций n+l, соответствующих этой сумме (3+2, 4+1, 5+0), первой будет реализовываться комбинация с наименьшим значением n, т.е. вслед за подуровнем 4s будет заполняться подуровень 3d.
Пример 2. Сколько электронов максимально может разместиться на 3 уровне? Решение. По условию n=3, значит, l=0,1,2, т.е., на 3 уровне существует 3s, 3p и 3d подуровни. Определяем максимальное число электронов на каждом подуровне: для s-подуровня любого уровня l=0, значит, m=0, т.е. m имеет одно значение, следовательно, на s-подуровне только одна орбиталь с двумя электронами (3s2); для р-подуровня любого уровня l=1, значит, m=-1,0,1, т.е. m имеет три значения, следовательно, на р-подуровне три орбитали с шестью электронами (3р6); для d-подуровня любого уровня l=2, значит, m=-2,-1,0,1,2, т.е. m имеет пять значений, следовательно, на d-подуровне пять орбиталей с десятью электронами (3d10).
Итого, на третьем уровне может размещаться 2+6+10=18 электронов. Число орбиталей на подуровне можно определить по формуле 2l+1.
Максимальное число электронов на подуровне 2(2l+1). Максимальное число электронов на уровне 2n2.
Пример 3. Составить электронные формулы атомов элементов с порядковыми номерами 20 и 25 и графические схемы заполнения электронами валентных орбиталей. Определить число валентных электронов для каждого атома. Показать графические схемы заполнения валентных орбиталей атомов в возбужденном состоянии.
Решение. С учетом последовательности заполнения уровней и подуровней по правилам Клечковского (1s2s2p3s3p4s3d4p и т.д.) cоставляем электронные
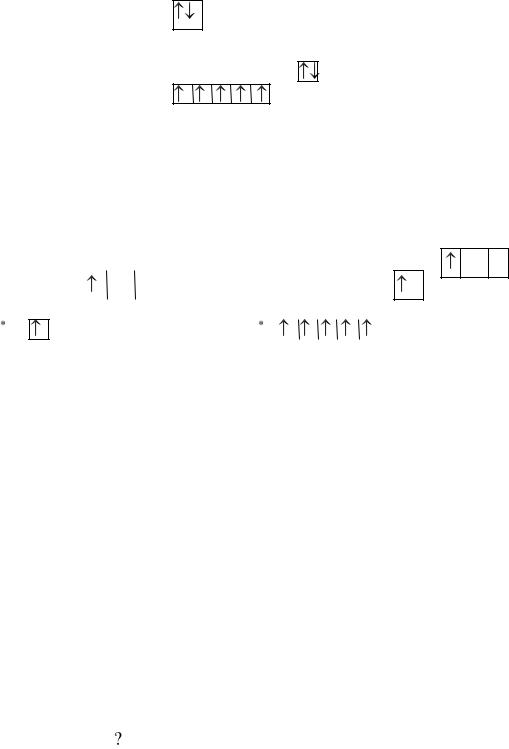
формулы элементов, распределяя по орбиталям соответственно 20 и 25 электронов.
№20 (Ca ) 1s22s22p63s23p63d04s2
№25 (Mn) 1s22s22p63s23p63d54s2
Графические схемы: 4s2
Ca 2 валентных электрона
4s2
3d5
Mn |
7 валентных электронов |
Валентными являются электроны внешнего и предвнешнего заполняющегося (d
иf) подуровня.
Ввозбужденном состоянии атома происходит «распаривание» валентных электронов путем их перехода на ближайший подуровень того же уровня:
4p1
|
4р1 |
|
|
4s1 |
4s1 |
|
|
3d5 |
|
|
||||
Ca |
Mn |
|
|
|
Задачи
41.Какие четыре квантовых числа определяют состояние электрона в атоме.
Какие значения может принимать каждое из них  *Составьте электронную формулу элементов с порядковыми номерами 12 и 21.
*Составьте электронную формулу элементов с порядковыми номерами 12 и 21.
Определите, к какому типу (s- , p- , d- и f-) относятся эти элементы и их положение в Периодической системе (период, подгруппа).
42.Какие квантовые числа определяют энергию электрона в атоме  В чем сущность принципа минимума энергии
В чем сущность принципа минимума энергии  Укажите последовательность заполнения уровней и подуровней.
Укажите последовательность заполнения уровней и подуровней.
* 13 и 22.
43.Какое квантовое число определяет форму атомных орбиталей  Изобразите форму s-, p- и d- орбиталей.
Изобразите форму s-, p- и d- орбиталей.
* 16 и 24.
44.Какое квантовое число определяет количество орбиталей в данном
подуровне атома Чему равно число орбиталей на s- , p- , d- и f- подуровнях * 11 и 25.
* 11 и 25.
45. Какие значения может принимать магнитное квантовое число m при l = 0; 1; 3

* 18 и 24 .
46.Чему равно число орбиталей на p – подуровнях данного энергетического уровня Изобразите форму p – орбиталей и расположение их в пространстве. *30 и 36.
47.Какие электроны в атоме называются s- , p- , d- и f- электронами Изобразите форму атомных орбиталей s- , p- , d- атомных орбиталей.
Изобразите форму атомных орбиталей s- , p- , d- атомных орбиталей.
*31 и 42.
48.В чем сущность правила Гунда Разместите три электрона по энергетическим ячейкам d – подуровня.
* 20 и 40.
49.Что такое электронное облако Что характеризует вероятность нахождения электрона в данной точке пространства и в элементарном объеме
Что характеризует вероятность нахождения электрона в данной точке пространства и в элементарном объеме Что такое орбиталь
Что такое орбиталь
* 54 и 56.
50.В чем сущность принципа Паули Какое максимальное число электронов на
s- , p- , d- и f- подуровнях 
* 23 и 52.
*См. условие задачи 41.
V.Зависимость свойств элементов от положения
впериодической системе Д.И.Менделеева
Смысл периодического закона состоит в следующем:
возрастание положительного заряда ядер элементов приводит к периодическому повторению строения внешних электронных оболочек атомов, а следовательно, к периодическому повторению химических свойств элементов.
Деление элементов на периоды обусловленно числом энергетических уровней: в одном периоде объединены элементы, имеющие одинаковое число энергетических уровней (электронных слоев), равное номеру периода.
Деление на группы и подгруппы обусловленно порядком заполнения электронами уровней и подуровней:
элементы главных подгрупп состоят из S- или р-элементов (т.е. из элементов, у которых заполняются либо S-, либо р-подуровень);
элементы побочных подгрупп состоят из d- или f-элементов (т.е. из элементов,
укоторых заполняются либо d-, либо f-подуровень).
Номер группы, как правило, указывает максимальное число электронов,
которые могут участвовать в образовании химических связей.
Многие свойства элементов (радиус атома, электроотрицательность, степень окисления и др.) связаны со строением электронных оболочек и поэтому, вместе с последними, обладают периодичностью.
Впериоде при движении слева направо радиус атомов уменьшается, т.к. при одном и том же числе электронных слоев увеличивается заряд ядра и число электронов на внешнем уровне, а следовательно, увеличивается и сила притяжения электронов ядром, сжимающая атом.
Вгруппах при движении сверху вниз радиус атомов увеличивается, т.к. в этом направлении увеличивается число электронных слоев.
Способность атомов удерживать валентные электроны характеризуется энергией ионизации, сродством к электрону и электроотрицательностью.
Энергия ионизации J - это энергия, которую необходимо затратить для отрыва от атома наиболее слабо связанного с ним электрона.
Впериодах энергия ионизации увеличивается слева направо, а в подгруппах (в первую очередь главных)-снизу вверх.
Сродство к электрону Е - это энергия, которая выделяется при присоединении к атому одного электрона.
Сродство к электрону изменяется по периодической таблице, в целом, аналогично изменению энергии ионизации.
Энергия ионизации и сродство к электрону характеризуют металлические (способность отдавать электроны) и неметаллические (способность принимать электроны) свойства элементов.
Более полной и общей характеристикой этих свойств является электроотрицательность элемента (Х).
Х=J+E
Чем меньше электроотрицательность элемента, тем сильнее выражены его металлические свойства и слабее неметаллические.
Примеры решения задач
Пример 1. Какую высшую и низшую степень окисления проявляют мышьяк, селен и бром? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Решение Высшую степень окисления элемента определяет номер группы
периодической системы, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того количества электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2np6). Данные элементы находятся соответственно в Va, VIa, VIIa группах и имеют структуру внешнего энергетического уровня s2p3, s2p4, s2p5. Низшие степени окисления -3,

-2, -1. Примеры H3As-3, Na2Se-2, KBr-1. Высшие степени окисления элементов +5, +6, +7. Примеры соединений H3As+5O4, Se+6O3, KBr+7O4.
Пример 2. Какой из элементов четвертого периода седьмой группымарганец или бром – проявляет металлические, а какой -неметаллические свойства? Решение
Электронные формулы элементов
25Mn 1s22s22p63s23p63d54s2 35Br 1s22s22p63s23p63d104s24p5
Марганец -d-элемент VIIб группы, бром -р-элемент VIIa группы. На внешнем уровне марганца два электрона. Атомы элементов с небольшим (1-2) числом электронов на внешнем уровне обычно имеют низкие значения электроотрицательности, поэтому способны лишь к потере электронов, т.е. проявляют металлические свойства. У бора на внешнем уровне 7 электронов, до образования устойчивой восьмиэлектронной оболочки не хватает всего одного электрона, значение электроотрицательности высокое, поэтому более характерным является присоединение электронов, т.е. неметаллические свойства.
Для всех групп, содержащих p- и d-элементы, преобладание металлических свойств у d-элементов является общей закономерностью.
Задачи
51.Что такое энергия ионизации атома Что она характеризует
Что она характеризует Как она изменяется в периодах и в подгруппах с увеличением порядкого номера
Как она изменяется в периодах и в подгруппах с увеличением порядкого номера
52.Как и почему изменяется энергия ионизации атома в главных и побочных
подгруппах
53.Как изменяются радиусы атомов и положительных ионов в периодах и
подгруппах с увеличением порядкового номера Что такое лантаноидное сжатие
Что такое лантаноидное сжатие
54.Что такое сродство к электрону Как изменяется окислительная способность неметаллов в периодах и группах с увеличением порядкого
Как изменяется окислительная способность неметаллов в периодах и группах с увеличением порядкого
номера 55. Что такое электроотрицательность
55. Что такое электроотрицательность Что она характеризует Как изменяется
Что она характеризует Как изменяется
электроотрицательность p- элементов в периодах и группах с увеличением порядкового номера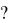
56.Как изменяются свойства гидроксидов элементов в периодах и группах с увеличением порядкого номера Почему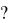
57.С учетом положения элементов в периодической системе ответьте на вопрос: какой из двух гидроксидов является более сильным основанием:
Mg(OH)2 или Ba(OH)2 ; Ca(OH)2 или Fe(OH)2 ?
58.Составьте формулы оксидов и гидрооксидов элементов IIIА подгруппы. Как изменяются свойства этих соединений при переходе от Al к Tl 
59.Составьте формулу оксидов и гидрооксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления. Как
изменяются их свойства при переходе от натрия к сере 60. Какова современная формулировка периодического закона
60. Какова современная формулировка периодического закона В чем причина
В чем причина
периодической зависимости свойств элементов и образуемых ими соединений от заряда ядра атомов
VI. Химическая связь
Образование химической связи между атомами происходит за счет электронов, расположенных на внешнем и предвнешнем (для d- и f-элементов) энергетических уровнях и связанных с ядром наименее прочно. Их называют валентными электронами.
В зависимости от характера распределения электронной плотности в молекуле различают три основных типа химической связи: ковалентную, ионную и металлическую.
Связь, осуществляемая за счет электронных пар, в одинаковой мере принадлежащих обоим атомам, называется ковалентной.
Существует два механизма образования ковалентной связи: обменный - за счет неспаренных электронов, находящихся в невозбужденном или возбужденном состоянии, и донорно-акцеторный.
Число связей за счет неспаренных электронов, которые может образовывать атом данного элемента с другими атомами, равно числу этих электронов в основном или возбужденном состоянии. Например, атом углерода в основном состоянии имеет 2 неспаренных электрона и может образовать 2 химические связи, например, с двумя неспаренными электронами атома
кислорода (получается молекула С=О): |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
2р2 |
|
|
|
|
|
2р4 |
|
|||
|
|
|
|
|
2s2 |
|
|
|
|
|
|
2s2 |
|
|
|
|
||
|
C |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
В возбужденном состоянии атом углерода имеет на внешнем уровне четыре |
||||||||||||||||||
неспаренных электрона и может образовать 4 химические связи, |
|
|||||||||||||||||
|
2s2 |
|
|
2р2 |
E |
|
2s2 |
|
2р3 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
C |
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ |
|
|
|
|
|
|||||||||||||
например, с |
четырьмя неспаренными |
электронами |
двух атомов |
кислорода |
||||||||||||||
(получается молекула О=С=О). |
|
|
|
|
|
|
|
|
|
|||||||||
Число |
|
|
образуемых |
атомом |
|
ковалентных |
|
связей |
называется |
|||||||||
ковалентностью элемента в соответствующем соединении. |
|
|||||||||||||||||

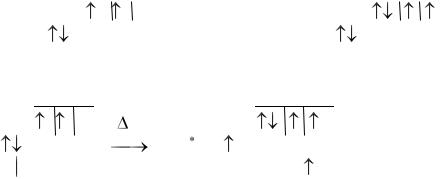
Донорно-акцепторный механизм образования ковалентной связи заключается в том, что один из атомов, участвующих в образовании химической связи, предоставляет неподеленную электронную пару (его называют донором), а второй (акцептор)-свободную орбиталь. Примером может служить образование иона аммония NH4+ из молекулы аммиака NH3 и иона водорода Н+:
Н |
|
Н + |
. . |
|
. . |
Н : N : + |
H+ |
Н:N:Н |
. . |
|
. . |
Н |
|
Н |
NH3 – донор, |
Н+- акцептор |
|
Все связи N-H в ионе аммония равноценны.
Донорно-акцепторный механизм образования ковалентной связи особенно распространен в комплексных соединениях.
Для обоих механизмов образования ковалентной связи справедливо следующее: атом не может образовать ковалентных связей больше, чем число валентных орбиталей.
Ковалентная связь характеризуется длиной (это расстояние между ядрами атомов, образовавших связь), прочностью (она определяется энергией связи - это энергия, которую необходимо затратить для разрыва всех связей в молекулах, составляющих 1 моль вещества), направленностью (все орбитали, кроме S, имеют пространственную направленность, поэтому и связи, образованные за счет перекрывания таких орбиталей, обладают определенной направленностью), полярностью (если общая электронная пара расположена симметрично между ядрами атомов, то связь неполярная - это молекулы, состоящие из атомов одного элемента, если общая электронная пара смещена в сторону более электроотрицательного атома, то связь полярная - это молекулы, образованные атомами разных элементов).
Различают - и -ковалентные связи. 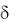 связь – это связь, при образовании которой перекрывание электронных облаков происходит вдоль прямой, соединяющей центры атомов.
связь – это связь, при образовании которой перекрывание электронных облаков происходит вдоль прямой, соединяющей центры атомов. 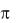 связь
связь 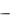 это связь, при образовании которой перекрывание электронных облаков происходит вдоль линии, перпендикулярной прямой, соединяющей центры атомов.
это связь, при образовании которой перекрывание электронных облаков происходит вдоль линии, перпендикулярной прямой, соединяющей центры атомов.
Ковалентная связь, образованная одной парой электронов, называется одинарной (простой), двумя - двойной, тремя - тройной. Двойную и тройную связи называют кратными.
Ионной называется химическая связь, осуществляемая за счет сил электростатического притяжения противоположно заряженных ионов. К возникновению ионов приводит большая разница электроотрицательностей (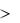 1,7) атомов, образующих связь. Поэтому ионная связь возникает между
1,7) атомов, образующих связь. Поэтому ионная связь возникает между
