
4 курс / Общая токсикология (доп.) / Врожденные пороки сердца
.pdf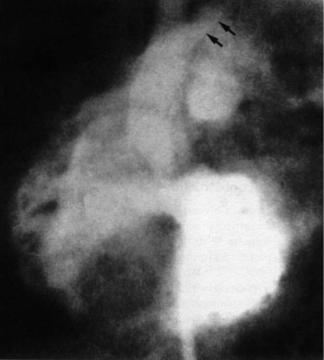
362 |
Часть 5. ПОРОКИ РАЗВИТИЯ АОРТЫ И ЕЕ ПРОКСИМАЛЬНЫХ ВЕТВЕЙ |
|
|
|
|
Как и при других пороках с дуктусзависимым системным кровотоком, дети поступают в состоя нии сердечно сосудистого шока или сердечной недостаточности после спонтанного закрытия ар териального протока в первые дни жизни. Прежде всего проводят энергичные мероприятия для ста билизации состояния: восстанавливают объём циркулирующей крови, начинают инфузию ПГЕ1 и, если необходимо, стабилизируют гемодинами ку инотропной поддержкой.
Характерным клиническим признаком являет ся различие пульса на обеих руках, зависящее от типа перерыва, которое можно определить после восстановления удовлетворительного сердечного выброса. Отсутствие пульса на всех конечностях указывает на возможность перерыва типа В с ано мальной подключичной артерией, т.е. когда обе сонные артерии отходят проксимальнее, а обе подключичные артерии — дистальнее перерыва. Сильная каротидная пульсация позволяет диффе ренцировать перерыв дуги от критического аор тального стеноза, при котором пульс ослаблен. Дифференциальный цианоз (розовая верхняя по ловина туловища и голубая — нижняя) теорети чески возможен, однако наблюдается нечасто, поскольку кровь в легочной артерии и, следова тельно, в артериальном протоке хорошо насыщена кислородом из за большого лево правого сброса через ДМЖП.
На рентгенограмме — кардиомегалия, усилен ный легочной рисунок, легочно венозный застой или отек. Верхнее средостение может быть сужен ным из за отсутствия вилочковой железы, как обычно бывает при Di George синдроме. На ЭКГ
— гипертрофия правого желудочка.
Двухмерная ЭхоКГ является наиболее важным методом диагностики перерыва дуги. Из подре берного переднего доступа порок может быть за подозрен по выраженному несоответствию разме ров восходящей аорты и легочного ствола (36) при наличии типичного несоосного ДМЖП вслед ствие отклонения кзади конусной перегородки. Последняя лучше видна по парастернальной длинной оси. Исследование дуги из надключич ного или высокого парастернального доступа поз воляет определить характер отхождения брахиоце фальных сосудов и проходимость. В отличие от нормального направления дуги аорты кзади, при перерыве дуги, особенно при типе В, курс сонных артерий направлен кверху.
Во многих центрах для подтверждения диагно за еще используется ангиокардиография (рис. 3), однако ток крови через ДМЖП затрудняет полу чение высококачественного изображения восхо
ПБА ЛСА
Ао
ИП ВИС
РЖ Д
ЛЖ
Рис. 3. Перерыв дуги аорты (показан стрелками) с ДМЖП
(Д) и субаортальным сужением, образовавшимся в резуль" тате смещения инфундибулярной перегороки (ИП) кзади. Видна персистирующая левая вентрикулоинфундибулярная складка (ВИС) — переднелатеральная мышца Moulaert (Ао – аорта, ЛЖ – левый желудочек, ПЖ – правый желудо" чек, ПБА – правая безымянная артерия, ЛСА – левая общая сонная артерия)
дящей аорты, чтобы отличить перерыв от тяжелой гипоплазии дуги. Перерыв может быть безоши бочно диагностирован при ангиографии, когда обе каротидные артерии отходят проксимально, а обе подключичные артерии — дистально по отно шению к месту перерыва и боталлову протоку. Большое расстояние между сонными артериями и нисходящей аортой однозначно указывает на пе рерыв.
Трехмерное изображение на МРТ может проде монстрировать характер отхождения сонных арте рий и отсутствие связи между проксимальной и дистальной аортой. Однако этот метод не позволя ет отличить перерыв от тяжелой гипоплазии дуги.
ЕСТЕСТВЕННОЕ ТЕЧЕНИЕ
Естественное течение порока неблагоприят ное. В течение первой недели жизни умирают 42,1% младенцев, к 6 мес выживаемость снижает ся до 26,3% и сохраняется на этом уровне до 15 летнего возраста.
Глава 26. ПЕРЕРЫВ ДУГИ АОРТЫ |
363 |
|
|
|
|
ДОХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
В первые несколько дней внутривенно вводят ПГЕ1, интубируют, проводят искусственную вен тиляцию легких с кислородом. Корригируют кон центрацию сывороточного кальция. Следует избе гать гипервентиляции и дыхательного алкалоза для профилактики судорожной готовности. Боль ным с Di George синдромом нельзя переливать цитратную кровь, так как она потребляет сыворо точный кальций.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Целью хирургической коррекции порока явля ется создание непрерывности аорты с восстанов лением физиологического кровотока в области ее дуги, устранение субаортального стеноза, а также разобщение большого и малого кругов кровообра щения. Хирургическая коррекция может быть как одно , так и двухэтапной.
Двухэтапный метод хирургической коррекции
Двухэтапный метод хирургической коррекции заключается в восстановлении целостности аорты за счет собственных тканей или путем импланта ции сосудистого протеза с одновременной пере вязкой ОАП и суживанием легочной артерии. Во время второго этапа коррекции порока закрывают ДМЖП и производят дебандаж легочной артерии (37). Подобная двухэтапная коррекция требует двух торакотомий: на первом этапе выполняют ле востороннюю торакотомию, на втором — стерно томию. У больных с атрезией дуги аорты типа А для восстановления целостности аорты использу ют левую подключичную артерию, которую соеди няют «конец в конец» или «конец в бок» с верхним отделом нисходящей аорты (анастомоз Blalock–Park) (38). Иногда имеется возможность непосредственного анастомоза участков аорты между собой. При атрезии дуги аорты типа В су ществует два варианта оперативного вмешатель ства с использованием собственных сосудов для реконструкции аорты: левую сонную артерию анастомозируют с дистальным отделом аорты ли бо левую подключичную артерию анастомозируют с проксимальным отделом аорты (обратный анас томоз Blalock–Park). Описаны также методики с использованием обеих вышеуказанных артерий (39). Иногда при типе В возникает необходимость протезирования аорты, особенно когда левая сон ная и подключичная артерии сужены. Необходи
мо учитывать, что при использовании искусствен ного протеза в последующем неизбежно повтор ное вмешательство.
Хирургическая тактика зависит от степени су баортального сужения. Диаметр подаортального отверстия 5–6 мм и более позволяет выполнить первичную внутрисердечную коррекцию, т.е. зак рытие ДМЖП заплатой в сочетании с реконструк цией дуги аорты. Диаметр выводного тракта менее 3 мм недостаточен для обеспечения нормального сердечного выброса у доношенных детей. При нормальной ориентации магистральных артерий субаортальное сужение следует обойти. Предпоч тительным методом является соединение прокси мального конца пересеченного легочного ствола с восходящей аортой с помощью гомографта, поз воляющее одновременно реконструировать аорту, как при синдроме гипоплазии левых отделов серд ца (операция Norwwood) (40). Легочный кровоток обеспечивают из аорты с помощью сосудистого протеза из Gore Tex, если ДМЖП остается откры тым, или путем имплантации кондуита между пра вым желудочком и бифуркацией легочной арте рии, если желудочки разделены заплатой, направ ляющей ток крови из левого желудочка в легочную артерию через ДМЖП. Когда перерыв дуги аорты сочетается с ТМА, выполняют операцию артери ального переключения в комбинации с трансану лярной заплатой в неолегочном выводном тракте.
Дугу аорты почти всегда можно реконструиро вать путем препаровки тканей вокруг двух компо нентов дуги и выполнения прямого анастомоза концов аорты (41), при необходимости используя гомографт для адекватного расширения аорты. Применение трубчатого гомографта для создания проксимальной и дистальной аорты следует по возможности избегать во время первичной опера ции в младенческом возрасте, так как при быстром росте ребенка и образовании фиброзного футляра вокруг нативной аорты усложняется анастомоз "конец в конец" при последующей операции.
Суживание легочной артерии является не луч шим методом паллиативного этапа лечения ДМЖП с перерывом дуги аорты вследствие развития гипе ртрофии обоих желудочков с прогрессированием субаортального стеноза, осложняющего оконча тельную отсроченную коррекцию любым методом.
Первичная полная коррекция при сопутствующем ДМЖП
Хирургическое лечение перерыва дуги аорты претерпело эволюцию от этапного до одномомент ного. В Бостонской клинике предпочитают одно
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
364 |
Часть 5. ПОРОКИ РАЗВИТИЯ АОРТЫ И ЕЕ ПРОКСИМАЛЬНЫХ ВЕТВЕЙ |
|
|
|
|
этапную коррекцию в неонатальном периоде с ис пользованием прямого анастомозирования нисхо дящей аорты с дугой или восходящей аортой (42).
На предоперационном этапе соблюдают прин ципы ведения, принятые для больных с дуктусза висимым системным кровотоком — дыхание ком натным воздухом без гипервентиляции. Кроме обычного мониторирования особое внимание уде ляют измерению артериального давления выше и ниже будущего анастомоза, например, в лучевой и пупочной артериях. Это позволяет не только оце нить градиент давления на анастомозе, но и адек ватность перфузии верхнего и нижнего артериаль ных бассейнов во время фазы охлаждения при ис кусственном кровообращении.
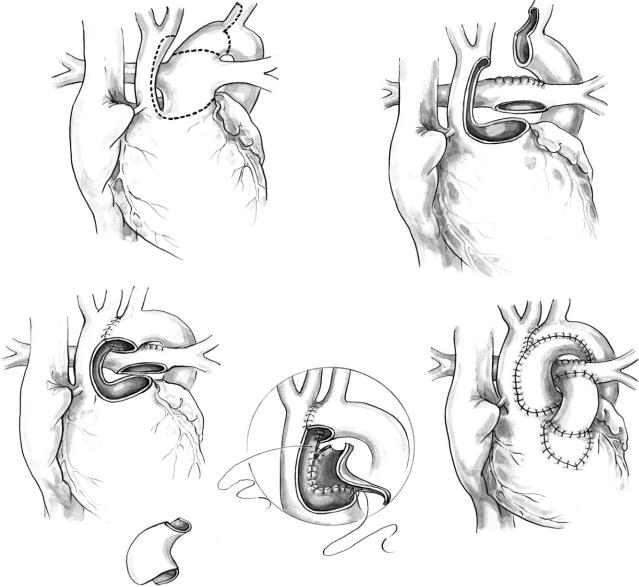
Операцию выполняют через срединную стер нотомию в условиях искусственного кровообра щения и короткого периода остановки кровообра щения. После стернотомии удаляют вилочковую железу и открывают полость перикарда. Тщатель но выделяют сосуды дуги, ветви легочной артерии, артериальный проток и проксимальную часть нисходящей аорты. Идентифицируют и оберегают от повреждения возвратный глоточный нерв.
Принципиальное значение имеет канюляция артериальной системы (рис. 4). Для равномерного охлаждения больного канюлируют восходящую аорту и легочный ствол или проток (рис. 4, б). Место канюляции — по правой стороне восходя щей аорты чуть ниже основания безымянной арте рии. Конец канюли должен быть введен в просвет аорты не глубже чем на 1,5–2 мм, чтобы обеспе чить антеградную перфузию мозга и ретроградный кровоток в коронарные артерии. Если сосуды дуги достаточно широкие, альтернативным местом ка нюляции является одна из сонных артерий. Это позволит обеспечить антеградный мозговой кро воток во время выполнения аортального анасто моза и избежать остановки кровообращения, но может стать причиной избыточной перфузии моз га и стенозирования места канюляции. Поскольку аортальный анастомоз несложен и может быть вы полнен быстро, остановка кровообращения сопровождается минимальным риском и значи тельно облегчает эту часть операции.
Канюли в аорте и легочном стволе соединяют с помощью V образного коннектора. Венозный дренаж осуществляют через одну или две канюли в правом предсердии или полых венах. Сразу после начала искусственного кровообращения турнике тами обжимают обе ветви легочной артерии для предотвращения утечки артериальной крови в ле гочные сосуды. В нисходящую аорту кровь из ап парата поступает через ОАП. Во время фазы ох
лаждения следует проводить инфузию ПГЕ1. Про должают выделение восходящей аорты и её ветвей, артериального протока и нисходящей аорты для уменьшения натяжения анастомоза и снижения риска кровотечения из линии шва. С этой же целью пересекают аберрантную правую подклю чичную артерию, отходящую от нисходящей аор ты, если она есть, а также левую подключичную артерию при типе В перерыва дуги.
При температуре 18–20 0С в прямой кишке кро вообращение останавливают. Затягивают турни кеты на сосудах дуги и ослабляют на легочных ар териях. Вводят кардиоплегический раствор через аортальную канюлю. После этого обе аортальные
ивенозную канюли удаляют, если предполагается выполнять аортальный анастомоз при останов ленном кровообращении. Наш опыт показывает, что с разных точек зрения это лучше делать в усло виях перфузии мозга. С помощью проводника аортальную канюлю проводят в один из плечего ловных сосудов, обжимают турникетом и начина ют перфузию мозга с низкой объёмной скоростью.
Артериальный проток лигируют и пересекают в месте его соединения с нисходящей аортой (рис. 4, в). Иссекают остатки ткани протока. Нисходящую аорту пережимают С образным зажимом и подтя гивают к месту будущего анастомоза. Анастомоз выполняют на восходящей аорте, в месте, где она наиболее подвижна, благодаря чему уменьшается степень натяжения шва (рис. 4, г). Верхний край разреза обычно простирается до основания сосу дов дуги. Анастомоз должен находиться точно напротив места канюляции аорты, его накладыва ют 6/0–7/0 проленом. При наличии сужения вос ходящей аорты место анастомозирования может быть расширено лоскутом перикарда или стенкой гомографта.
Перед реперфузией освобождают тесемки с плечеголовных сосудов, аортальную канюлю под тягивают, чтобы её конец находился в просвете аорты. Удаляют воздух из восходящей аорты, дуги
инисходящей аорты. Пережимают восходящую аорту проксимальнее канюли и снимают зажим с нисходящей аорты. Не вводя очередную дозу кар диоплегического раствора, открывают правое предсердие или легочный ствол или правый желу дочек поперечным разрезом (рис. 4, д) в зависи мости от локализации дефекта и закрывают его ушиванием или с помощью заплаты из аутопери карда. Локализация дефекта должна быть установ лена по ЭхоКГ до операции. Заплату фиксируют отдельными матрацными швами с прокладками таким образом, чтобы ее верхний край распола гался на левой стороне инфундибулярной перего

Глава 26. ПЕРЕРЫВ ДУГИ АОРТЫ |
365 |
|
|
|
|
б
а
г
д
е
Рис. 4. Коррекция простого перерыва дуги аорты типа В с ДМЖП
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

366 |
Часть 5. ПОРОКИ РАЗВИТИЯ АОРТЫ И ЕЕ ПРОКСИМАЛЬНЫХ ВЕТВЕЙ |
|
|
|
|
а
б |
в |
|
Рис. 5. Техника операции при атрезии дуги аорты в секторе А
родки для отклонения перегородки от выводного тракта левого желудочка. После закрытия дефекта канюлируют предсердие и возобновляют искус ственное кровообращение. При длительной оста новке кровообращения может быть применена промежуточная реперфузия в течение 5–10 мин с объёмной скоростью 100 мл/кг/мин. Если дефект закрывают доступом через легочный ствол, оста навливать кровообращение нет необходимости. Достаточно проводить перфузию со скоростью 50 мл/кг/мин.
У многих пациентов с перерывом дуги аорты растяжимость левого желудочка снижена, что спо собствует увеличению сброса крови на предсерд ном уровне, поэтому овальное окно следует зак рыть в период гипотермической остановки крово обращения.
После закрытия дефектов эвакуируют воздух из левых отделов сердца, снимают зажим с аорты, на чинают согревание и ушивают разрезы легочного ствола или правого предсердия (рис. 4, е). В левом предсердии оставляют катетер для послеопераци онного мониторирования. Пациента согревают до 36 0С и отлучают от аппарата обычно с минималь ной инотропной поддержкой.
Хирургическая летальность при первичной операции составляет около 10%.
При атрезии (не перерыве) дуги аорты в секто ре А облитерированный участок перешейка аорты завязывают и пересекают (рис. 5, а). В условиях перфузии головного мозга иссекают артериаль ный проток и нисходящую аорту анастомозируют с вогнутой частью дуги (рис. 5, б, в).
Коррекция перерыва дуги аорты, сочетающегося с ОАС
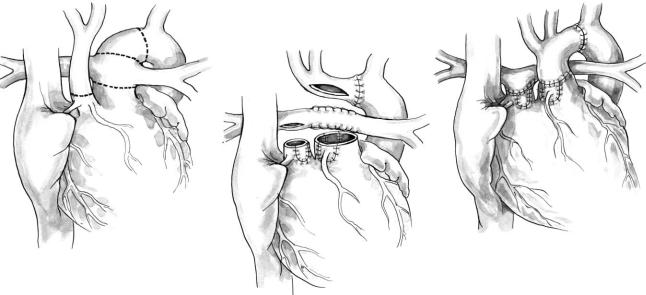
После ДМЖП общий артериальный ствол яв ляется наиболее частым сопутствующим пороком при перерыве дуги аорты. Полная коррекция пре дусматривает одновременное устранение обоих пороков. Канюляция аорты упрощается использо ванием одной артериальной канюли, которую вводят в дистальную часть восходящей аорты или в легочный ствол, являющийся компонентом ОАС. При включении аппарата искусственного кровообращения пережимают турникетами ветви легочной артерии. По достижении температуры 18 0С сосуды мозга пережимают и останавливают кровообращение. Артериальный проток перевя зывают и пересекают. Легочный компонент об щего ствола отсекают от корня ствола (рис. 6, а, б).
Восходящую аорту рассекают вертикально, включая начальные 5 мм левой обшей сонной ар терии. Все ткани артериального протока удаляют из нисходящей аорты, оставляя левую подключич ную артерию. В ее основании делают надрез дли ной приблизительно 5 мм (рис. 6, б). При условии хорошей мобилизации левой общей сонной, левой подключичной артерии и проксимальной части нисходящей аорты разрезы обеих артерий сшива ют 7/0 проленом. В разрез аорты и основания об щего ствола вшивают клиновидную вставку из го молегочной артерии или аорты аналогично тому, как это делают при выполнении операции Norwood I у пациентов с синдромом гипоплазии левых отделов сердца (рис. 6, в). На этом этапе во зобновляют искусственное кровообращение и па
Глава 26. ПЕРЕРЫВ ДУГИ АОРТЫ |
367 |
|
|
|
|
а |
|
б |
г
в
Рис. 6. Коррекция перерыва дуги аорты, сочетающегося с ОАС
циента согревают. Через вертикальный разрез правого желудочка, начатый непосредственно под клапаном ствола, закрывают заплатой ДМЖП. Правый желудочек соединяют с бифуркацией ле гочной артерии с помощью клапанного легочного или аортального гомографта (рис. 6, г).
Коррекция перерыва дуги аорты, сочетающегося с транспозицией магистральных артерий
Когда перерыв дуги аорты сочетается с ТМА или аномалией Taussig–Bing, реконструкцию дуги комбинируют с процедурой артериального пере ключения. В связи со значительной несоразмер ностью магистральных артерий у этих пациентов (рис. 7, а) аорту пересекают непосредственно над
синусами Вальсавы и разворачивают влево и кза ди, чтобы анастомозировать «конец в конец» с нисходящей аортой (рис. 7, б). Производят про дольный разрез по нижнему краю этой неоаор тальной дуги. Широкую проксимальную неоаорту с имплантированными коронарными пуговицами анастомозируют с разрезом неоаортальной дуги «конец в бок». После возобновления искусствен ного кровообращения закрывают ДМЖП через правую вентрикулотомию, ДМПП ушивают через короткий разрез правого предсердия. Прокси мальную неолегочную артерию анастомозируют с легочной бифуркацией или с правой легочной ар терией с использованием маневра Lecompte при переднезаднем расположении магистральных ар терий или без него при ориентации крупных сосу дов «бок о бок» (рис. 7, в).
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
368 |
Часть 5. ПОРОКИ РАЗВИТИЯ АОРТЫ И ЕЕ ПРОКСИМАЛЬНЫХ ВЕТВЕЙ |
|
|
|
|
|
|
|
|
|
|
в |
|
|
а |
|
|||||
|
|
|
б |
||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Рис. 7. Коррекция перерыва дуги, сочетающегося с ТМА |
|
|
|
|
|
||
|
|
|
|
|
|||
РЕЗУЛЬТАТЫ |
регородки, малые размеры дефекта и субаорталь |
||||||
ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ |
ное сужение. Факторами риска, связанными с тех |
||||||
|
|
|
нической стороной вмешательства, были: |
||||
В связи с высокой естественной смертностью и |
• коррекция без сопутствующих процедур у паци |
||||||
редкой встречаемостью перерыва дуги аорты в ли |
ентов с наличием других сужений между левым |
||||||
тературе представлены результаты хирургического |
желудочком и аортой; |
||||||
лечения в малых сериях. Согласно опубликованно |
• анастомоз Damus–Kaye–Stansel; |
||||||
му в 1988 г. исследованию (43), в котором предс |
• миотомия или миэктомия при субаортальном |
||||||
тавлен опыт лечения 63 больных, 30 дневная, 1 , 5 |
стенозе. |
||||||
и 10 летняя выживаемость составила 61, 52, 48 и |
Эти данные были получены 15 лет назад. Веро |
||||||
47% соответственно. Результаты улучшились с на |
ятно, что некоторые технические погрешности к |
||||||
коплением опыта, и к 1986 г. вероятность смерти |
настоящему времени устранены. |
||||||
после операции, выполненной детям до 2 недель |
В другой сводной статистике, охватывающей |
||||||
ного возраста, составила всего 6%. Из 33 больных, |
300 наблюдений, представлена удельная частота |
||||||
у которых перерыв дуги сочетался с ДМЖП, |
различных сочетаний пороков с перерывом дуги |
||||||
обструкция выводного тракта левого желудочка |
(44, 45). У 208 (69,4%) пациентов был простой пе |
||||||
выявлена у 8 пациентов, 7 из которых были под |
рерыв — сочетание с ДМЖП и артериальным про |
||||||
вергнуты повторным операциям. Отсутствие этого |
током, у 92 (30,6%) — сложный перерыв: ОАС — у |
||||||
осложнения к 1 мес, 1 году и 3 годам составило 97, |
36 больных, атрезия трехстворчатого клапана — у |
||||||
78 и 58% соответственно. Рецидив или сохранение |
8, транспозиция — у 8, атрезия митрального кла |
||||||
обструкции дуги были обнаружены у 15 больных и |
пана — у 6, другие формы единственного желудоч |
||||||
отмечались более часто у пациентов, которым был |
ка — у 6, аортолегочное окно — у 6 и отхождение |
||||||
выполнен прямой анастомоз, чем у тех, которым |
обеих магистральных артерий от правого желудоч |
||||||
был имплантирован трубчатый протез. |
ка — у 5 больных. У оставшихся 17 пациентов име |
||||||
Согласно многоцентровым исследованиям, |
ли место сложные сочетания различных пороков. |
||||||
представленным в 1994 г. (42), из 183 новорожден |
Перерыв дуги типа А наблюдался у 37% больных, |
||||||
ных с перерывом дуги аорты и ДМЖП 9 умерли |
типа В — у 62% и типа С у 1%. Аберрантная правая |
||||||
перед хирургическим вмешательством. Выживае |
подключичная артерия была обнаружена у 8% па |
||||||
мость среди 172 оставшихся была 73, 65, 63 и 63%, |
циентов при типе А и у 20% — при типе В. Пере |
||||||
соответственно к 1 мес, 1, 3 и 4 годам после коррек |
рыв правосторонней дуги аорты имел место у 2,7% |
||||||
ции. Факторами риска смерти оказались малая |
пациентов. |
||||||
масса при рождении, более ранний возраст на мо |
Общая хирургическая летальность составила |
||||||
мент операции, тип В перерыва, расположение де |
35%. В группе больных с простой транспозицией, у |
||||||
фекта в тракте оттока и в трабекулярной части пе |
которых была выполнена первичная коррекция |
||||||
Глава 26. ПЕРЕРЫВ ДУГИ АОРТЫ |
369 |
|
|
|
|
или проведено этапное лечение (суживание легоч ной артерии с последующим удалением тесьмы и закрытием ДМЖП) летальность составила 30%. Среди пациентов, у которых перерыв дуги сочетал ся со сложными пороками, летальность составила в среднем 46%, в частности при общем артериаль ном стволе она достигала 67%. Аналогичные ре зультаты получены и в других центрах. Так, в Детс ком госпитале Торонто средняя выживаемость в возрасте 1 мес составила 50%, к 1 и 5 годам жизни
— 34%. После 1993 г. 5 летняя выживаемость пос ле одноэтапной коррекции неосложненного пере рыва дуги достигла 93%, а отсутствие необходи мости в повторных операциях составило 69% (46).
На протяжении многих лет летальность не уменьшилась. Среди пациентов с простым пере рывом были применены два протокола: первичная коррекция с летальностью 37% и двухэтапное ле чение с летальностью 46%.
Результаты лечения перерыва дуги аорты улуч шились после внедрения простогландина для ста билизации состояния детей перед операцией (47, 48). Существенную роль в уменьшении безопас ности лечения этих крайне тяжелых детей сыграла эволюция диагностических методов от инвазив ных до неинвазивных.
ЗАКЛЮЧЕНИЕ
Коррекция перерыва дуги аорты и сопутствую щих аномалий до настоящего времени остается трудной проблемой. Большинство пациентов на ходятся в тяжелом состоянии, с выраженной сер дечной недостаточностью, осложненной анурией или олигурией у каждого третьего пациента. В этих случаях требуется неотложная операция в раннем неонатальном периоде.
Особую проблему составляет стеноз выводного тракта левого желудочка. Различные формы суба ортального стеноза встречаются в половине случаев (49). До настоящего времени нет единого мнения по вопросам о том, влияет ли обструкция выводно
го тракта левого желудочка на исходы коррекции перерыва дуги аорты и есть ли необходимость уст ранять сужение во время первичной коррекции, а также какой метод операции предпочтителен. Не которые хирурги во время первой операции не предпринимали попыток устранить субаортальную обструкцию вне зависимости от выраженности су жения (50) и получили результаты сравнимые, с таковыми при более агрессивной тактике. Другие считают, что включение в протокол вмешательства одновременного устранения субаортального стено за не увеличивает хирургический риск и поэтому оправдано.
Тяжелая обструкция не оставляет хирургу выбора.
Внекоторых центрах для создания свободного выхо да прибегают даже к операции Norwood (51). Имеют ся сообщения о небольшой группе пациентов, кото рые перенесли успешную бивентрикулярную кор рекцию после первичной операции Norwood, выпол ненной по поводу перерыва дуги аорты с выражен ным субаортальным стенозом (52). При тяжелой обструкции с гипоплазией левого желудочка прибе гают к этапному лечению, вначале выполняя опера цию Norwood, затем операцию Rastelli (53). Остается неясным, имеет ли преимущество этот тип вмеша тельства перед субаортальной резекцией.
Большая вероятность развития рецидива суже ния выхода из левого желудочка и реконструиро ванной дуги аорты требует постоянного наблюде ния за динамикой этого процесса. Возможно фор мирование недостаточности аортального клапана.
Внекоторых случаях развивается обструкция ды хательных путей (54–56).
Отклонение инфундибулярной перегородки кзади может стать причиной позднего субаорталь ного сужения и повторной операции.
Вотдаленном периоде высока частота реопера ций по поводу рекоарктации, сдавления бронхов, обструкции кондуита, субаортального стеноза, а также этапных вмешательств и других редких опера ций (57).
Литература
1.Fyler DC. Report of the New England Regional Infant Cardiac Program. Pediatrics 1980; 65(Suppl): 376–161.
2.Samanek M, Voriskova M. Congenital heart disease among 815,569 chil dren born between 1980 and 1990 and their 15 year survival: a prospec tive Bohemia survival study. Pediatr Cardiol 1999; 20(6): 411 17.
3.Van Praagh R, Bernhard WF, Rosenthal A, Parisi LF, Fyler DC. Interrupted aortic arch: surgical treatment. Am J Cardiol 1971; 27: 200 11.
4.Anderson RH, Macartney FJ, Shinebourne EA, Tynan M. Interruption of the aortic arch. In: Paediatric Cardiology. Edinburgh: Churchill Livingstone, 1981:1087–121.
5.Freedom RM, Smallhorn JF, Moes CAF. Interruption of aortic arch. In: Freedom RM, Benson LN, Smallhorn JF, eds. Neonatal Heart Disease. London: Springer Verlag, 1992: 390^103.
6.Rowe RD, Freedom RM, Mehrizi A. Interruption of the aortic arch. In: The Neonate with Congenital Heart Disease. New York: WB Saunders, 1981: 193 203.
7.Freedom RM, Culham JAG, Moes CAF. Interruption of the aortic arch. In: Angiocardiography of Congenital Heart Disease. New York: Macmillan Publishing, 1984:472–86.
8.Freedom RM, Mawson J, Yoo S J, Benson LN. Congenital Heart Disease: Textbook of Angiocardiography, Vols 1 & 2. Armonk, NY: Futura, 1997:1432.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
370 |
Часть 5. ПОРОКИ РАЗВИТИЯ АОРТЫ И ЕЕ ПРОКСИМАЛЬНЫХ ВЕТВЕЙ |
|
|
|
|
9.Moene RJ, Gittenberger De Groot AC, Oppenheimer Dekker A, Bartelings MM. Anatomic characteristics of ventricular septal defect associated with coarctation of the aorta. Am J Cardiol 1987; 59: 952 5.
10.Oppenheimer Dekker A, Gittenberger de Groot AC, Roozendaal H. The ductus arteriosus and associated cardiac anomalies in interruption of the aortic arch. Pediatr Cardiol 1982; 2:185–93.
11.Moerman P, Dumolin P, Lauweryns J, Van der Hauwaert L. Interrupted right aortic arch in Di George syndrome. Br Heart J 1987; 58: 274–8.
12.Marino B, Digilio MC, Persiani M et al. Deletion 22qll in patients with interrupted aortic arch. Am J Cardiol 1999; 84: 360–1.
13.Lewin MB, Lindsay EA, Jurecic V et al. A genetic etiology for interruption of the aortic arch type B. Am J Cardiol 1997; 80: 493–7.
14.Rauch R, Raucg A, Koch A et al. Cervical origin of the subclavian artery as a specific marker for monosomy 22qll. Am J Cardiol 2002; 89: 481 4.
15.Momma K, Ando M, Matsuoka R, Joo K. Interruption of the aortic arch associated with deletion of chromosome 22qll is associated with a subarterial and doubly committed ventricular septal defect in Japanese patients. Cardiology 1999; 9:463–7.
16.Van Mierop LHS, Kutsche LM. Cardiovascular anomalies in DiGeorge syndrome and importance of neural crest as a possible pathogenic fac tor. Am J Cardiol 1986; 58:133 7.
17.Celoria GC, Patton RB. Congenital absence of the aortic arch. Am Heart J 1959; 58:407 13.
18.Donofrio MT, Ramaciotti C, Weinberg PM, Murphy JD. Aortic atresia with interruption of the aortic arch and an aortopul monary fistulous tract: case report. Pediatr Cardiol 1995; 16: 147 9.
19.De Caro E, Pongiglione G, Ribaldone D. Interruption of the aortic arch, ventricular septal defect, aortic atresia and aortopulmonary fistulous communication. Int J Cardiol 1998; 65(1): 19 21.
20.Braunlin E, Peoples WM, Freedom RM et al. Interruption of the aortic arch with aorticopulmonary septal defect. Pediatr Cardiol 1982; 3: 329 35.
21.Bowers DE, Schiebler GL, Krovetz LJ. Interruption of the aortic arch with complete transposition of the great vessels. Am J Cardiol 1965; 16: 442 8.
22.Blackburn ME, Gibbs JL, Sethia B. Severe pulmonary stenosis and interruption of the aortic arch. Int J Cardiol 1992; 34: 106 8.
23.Matsushita T, Nakajima T, Kishimoto H. Interruption of aortic arch associated with pulmonary valve stenosis. Int J Cardiol 1995; 49: 86 8.24.
24.Mignosa C, Wilson DG, Wood A, Kirk CR, Musumeci F. Absent pul monary valve syndrome with interrupted aortic arch. Ann Thorac Surg 1998; 66: 244 6.
25.Korula RJ, Bais A, Lai N, Jairaj PS. Interrupted aortic arch with tetral ogy of Fallot. A report of an unsuccessful surgicaly treated case. J Cardiovasc Surg 1991; 32: 541 3.
26.Rudolph AM, Heymann MA, Spitznas U. Hemodynamic considerations in the development of narrowing of the aorta. Am J Cardiol 1972; 30: 514 25.
27.Shinebourne EA, Elseed AM. Relation between fetal flow patterns, coarctation of the aorta, and pulmonary blood flow. Br Heart J 1974; 36: 492 8.
28.Van Mierop LHS, Kutsche LM. Interruption of the aortic arch and coarc tation of the aorta: pathogenetic relations. Am J Cardiol 1984; 54: 829 34.
29.Freedom RM, Moes CAF, Pelech A et al. Bilateral ductus arteriosus (or Remnant): an analysis of 27 patients. Am J Cardiol 1984; 53: 884 91.
30.Ma JS, Choe G, Hwang TJ, Oh BS, Nam JH. Anomalous origin of the left anterior descending coronary artery from the pulmonary trunk associat ed with type B interrupted aortic arch. Pediatr Cardiol 1994; 15: 143 5.
31.Al Marsafawy HM, Yen Ho S, Redington AN, Anderson RH. The rela tionship of the outlet septum to the aortic outflow tract in hearts with interruption of the aortic arch. / Thorac Cardio vasc Surg 1995; 109:1225 36.
32.Al Marsafawy HM, Yen Ho S, Redington AN, Anderson RH. The rela tionship of the outlet septum to the aortic outflow tract in hearts with interruption of the aortic arch. / Thorac Cardio vasc Surg 1995; 109:1225 36.
33.Anderson RH, Penkoske PA, Zuberbuhler JR. Variable morphology of ventricular septal defect in double inlet left ventricle. Am J Cardiol 1985; 55:1560 5.
34.Pierpont MEM, Zollikofer CL, Moller JH, Edwards JE. Interruption of the aortic arch with right descending aorta: a rare condition and a cause of bronchial compression. Pediatr Cardiol 1982; 2:153 9.
35.Van Hare GF, Townsend SF, Hardy K, Turley K, Silverman NH. Interrupted aortic arch with a right descending aorta and right ductus arteriosus causing severe right bronchial compression. Pediatr Cardiol 1988; 9:171 4.
36.Smallhorn JF, Anderson RH, Macartney FJ. Cross sectional echocardio graphic recognition of interruption of aortic arch between left carotid and subclavian arteries. Br Heart J 1982; 48: 229 35.
37.Ventemiglia R., Oglietti J., Wukasch D. C. Interruption of the aortic arch, J. Thorac. Cardiovasc. Surg. 1976, 72,235.
38.Blalock A., Park E. A. The surgical tratment of experimental coarctation (atresia) of the aorta, Ann. Surg. 1944, 119,445.
39.Sirak H.D., Ressallat M., Hosier D. M. A new operation for repairing aortic arch atresia in infancy. Report of three cases, Circulation 1968, 37 (Suppl),2,43.
40.Rychik J, Murdison KA, Chin AJ, Norwood WI. Surgical management of severe aortic outflow obstruction in lesions other than the hypoplas tic left heart syndrome: use of a pulmonary artery to aorta anastomo sis. J Am Coll Cardiol 1991;18: 809 816.
41.Menahem S, Rahayoe AU, Brawn WJ, Mee RB. Interrupted aortic arch in infan cy: a 10 year experience. Pediatr Cardiol 1992; 13: 214 21.
42.Jonas R., Quaegebeur J., Kirklin J. Outcomes in patients with inter rupted aortic arch and ventricular septal defects. A multiinstitutional study. Congenital Heart Surgeons Society, J. Thorac. Cardiovasc. Surg. 1994, 107,1099.
43.Sell JE, Jonas RA, Mayer JE et al. The results of a surgical program for inter rupted aortic arch. J Thorac Cardiovasc Surg 1988; 96: 864 77.
44.Freedom RM, Benson LN, Smallhorn JF. Congenitally corrected trans position of the great arteries. In; Moller JH, Neal WA, eds. Fetal, Neonatal, and Infant Cardiac Disease. Norwalk, CT: Appleton & Lange, 1989: 555 70.
45.Powell CB, Stone FM, Atkins DL, Watson DG, Moller JH. Operative mor tality and frequency of coexistent anomalies in interruption of the aortic arch. Am J Cardiol 1997; 79(8): 1147 8.
46.Oosterhof T, Freedom RM, Van Arsdell GS, Williams WG, McCrindle BW. Outcomes of interrupted aortic arch in 119 patients. Presented at the Annual Meeting of the Association for European Paediatric Cardiology Strasbourg, France, June, 2000. Cardiol Young 2000; 10(Suppl 2): 37.
47.Zahka KG, Roland JMA, Cutilletta AF et al. Management of aortic arch interruption with prostaglandin El infusion and microporous expanded polytetrafluoroethylene grafts. Am J Cardiol 1980; 46:1001 5.
48.Benson LN, OUey PM, Patel RG, Coceani F, Rowe RD. Role of prostaglandin El infusion in the management of transposition of the great arteries. Am J Cardiol 1979; 44: 691 6.
49.Fulton JO, Mas C, Brizard CPR, Cochrane AD, Karl TR. Does left ventric ular outflow tract obstruction influence outcome of interrupted aortic arch repair? Ann Thorac Surg 1999; 67: 177 81.
50.Apfel HD, Levenbraun J, Quaegebeur JM, Allan LD. Usefulness of pre operative echocardiography in predicting left ventricular outflow obstruction after primary repair of interrupted aortic arch with ventric ular septal defect. Am J Cardiol 1998; 82: 470 3.
51.Jacobs ML, Rychik J, Murphy JD et al. Results of Norwood's opera tion for lesions other than hypoplastic left heart syndrome. J Thorac Cardiovasc Surg 1995; 110: 1555 61.
52.Erez E, Tam VK, Kanter KR, Fyfe DA. Successful biventricular repair after initial Norwood operation for interrupted aortic arch with severe left ventricular outflow tract obstruction. Ann Thorac Surg 2001; 71:1974 7.
53.Steger V, Heinemann MK, Irtel von Brenndorff C, Ziemer G. Combined Norwood and Rastelli procedure for repair of interrupted aortic arch with subaortic steno sis. Thorac Cardiovasc Surg 1998; 46:156 8.
54.Blatchford JW, Franciosi RA, Singh A, Edwards JE. Vascular ring in interruption of the aortic arch with bilateral ductus arteriosi. J Thorac Cardiovasc Surg 1987; 94: 596 9.
55.Tlaskal T, Hucin B, Kostelka M, Skovranek J. Successful reoperation for seve re left bronchus compression after repair of persistent truncus arterio sus with interrupted aortic arch. Eur J Cardiothorac Surg 1998; 13: 306 9.
56.Sakai T, Miki S, Ueda Y et al. Left main bronchus compression after aortic reconstruction for interruption of aortic arch. Eur J Cardiothorac Surg 1995; 9: 667 9.
57.Serraf A, Lacour Gayet F, Robotin M et al. Repair of interrupted aortic arch: a ten year experience. J Thorac Cardiovasc 1996; 112:1150 60.
Глава 27
АНОМАЛИИ КОРОНАРНЫХ АРТЕРИЙ,
ОТХОДЯЩИХ ОТ АОРТЫ
ЭМБРИОЛОГИЯ |
дить самостоятельным устьем от правого синуса. |
|
От левого коронарного синуса отдельным устьем |
У эмбрионов на ранней стадии развития стенки |
может отходить первая ветвь проникающей коро |
сердца образованы рыхло расположенными мы |
нарной артерии. |
шечными волокнами, которые кровоснабжаются |
Ни один из этих вариантов анатомии коронар |
из камер, как губчатый субэндокард у взрослых ля |
ных артерий не имеет клинических последствий и |
гушек. По мере роста эмбриона стенки сердца |
не включен в перечень аномалий коронарных ар |
утолщаются, мышечные слои располагаются более |
терий. |
компактно. Для снабжения субстратами метаболи |
|
чески активного миокарда из внутримышечных |
СТЕНОЗ И АТРЕЗИЯ УСТЬЯ |
синусоидов образуются интрамуральные коронар |
КОРОНАРНОЙ АРТЕРИИ |
ные артерии, капилляры и вены. Синусоиды фор |
|
мируют связи с коронарным синусом. Вскоре пос |
Эта редкая врожденная аномалия чаще поража |
ле этого, примерно на 44 й день гестации, из осно |
ет левую коронарную артерию (Koh и соавт., |
вания аорты начинают развиваться экстрамураль |
1989). Она может быть результатом внутриутроб |
ные сосуды, выпячивающиеся к верхушке сердца. |
ного воспаления, фибромышечной дисплазии, |
У них появляются проникающие ветви, которые |
врожденного порока развития. Отсутствие экстра |
входят в миокард и соединяются с примитивной |
муральной части коронарной артерии чаще наб |
системой синусоидов (1–5). Такие же зачатки зак |
людается при атрезии легочной артерии с интакт |
ладываются в основании легочной артерии. |
ной межжелудочковой перегородкой (13, 14) и при |
|
атрезии аорты. Давление в малых и резко гиперт |
ДОПОЛНИТЕЛЬНЫЕ |
рофированных правом или левом желудочках пре |
КОРОНАРНЫЕ АРТЕРИИ |
вышает давление в аорте. Коронарное кровообра |
|
щение осуществляется через расширенные сину |
Эти коронарные артерии представляют собой |
соиды, имеющие связь с коронарными артериями. |
типичные ветви коронарных артерий, отходящие |
Еl Said и соавторы (1973) описали атрезию устья |
самостоятельным устьем от синусов Вальсальвы, |
левой коронарной артерии у 14 летнего мальчика, |
поэтому дополнительным является только их |
предъявлявшего жалобы на боль в сердце, утомля |
устье. Наиболее часто отмечается патология пра |
емость при нагрузке, обмороки. У него выслуши |
вой коронарной артерии. Описано наличие от 2 до |
вался систолический шум на верхушке, на ЭКГ |
5 дополнительных устьев в правом коронарном |
периодически регистрировались желудочковые |
синусе. Ее первая ветвь — артерия конуса — у 50% |
экстрасистолы, при велоэргометрии отмечено |
пациентов отходит в виде самостоятельной арте |
смещение сегмента SТ ниже изолинии на 3 мм. |
рии от правого синуса Вальсальвы (6, 7). В этом |
Коронарография выявила ретроградное заполне |
случае ее называют правой дополнительной коро |
ние левой коронарной артерии через коллатерали. |
нарной артерией. |
Авторы выполнили аортокоронарное шунтирова |
У 1% здоровых людей и чаще при двустворча |
ние с использованием v. saphena. Сходство клини |
том аортальном клапане передняя нисходящая |
ческой симптоматики и данных ЭКГ у таких боль |
(передняя межжелудочковая) артерия и огибаю |
ных с фиброэластозом эндокарда является пово |
щая ветвь левой коронарной артерии отходят са |
дом для диагностики изолированного фиброэлас |
мостоятельными устьями от левого синуса (6, |
тоза или аномального отхождения левой коронар |
8–12). Передняя нисходящая артерия может отхо |
ной артерии от легочного ствола. Molander (1982) |
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
