
4 курс / Общая токсикология (доп.) / Врожденные пороки сердца
.pdf272 |
Часть 4. ДЕФЕКТЫ ПЕРЕГОРОДОК |
|
|
|
|
33.Allan L. Atrioventricular septal defect. In: Allan L, Hornberger L, Sharland G, eds. Textbook of Fetal Cardiology. London Greenwich Medical Media, 2000; 163–73.
34.Huggon IC, Cook AC, Smeeton NC, Magee AG, Sharland GK. Atrioventricular septal defects diagnosed in fetal life: associated car diac and extra–cardiac abnormalities and outcome. J Am Coll Cardiol. 2000; 36: 593–601.
35.Allan LD. Atrioventricular septal defect in the fetus. Am J Obstet Gynecol 1999; 181(5 part 1): 1250–3.
36.Fesslova V, Villa L, Nava S et al. Spectrum and outcome of atrioven tricular septal defect in fetal life. Cardiol Young 2002; 12:18–26.
37.Berger TJ, Blackstone EH, Kirklin JW et al. Survival and probability of cure without and with operation in complete atri oventricular canal. Ann Thorac Surg 1979; 27: 104–11.
38.Clapp S, Perry BL, Farooki ZQ et al. Down's syndrome, complete atri oventricular canal, and pulmonary vascular obstructive disease. J Thorac Cardiovasc Surg 1990; 100: 115–21.
39.Frescura C, Thiene G, Franceschini E, Talenti E, Mazzucco A. Pulmonary vascular disease in infants with complete atrioventricular septal defect. Int J Cardiol 1987; 15: 91–100.
40.Yamaki S, Yasui H, Kado H et al. Pulmonary vascular disease and oper ative indications in complete atrioventricular septal defect in early infancy. J Thorac Cardiovasc Surg 1993; 106:398–405.
41.Haworth SG. Understanding pulmonary vascular disease in young chil dren. Int J Cardiol 1987; 15: 101–3.
42.Haworth SG. Pulmonary vascular bed in children with complete atri oventricular septal defect: relation between structural and hemody namic abnormalities. Am J Cardiol 1986; 57:833–9.
43.Plett JA, Tandon R, Moller JH, Edwards JE. Hypertensive pulmonary vascular disease. Arch Pathol 1974; 97: 187–8.
44.Noonan JA, Walters LR. Hemodynamic studies in Down's syndrome patients with congenital heart disease. Pediatr Res 1974;79: 353.
45.Guenthard I, Wyler F. Complete atrioventricular septal defect and Ebstein anomaly. Pediatr Cardiol 1996; 17: 67–9.
46.Kontras SB, Bodenbender JA. Abnormal capillary morphology in con genital heart disease. Pediatrics 1966; 37: 316–22.
47.Ugazio AG, Lanzavecchia A, Jayakar S et al. Immunodeficiency in Down's syndrome. Titres of natural antibodies in E. coli and rabbit ery throcytes at different ages. Acta Paediatr Scand 1978;67: 70–8.
48.Chesler E, Korns ME, Edwards JE. Anomalies of the tricuspid valve, including pouches, resembling aneurysms of the membranous ventric ular septum. Am J Cardiol 1968; 21: 661–8.
49.Kudo T, Yokoyama M, Imai Y, Konno S, Sakakibara S. The tricuspid pouch in endocardial cushion defect. Am Hearth 1974;87: 5449.
50.Pah IE, Park SC, Anderson RH. Spontaneous closure of the ventricu lar component of an atrioventricular septal defect. Am J Cardiol 1987;
60:1203–5.
51.Grech V, Bailey M, Mercieca V. Spontaneous resolution of the septal defects in atrioventricular septal defect. Pediatr Cardiol 2001; 22: 302–5.
52.Thiene G, Ventriglia F, Frescura C. Heart and lung pathology in Down syndrome. In: Marino B, Pueschel S, eds. Heart Disease in Persons with Down Syndrome. Baltimore, MD: Paul H. Brookes, 1996: 111–25.
53.Freedom RM, Bini M, Rowe RD. Endocardial cushion defect and sig nificant hypoplasia of the left ventricle: a distinct clinical and patholog ical entity. Eur J Cardiol 1978; 7: 263–81.
54.Freedom RM, Perrin DG, Smallhorn JF. A consideration of certain anatomic risk factors in patients with atrioventricular septal defect. In: D'alessandro LC, ed. Heart Surgery. Rome:Casa Editrice Scientifica Internazione, 1985: 351–68.
55.Troconis CJ, Di Donato R, Marino B, Vairo U, Marcelletti C. Atrioventricular septal defects with severe left ventricular hypoplasia–clinical findings and surgical options. Cardiol Young 1992;
2:53–5.
56.Alvarado O, Sreeram N, McKay R, Boyd IM. Cavopulmonary connec tion in repair of atrioventricular septal defect with small right ventricle. Ann Thorac Surg 1993; 55:729–36.
57.Muster AJ, Zales VR, Ilbawi MN et al.. Biventricular repair of hypoplas tic right ventricle assisted by pulsatile bidirectional cavopulmonary anastomosis. J Thorac Cardiovasc Surg 1993; 105: 112–19.
58.van Son JA, Phoon CK, Silverman NH, Haas GS. Predicting feasibility of biventricular repair of right–dominant unbalanced atrioventricular canal. Ann Thorac Surg 1997; 63: 1657–63.
59.Giamberti A, Marino B, di Carlo D et al. Partial atrioventricular canal with congestive heart failure in the first year of life:surgical options. Ann Thorac Surg 1996, 62: 151–4.
60.Giamberti A, Marino B, di Carlo D etal. Partial atrioventricu lar canal with congestive heart failure in the first year of life:surgical options. Ann Thorac Surg 1996, 62: 151–4.
61.Lillehei CW, Cohen M, Warden HE. The direct vision intracardiac cor rection of congenital anomalies by controlled cross–circulation. Results in thirty–two patients with ventricular septal defects, tetralogy of Fallot and atrioventricularis communis defect. Surg 1955; 38:11–23.
62.Kirklin JW, Daugherty GW, Burchell HB et al. Repair of the partial form of persistent common atrioventricular canal: Ventricular communica tion. Ann Surg 1955; 142:858.
63.Watkins E Jr, Gross RE. Experiences with surgical repair of atrial sep tal defects. J Thorac Cardiovasc Surg 1955; 30:469.
64.Lev M. The architecture of the conduction system in congeni heart dis ease. I. Common atrioventricular orifice. AMA Arch Pathol 1958; 65:174.
65.Bharati S, Lev M, McAllister HA et al. Surgical anatomy of the atrioven tricular valve in the intermediate type of common atrioventricular ori fice. J Thorac Cardiovosc Surg 1980; 79:884–889.
66.Maloney JV, Marable SA, Mulder DG. The surgical treatment of com mon atrioventricular canal. J Thorac Cardiovasc Surg 1962;43:84–91.
67.Rastelli GC, Ongley PA, Kirklin JW, McGoon DC. Surgical repair of complete form of persistent common atrioventricular canal. J Thorac Cardiovosc Surg 1968; 5:299–308.
68.Rastelli GC, Weidman WH, Kirklin JW. Surgical repair of the partial form of persistent common atrioventricular canal, with special refer ence to the problem of mitral valve incompetence. Circulation 1965;31:131.
69.Castaneda AR, Mayer JE, Jonas RA. Repair of complete atrioventricu lar canal in infancy. World J Surg 1985; 9:590–597.
70.Van Mierop LHS, Alley RD, Kausel HW, Stranahan A. The anatomy and embryology of endocardial cushion defects. J Thorac Cardiovasc Surg 1962; 43; 71–83.
71.Anderson RH, Neches WI, Zuberbuhier JR, Penkoske PA. Scooping of the left ventricular septum in atrioventricular septal defect. J Thorac Cardiovasc Surg 1988; 95:146.
72.Clapp S, Perry BL, Farooki ZQ et al. Down's syndrome, complete atri oventricular canal, and pulmonary vascular obstructive disease. J Thorac Cardiovasc Surg 1990; 100:115–121.
73.Feldt RH, DuShane JW, Titus JL. The atrioventricular conduction sys tem in persistent common atrioventricular canal defect. Circulation 1970; 42 :437–444.
74.Carpentier A. Surgical anatomy and management of the mitral compo nent of atrioventricular canal defects. In Anderson RH, Shinebourne EA (eds). Pediatric Cardiology, London, Churchill Livingstone, 1980, pp 477–490.
75.Wilcox BR, Jones DR, Frantz EG et al. Anatomically sound, simplified approach to repair of complete atrioventricular septal defect. Ann Thorac Surg 1997; 64:487–493.
76.Nicholson IA, Nunn GR, Sholler GE et al. Simplified single patch tech nique for the repair of atrioventricular septal defect. J Thorac Cardiovasc Surg 1999; 118:642–646.
77.Chin AJ, Keane JF, Norwood WI, Castaneda AR. Repair of complete common atrioventricular canal in infancy. J Thorac Cardiovasc Surg 1982; 84:437–445.
78.Crawford FA Jr, Stroud MR. Surgical repair of complete atrioventricu lar septal defect. Ann Thorac Surg 2001; 72:1621–1628.
79.Starr A, Hovaguimian H. Surgical repair of subaortic stenosis in atri oventricular canal defects. J Thorac Cardiovasc Surg 1994,108:376–6.
80.Lappen RS, Muster AJ, Idriss FS, et al. Masked subaortic stenosis in ostium primum atrial septal defect: recognition and treatment. Am J Cardiol 1983;52:336–40.
81.DeLeon SY, Ilbawi MN, Wilson WR, et al. Surgical options in subaor tic stenosis associated with endocardial cushion defects. Ann Thorac Surg 1991;52:1076–83.

Глава 20. АТРИОВЕНТРИКУЛЯРНЫЙ СЕПТАЛЬНЫЙ ДЕФЕКТ
82.Ebels J, Meijboom EJ, Anderson RH, et al. Anatomic and functional "obstruction" of the outflow tract in atrioventricular septal defects with separate valve orifices ("ostium primum atrial septal defect"): an echocardiographic study. Am J Cardiol 1984;54:843–7.
83.Taylor NC, Somerville J. Fixed subaortic stenosis after repair of ostium primum defects. Br Heart J 1981; 45:689–97.
84.Ben–Shachar G, Moller JH, Castaneda–Zuniga W, Edwards JE. Signs of membranous subaortic stenosis appearing after correction of per sistent common atrioven tricular canal. Am J Cardiol 1981;48:340–4.
85.Van Praagh S, Antoniadis S. Otero–Coto E, et al. Commor atrioventric ular canal with and without conotruncal malformations: An anatomic study of 251 postmortem cases. In Takao A, Nora JJ (eds). Congenital Heart Disease: Cause and Processes. Mount Kisco, NY, Futura Publishing, 1984 pp 599–639.
86.Muhiudeen IA, Roberson DA, Silverman NH et al: Intraoperative echocardiography for evaluation of congenital heart defects in infants and children, Anesthesiology 76:165, 1992.
87.Roberson DA, Muhiudeen IA, Silverman NH et al: Intraoperative trans esophageal echocardiography of atrioventricular septal defect. J Am Coll Cardiol 18:537, 1991.
88.Canter CE, Sekaaski DC, Martin TC et al: Intraoperaijve evaluation of atrioventricular septal defect repair by color flow mapping echocardio graphy. Ann Thorac Surg 48:544, 1989.
89.Leblanc JG, Ashmore PG, Pineda E et al: Pulmonary artery banding: results and current indications in pediatric cardiac surgery. Ann Thorac Surg 44:628, 1987.
90.Van Nooten G, Deuvaert FE, DePaepe J et al: Pulmonary artery band ing: experience with 69 patients. J Cardiovasc Surg Torino 30:334, 1989.
91.Merrill WH, Hammon JW Jr, Graham TP Jr et al: Complete repair of atrioventricular septal defect, Ann Thorac Surg 52:29,1991.
92.Fixler DE. Atrioventricular septal defect. In: JH Moller, ed. Surgery of Congenital Heart Disease. Pediatric Cardiac Care Consortium. Perspectives in Pediatric Cardiology, Vol. 6.Armonk, NY: Futura, 1998: 67–83.
93.Freedom RM, Perrin DG, Smallhorn JF. A consideration of certain anatomic risk factors in patients with atrioventricular septal defect. In: D'alessandro LC, ed. Heart Surgery. Rome:Casa Editrice Scientifica Internazione, 1985: 351–68.
94.Manning PB, Mayer JE, Sanders SP et al Unique features and progno sis of primum ASD presenting in the first year of life. Circulation 1994; 90(5 part 2): 11–30–11–35.
95.El–Najdawi EK, Driscoll DJ, Puga FJ et al. Operation for partial atri oventricular septal defect: a forty–year review. J Thorac Cardiovasc Surg 2000; 119: 880–90.
96.Cooley DA, Garrett JR Septoplasty for left ventricular outflow obstruc tion without aortic valve replacement: a new technique. Ann Thorac Surg 1986; 42(4): 445–8.
97.Sayed HM, Dacie JV, Handley DA, Lewis SM, Cleland WP. Hemolytic anemia of mechanical origin after open heart surgery. Thorax 1961; 16: 356.
273
98.Sanyl SK, Polesky HF, Hume M, Browne MI. Spontaneous partial remission of postoperative hemolytic anemia in a case with ostium pri mum defect. Circulation 1964; 30: 803–7.
99.Neill CA. Postoperative hemolytic anemia in endocardial cushion defect. Circulation 1964; 30: 801–2.
100.Verdon TA, Forrester RH, Crosby WH. Hemolytic anemia after open heart repair of ostium–primum defects. N Engi J Med 1963; 269: 444–6.
101.Sigler AT, Forman EN, Zinkham WH, Neill CA. Severe intravascular hemolysis following surgical repair of endcardial cushion defect. Am J Med 1963; 35: 467–80.
102.Nevaril CG, Lynch EC, Alfrey CP, Hellums DH. Erythrocyte damage and destruction induced by shearing stress. J Clin Lab Invest 1968; 71: 784–90.
103.Tsang IC, Shum–Tim D, Tchervenkov CI, Jutras L, Sinclair B. Hemolytic anemia after atrioventricular septal defect repair without synthetic material. Ann Thorac Surg 1999, 68: 1838–40.
104.Oshima Y, Yamaguchi M, Yoshimura N, Oka S, Ootaki Y. Anatomically corrective repair of complete atrioventricular septal defects and major cardiac anomalies. Ann Thorac Surg 2001; 72(2): 424–9.
105.Gunther T, Mazzitelli D, Haehnel CJ et al. Long–term results after repair of complete atrioventricular septal defects: analysis of risk fac tors. Ann Thorac Surg 1998; 65(3): 754–9; discussion 759–60.
106.Hanley FL, Fenton KN, Jonas RA et al. Surgical repair of complete atrioventricular canal defects in infancy. Twenty–year trends. J Thorac Cardiovasc Surg 1993; 106(3): 387–94; discus sion 394–7.
107.Permut LC, Mehta V. Late results and reoperation after repair of com plete and partial atrioventricular canal defect. Semin Thorac Cardiovasc Surg 1997; 9(1): 44–54.
108.McGrath LB, Gonzalez–Lavin L. Actuarial survival, freedom from reoperation, and other events after repair of atrioventricular septal defects. J Thorac Cardiovasc Surg 1987; 94(4):582–90.
109.Tweddell JS, Litwin SB, Berger S et al. Twenty–year experience with repair of complete atrioventricular septal defects. Ann Thorac Surg 1996; 62: 419–24.
110.Rhodes J, Warner KG, Fulton DR, Romero BA, Schmid CH, Marx GR. Fate of mitral regurgitation following repair of atrioventricular septal defect. Am J Cardiol 1997; 80(9): 1194–7.
111.Jonas J. Comprehensive surgical management of congenital heart disease. Arnold, 2004,397–398.
112.Najm HK, Van Arsdell GS, Watzka S et al. Primary repairis superior to initial palliation in children with atrioventricular septal defect and tetral ogy of Fallot. J Thorac Cardiovasc Surg 1998, 116: 905–13.
113.McElhinney DB, Reddy VM, Silverman NH, Brook MM, Hanley FL. Atrioventricular septal defect with common valvar orifice and tetralogy of Fallot revisited: making a case for primary repair in infancy. Cardiol Young 1998; 8(4): 455–61.
114.Karl TR. Atrioventricular septal defect with tetralogy of Fallot or dou ble outlet right ventricle: surgical considerations. Semin Thorac Cardiovasc Surg 1997, 9: 26–34.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Глава 21
ДЕФЕКТ
МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ
В 1879 г. Roger (1) впервые описал клинические |
служить как наследственная предрасположен! |
признаки небольшого дефекта межжелудочковой |
ность, так и влияние факторов внешней среды. |
перегородки (ДМЖП). В 1897 г. Eisenmenger опуб! |
ЭМБРИОЛОГИЯ |
ликовал посмертные находки у синего больного, |
|
умершего в возрасте 32 года: большой ДМЖП и |
|
смещенную вправо аорту. С младенческого воз! |
Межжелудочковая перегородка начинает фор! |
раста у пациента имели место цианоз и одышка, |
мироваться в конце 4!й недели внутриутробного |
выслушивались шумы недостаточности трех! |
развития. Нормальное закрытие межжелудочко! |
створчатого и легочного клапанов. На аутопсии |
вой перегородки происходит благодаря трем кон! |
были обнаружены гипертрофия и дилатация пра! |
курирующим механизмам: |
вого желудочка, расширенное кольцо трехствор! |
а) росту конотрункусного гребня книзу, что фор! |
чатого клапана, большой ДМЖП со смещенной |
мирует перегородку тракта оттока; |
аортой, атеросклероз легочных артерий и геморра! |
б) росту эндокардиальных подушечек, в результа! |
гический инфаркт легких вследствие тромбоза ле! |
те чего образуется приточная перегородка; |
гочной артерии (2). Abbott (3) писала, что первое |
в) росту мышечной перегородки, которая форми! |
упоминание об этом пороке появилось в 1847 г. в |
рует апикальную и среднемышечную части пе! |
публикации Dalrymple, однако она ввела термин |
регородки. |
комплекс Eisenmenger. Это наименование применя! |
Если к 7–8!й неделе гестации слияние этих об! |
ется для обозначения стадии естественного тече! |
разований неполное, остается отверстие, через ко! |
ния большого ДМЖП с высоким сопротивлением |
торое сообщаются полости желудочков. Если же |
легочных сосудов и преимущественно право!ле! |
процесс слияния первичной перегородки с аорто! |
вым шунтом. |
легочной перегородкой, разделяющей магист! |
ЧАСТОТА |
ральные сосуды, будет прерван, образуется дефект |
конусной части межжелудочковой перегородки |
|
|
(подартериальный) или перимембранозный де! |
Изолированный ДМЖП является самым час! |
фект. Неполное слияние эндокардиальных отро! |
тым ВПС, если исключить двустворчатый аор! |
стков с первичной межжелудочковой перегород! |
тальный клапан, и составляет 20% всех врожден! |
кой приводит к формированию дефекта приточ! |
ных аномалий (4,5) у детей, родившихся живыми; |
ной части межжелудочковой перегородки под пе! |
1,5–3,5 случая на 1000 родившихся в срок (4–8) и |
регородочной створкой трехстворчатого клапана |
4,5–7 — на 1000 родившихся раньше срока (6, 8). |
(дефект типа АВСД). Нарушение формирования |
Меньшая частота этого порока среди взрослых с |
самой первичной перегородки приводит к образо! |
ВПС вызвана главным образом спонтанным зак! |
ванию дефекта в области мышечной части межже! |
рытием многих дефектов. Дефект межжелудочко! |
лудочковой перегородки, чаще всего в области |
вой перегородки чаще диагностируется у лиц |
верхушки сердца. Tsang и соавторы (9) считают, |
женского пола — в 56% случав против 44% у лиц |
что эти дефекты являются следствием нарушения |
мужского пола (6). Дефект межжелудочковой пе! |
эмбрионального процесса уплотнения первичного |
регородки является наиболее частым пороком при |
губчатого миокарда в области мышечной перего! |
большинстве хромосомных синдромов — трисо! |
родки у верхушки. |
мии 13, трисомии 18 и трисомии 21. В большин! |
На формирование ДМЖП влияют хромосом! |
стве случаев (более 95%) дефект не сочетается с |
ные, наследственные и географические факторы. |
хромосомными аномалиями. Этиология порока |
Некоторые исследователи (10–12) обнаружили |
является мультифакторной. Причинами могут |
связь дефектов конусной перегородки с микроде! |
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
276 |
Часть 4. ДЕФЕКТЫ ПЕРЕГОРОДОК |
|
|
|
|
лециями в хромосоме 22q11.2 (синдром Di George, или велокардиофациальный синдром). С этой же причиной связывают образование перимембра! нозных ДМЖП. У детей родителей с ДМЖП наб! людается большая частота формирования ВПС, однако это могут быть необязательно ДМЖП.
АНАТОМИЯ
Размеры дефектов варьируют от минималь! ных, гемодинамически не значимых, до крупных, конкурирующих по размерам с устьем аорты. По предложению Rowe (13), размеры межжелудочко! вых дефектов сравнивают с диаметром корня аор! ты. Если соотношение диаметра ДМЖП и диа! метра корня аорты > 0,8, дефект считают боль! шим, если диаметр ДМЖП составляет 1/2 диамет! ра аорты — средним, меньше 1/4 диаметра аорты
—малым.
Вбольшинстве случаев дефект является прос! тым отверстием в межжелудочковой перегородке. Реже дефект обусловлен тем, что первичная и ин! фундибулярная перегородки расположены в раз! ных плоскостях, они не соосны и поэтому не сра! щены (malalignment defect). Конусная (выводная) перегородка может отклоняться кпереди в сторону правого желудочка или кзади, в сторону левого же! лудочка. Перегородка отклоняется влево или впра! во, как дверь на фиксированных петлях (14). Наи! более часто встречается отклонение инфундибу! лярной перегородки кпереди. В этих случаях она отклоняется в сторону выводного тракта правого желудочка, что приводит к образованию большого ДМЖП и нависанию (overriding) аорты над первич! ной перегородкой. Этот тип дефекта характерен для комплекса Eisenmenger. При выраженном вторжении конусной перегородки в выводной тракт правого желудочка создается анатомия тет! рады Фалло. При отклонении конусной перего! родки кзади в выводной тракт левого желудочка на "шарнире", крепящемся вдоль аортального клапа! на, образуются ДМЖП и мышечный субаорталь! ный стеноз. При выраженном отклонении инфун! дибулярной перегородки влево клапан легочной артерии может нависать над межжелудочковой пе! регородкой. Задний несоосный дефект часто соче! тается с обструктивной патологией дуги аорты; он получил наименование дефекта коарктационного типа. Такой дефект часто наблюдается у больных с перерывом дуги аорты (15–19). Несоосность между предсердной и мышечной межжелудочковой пере! городками является причиной нависающих AV! клапанов и клапанов!наездников. Эта патология в данной главе не рассматривается.
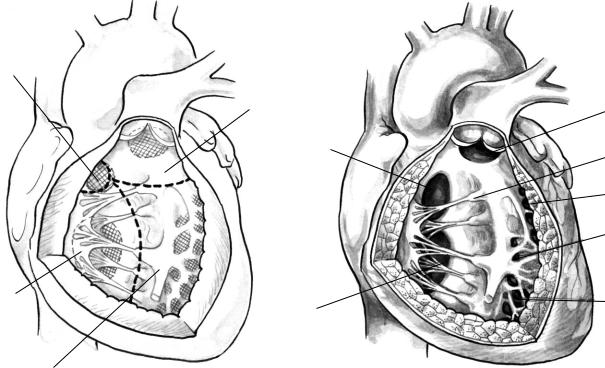
Классификация ДМЖП основана на локализа! ции дефектов. Наиболее исчерпывающая класси! фикация была опубликована Soto и соавторами (20). Межжелудочковую перегородку подразделя! ют на 4 части (рис. 1): приточную часть, отделяю! щую митральный и трехстворчатый клапаны; тра! бекулярную перегородку, которая простирается от места прикрепления папиллярных мышц трех! створчатого клапана книзу до верхушки и кверху до наджелудочкового гребня; гладкостенную вы! водную, или инфундибулярную, перегородку, ко! торая находится между наджелудочковым гребнем и легочным клапаном; относительно небольшую мембранозную перегородку, которая обычно раз! делена на две части перегородочной створкой трехстворчатого клапана.
Наиболее частым (80%) дефектом является пе римембранозный (синонимы — мембранозный дефект и подгребешковый). Он располагается в выводном тракте левого желудочка непосредствен! но под аортальным клапанаом и обычно простира! ется в прилежащие мышечную, приточную и выводную область. Со стороны правого желудочка дефект лежит под наджелудочковым гребнем (край конусной перегородки) и кзади от папиллярной мышцы конуса. Дефекты межжелудочковой пере! городки этой области часто вовлекают прилежа! щие отделы мышечной перегородки, поэтому их называют перимембранозными — перимембра! нозными приточными (типа АВСД), перимембра! нозными трабекулярными, перимембранозными инфундибулярными (при тетраде Фалло).
В связи с наличием лево!правого сброса разви! ваются вторичные приобретенные аномалии трех! створчатого клапана в виде избыточных тканей перегородочной створки или мешочков, которые могут частично или полностью закрыть дефект. Эти мешочки раньше называли «аневризмами межжелудочковой перегородки» и связывали с возможностью спонтанного закрытия дефекта. При перимембранозном дефекте инфундибуляр! ная перегородка иногда смещена кпереди, и в ре! зультате нарушения соосности между инфундибу! лярной и передней межжелудочковой перегород! кой аортальный клапан нависает над дефектом. Смещение конусной перегородки кзади или влево приводит к образованию субаортального стеноза. В случаях, когда имеется дефицит перегородочной комиссуры трехстворчатого клапана в месте ее прикрепления к атриовентрикулярной мембра! нозной перегородке, происходит лево!правый сброс крови из левого желудочка в правое пред! сердие. При таких дефектах шунт крови происхо! дит на желудочковом и предсердном уровнях. Из!
Глава 21. ДЕФЕКТ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ |
277 |
|
|
|
|
Мембранная
часть
|
|
|
Конусная часть |
|
|
|||
|
|
|
|
1 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
||
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
Приточная |
|
|
|
|
|
|||
|
|
|
6 |
|
|
|||
часть |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Трабекулярная |
|
|
|
|
|
|
|
|
часть |
а |
|
|
|
|
б |
||
|
|
|
|
|
|
|||
Рис. 1. Типы ДМЖП: а — вид межжелудочковой перегородки со стороны правого желудочка; б — анатомическое распо ложение дефектов: 1 — подлегочный дефект, 2 — папиллярная мышца конуса, 3 — перимембранозный дефект, 4 — кра евые мышечные дефекты, 5 — центральные мышечные дефекты, 6 — приточный дефект, 7 — верхушечные мышечные де фекты
редка встречается изолированный дефект между левым желудочком и правым предсердием (так на! зываемый косой канал). При таких дефектах име! ют место аномалии трехстворчатого клапана в ви! де перфорации, деформации, расщепления, диас! таза комиссуры.
В период эмбриогенеза закрытие межжелудоч! кового отверстия зависит от трех факторов: роста соединительной ткани на гребне мышечной пере! городки; роста гребней, разделяющих конус и ар! териальный трункус; прорастания в AV!канал правосторонних подушечек. Благодаря множеству механизмов, принимающих участие в закрытии мембранозной перегородки (межжелудочкового отверстия), дефект образуется чаще всего именно в этом месте.
Дефекты, расположенные в выводном тракте правого желудочка ниже легочного клапана, назы! вают надгребешковыми, инфундибулярными, ко! нусными, подлегочными или субартериальными дефектами с двойной связью с аортальным и ле! гочным клапанами. Эти дефекты в западных попу! ляциях встречаются у 5–7% больных с ВПС, за исключением Японии и других дальневосточных стран, где такая локализация встречается гораздо чаще — почти у 30% пациентов (21).
У пациентов с подлегочными дефектами кону!
са часто отсутствует мышечная или фиброзная опора аортального клапана, что приводит к гры! жевидному выпячиванию правой аортальной створки в ДМЖП. Провисание обусловлено не только отсутствием опорной стромы прилежащих створок (чаще некоронарной), но и инжекцион! ным присасывающим эффектом струи крови. Вы! падающая створка может создать градиент давле! ния в выводном тракте правого желудчка. Аор! тальные комиссуры обычно нормальные. У боль! ных с перимембранозным межжелудочковым де! фектом и аортальной недостаточностью пролаби! руют правая и/или некоронарная створки, аор! тальные комиссуры часто аномальные, нередко (до 40%) имеет место инфундибулярный стеноз легочной артерии. Пролабирующая аортальная створка частично закрывает небольшой дефект перегородки, препятствуя лево!правому шунтиро! ванию. Частота аортальной недостаточности при субартериальных дефектах увеличивается с 5% в возрасте младше 3 лет до 50% к 13–15 годам (22).
Аортальная недостаточность не всегда связана с пролабированием створок и может быть обус! ловлена двустворчатым клапаном.
Приточные дефекты, которые расположены кзади и книзу от мембранозных дефектов под пе! регородочной створкой трехстворчатого клапана и
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
278 |
Часть 4. ДЕФЕКТЫ ПЕРЕГОРОДОК |
|
|
|
|
ниже папиллярной мышцы конуса, ранее называ! ли атриовентрикулярными септальными дефекта! ми. Однако в данном случае это наименование нельзя признать правильным, так как эти дефекты обычно не сопровождаются аномалиями митраль! ного и трехстворчатого клапанов и общий атрио! вентрикулярный пучок Гиса не проходит ниже де! фекта, как при истинном АВСД (23). Приточные дефекты встречаются в 5–8% случаев.
Дефекты в мышечной перегородке нередко бы! вают множественными и встречаются с частотой 5–20%. Мышечные дефекты подразделяют на вер! хушечные, центральные и краевые, или передние (24, 25). Верхушечные дефекты встречаются чаще остальных. Они плохо видны со стороны правого желудочка, поскольку обычно окружены и покры! ты трабекулами, образующими извитые каналы. Со стороны левого желудочка трабекул мало и множественные отверстия часто соединяются и приобретают вид одного дефекта. Иногда верху! шечные дефекты имеют большие размеры.
Другим вариантом мышечных дефектов явля! ются центральные дефекты, расположенные поза! ди перегородочно!краевой трабекулы и в средней части перегородки. Обычно они частично прик! рыты трабекулами и могут создавать впечатление множественных дефектов. Со стороны левого же! лудочка такой дефект выглядит единичным, имеет округлую форму и расположен вдали от верхушки, передней и задней стенок левого желудочка.
Маленькие мышечные дефекты в области сое! динения перегородки и свободной стенки называ! ют краевыми, или передними, дефектами. Они обычно множественные, мелкие, извитые и выст! роены вдоль края перегородки. Множественные мышечные дефекты могут создавать решетчатость перегородки, образно называемой «швейцарским сыром». Эти ДМЖП типа швейцарского сыра крайне трудны для хирургического закрытия. Взаимоотношения атриовентрикулярных прово! дящих путей с ДМЖП очень важны с хирургичес! кой точки зрения. При перимембранозном дефек! те пучок Гиса проходит субэндокардиально по задненижнему краю дефекта. При приточных де! фектах пучок Гиса огибает дефект спереди и свер! ху (26). Мышечные и субартериальные дефекты располагаются вдали от пучка Гиса, если они не простираются в перимембранозную область.
Блокада правой ножки пучка Гиса возникает часто после закрытия ДМЖП и, вероятно, связана с вентрикулотомией (27, 28) или прямым повреж! дением правой ножки, которая проходит вдоль задненижнего края перимембранозного дефекта. Блокада правой ножки возникает в 60% случаев
при закрытии мышечных дефектов через попереч! ную вентрикулотомию и в 44% — при закрытии перимембранозных дефектов доступом через пра! вое предсердие (28). При вертикальной вентрику! лотомии частота блокады правой ножки увеличи! вается до 80% (29). Предполагается, что блокада правой ножки связана с пересечением дистальной ветви правой ножки, а не с повреждением разветв! лений Пуркинье.
ГЕМОДИНАМИКА
Выраженность гемодинамических нарушений зависит от разметов дефекта. При малых и средних размерах дефект ограничивает сброс крови слева направо. Большие дефекты, приблизительно рав! ные размеру устью аорты, не оказывают сущест! венного сопротивления току крови через дефект. Его объем определяется соотношением сопротив! лений сосудов системного и легочного кругов кро! вообращения.
Влияние ЛСС на структуру и функцию сердечно+сосудистой системы
После рождения фетальные резистивные мы! шечные легочные артерии малого просвета с утол! щенным мышечным слоем в течение 7–10 дней приобретают структуру взрослого типа — стенка артерий истончается, а их просвет увеличивается. Одновременно с морфологическими изменениями снижается ЛСС. При наличии больших дефектов этот процесс отсрочен и увеличенное легочное соп! ротивление служит защитным механизмом против чрезмерного увеличения легочного кровотока. По! вышение давление в левом предсердии (легочное венозное давление) играет важную роль в поддер! жании фазы легочной вазоконстрикции (30).
Когда легочные сосуды вытягиваются и дости! гают границ окружающих их фиброзных футля! ров, кривая давление–кровоток становится ли! нейной (31), поэтому дальнейшее увеличение кро! вотока сопровождается повреждением сосудов, которое может индуцировать воспалительный ар! териит. Хроническая баротравма и напряжение сдвига приводят к утолщению адвентиции, ги! пертрофии среднего мышечного слоя и поврежде! нию интимы. Глубинные процессы, происходя! щие на субклеточном уровне, изложены в гл. 6.
У больных с большими дефектами физиологи! ческое снижение ЛСС происходит в течение пер! вых нескольких месяцев жизни, что приводит к увеличению лево!правого сброса крови. Чрезмер! ный легочный кровоток сдерживается легочной
Глава 21. ДЕФЕКТ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ |
279 |
|
|
|
|
венозной и левопредсердной гипертензией, воз! никающими вследствие объемной перегорузки ле! вого желудочка. Левое предсердие и желудочек за! метно расширяются. При выраженной перегрузке левых отделов сердца развивается застойная сер! дечная недостаточность в возрасте 2–8 нед. Ком! пенсаторными механизмами, которые позволяют младенцу адаптироваться к объемной перегрузке, являются эффект Frank–Starling, увеличенная симпатическая стимуляция сердца и гипертрофия миокарда. Скорость развития гипертрофии явля! ется одним из ведущих факторов способности ре! бенка адекватно компенсировать ДМЖП с боль! шим лево!правым шунтом.
При умеренно повышенном ЛСС и большом сбросе артериальной крови систолическое давле! ние в легочной артерии и аорте равны. Реакция ле! гочных сосудов на гиперволемию различна. У не! которых пациентов сопротивление повышается незначительно и большой объем легочного крово! тока остается стабильным. У других легочные со! суды расширяются и удлиняются, мышечный средний слой стенок легочной артерии гипертро! фируется, увеличивается тонус резистивных сосу! дов, постепенно развиваются склеротические из! менения интимы. Эти изменения обычно наблю! даются только при больших дефектах, когда выб! рос в легочную артерию осуществляют оба желу! дочка. Гемодинамическими и клиническими пос! ледствиями повышения ЛСС являются снижение объема легочного кровотока, уменьшение диасто! лической перегрузки левых отделов сердца, посте! пенное уменьшение размеров левого предсердия и левого желудочка и уменьшение мышечной массы левого желудочка. Когда ЛСС превысит таковое в системном бассейне, давление в обоих кругах кро! вообращения остается равным, но направление сброса крови изменяется преимущественно на право!левое. Эту стадию легочной гипертензии называют синдромом Eisenmenger. У некоторых больных сопротивление легочных артерий после рождения никогда не снижается, т.е. сохраняется плодный тип строения легочных артерий. На про! тяжении всего младенческого периода у них высо! кое ЛСС, сбалансированный сброс, почти нор! мальные размер левого желудочка и масса миокар! да. У этих пациентов нет признаков левожелудоч! ковой декомпенсации ни в младенческом, ни в детском возрасте. Последняя стадия синдрома Eisenmenger одинакова в обеих группах. Иногда развивается декомпенсация правого желудочка, обычно в 3!й и 4!й декадах жизни.
Характер рабочей нагрузки на правый желудо! чек зависит от соотношения величины ЛСС и ве!
личины лево!правого сброса. При небольших де! фектах систолическое давление в правом желудоч! ке, объемная нагрузка и толщина стенки остаются нормальными. При средних размерах дефектов соотношение объема сброса и ЛСС таково, что давление в легочной артерии умеренно повышено и работа правого желудочка увеличена в основном за счет объемной нагрузки. Гипертрофия желудоч! ка пропорциональна степени повышения давле! ния. Большие дефекты создают систолическую перегрузку правого желудочка, связанную с прео! долением высокого ЛСС. Прогрессирует гиперт! рофия правого желудочка. При больших дефектах происходит диастолическое шунтирование слева направо через дефект, которое сопровождается расширением полости правого желудочка, менее выраженным, чем расширение левого желудочка (32).
Варианты физиологических состояний
Небольшой дефект с низким ЛСС
Небольшие дефекты оказывают большое соп! ротивление току крови с выраженным систоли! ческим градиентом давления между желудочками, с малым объемом лево!правого сброса и практи! чески нормальной работой желудочков. Объем сброса крови прямо связан с размером дефекта, и отсутствует тенденция к повышению ЛСС. Бдаго! даря наличию градиента давления в систолу и ди! астолу шунтирование крови происходит в течение всего сердечного цикла. Сокращение предсердий усиливает диастолический переток крови слева направо. Начало систолы желудочков характери! зуется более ранним повышением давления в ле! вом желудочке, чем в правом. Поэтому шунтиро! вание крови начинается в фазу изометрического сокращения. Наибольшие градиент и сброс крови отмечаются в фазу выброса. После закрытия полу! лунных клапанов во время изоволемического рас! слабления также происходит сброс крови. В конце изоволемического расслабления во время корот! кого интервала ранней диастолы, когда давление в левом желудочке падает ниже уровня давления в правом желудочке, лево!праый сброс временно прекращается, а реверсия шунта в этот момент не происходит.
Фонокардиографические исследования пока! зывают, что при большом градиенте давления между желудочками в течение всей систолы опре! деляется голосистолический шум. Диастоличес! кий шум отсутствует, несмотря на переток крови через дефект. Это объясняется недостаточной тур!
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
280 |
Часть 4. ДЕФЕКТЫ ПЕРЕГОРОДОК |
|
|
|
|
булентностью крови из!за малого количества шунтируемой крови.
Дефект средних размеров с вариабельным ЛСС
Дефекты средних размеров оказывают меньшее сопротивление шунтовому току, однако достаточ! но малы для беспрепятственного лево!правого сброса крови. Величина дефекта обычно меньше или равна половине диаметра аорты, и систоли! ческое давление в правом желудочке достигает 70–85% системного давлению. Легочно!сосудис! тое сопротивление обычно не повышено. Боль! шой объем шунта крови создает объемную перег! рузку левого предсердия и желудочка и приводит к гипертрофии поледнего. Систолическая работа и мышечная масса правого желудочка увеличены незначительно, так как в диастолу желудочек на! полняется нормальным количеством крови из по! лых вен. Во время систолы давление в левом желу! дочке возрастает быстрее, чем в правом, и гради! ент давления остается в течение всей систолы и в начальный период изоволемического расслабле! ния. Давление в левом желудочке падает быстрее, чем в правом, поэтому во время релаксации воз! никает положительный право!левый градиент и венозный сброс в выводной отдел левого желудоч! ка. С началом диастолы перепад давления на меж! желудочковой перегородке способствует сбросу крови из левого желудочка в правый. Небольшой объем крови, которая шунтировалась справа нале! во во вмемя изоволемической релаксации, возвра! щается в правый желудочек и не поступает в сис! темное кровообращение.
У младенцев, несмотря на рестриктивный де! фект, объем шунтового тока относительно боль! шой. Если дефект отстает в росте относительно массы тела, абсолютный объем шунта снановится менее значительным.
Большой дефект с умеренным повышением ЛСС
Дефект считается большим, когда его размеры сравнимы с размерами устья аорты. Поскольку де! фект не оказывает сопротивления перетоку крови, легочное кровообращение генерируется обоими желудочками. Объем и направление сброса крови определяются соотношением сосудистых сопро! тивлений малого и большого кругов кровообраще! ния. Кровь шунтируется слева направо также в фа! зу диастолы, усиливаясь сокращением предсер! дий. В начале систолы давление в левом желудоч! ке повышается раньше, чем в правом, способствуя перетоку крови через дефект до открытия аорталь!
ного клапана. Период раннего выброса характери! зуется наличием градиента давления на перего! родке и шунта через дефект в выходной тракт пра! вого желудочка. Во время позднего периода сер! дечного выброса давление в правом желудочке превышает таковое в левом. В этот момент сброс крови прекращается. В некоторых случаях возни! кает право!левый сброс в аорту, когда давление в левом желудочке падает ниже, чем в легочной ар! терии и аорте. В период релаксации давление в ле! вом желудочке падает быстрее и раньше, чем в правом. Возникают право!левый градиент давле! ния и шунтирование крови из правого желудочка в левый. Венозная кровь подмешивается к артери! альной в верхней части левого желудочка и остает! ся там несмотря на диастолический лево!правый сброс, поэтому в фазу изгнания небольшая часть смешанной крови изгоняется в аорту.
Большой дефект с выраженным повышением ЛСС
В этой ситуации объемная нагрузка левого же! лудочка нормальная. Шунтирование через дефект обычно справа налево. В диастолу и раннюю сис! толу сброс крови реверсный. Во время раннего изгнания имеет место очень небольшой сброс кро! ви слева направо. В поздней систоле происходит сброс крови справа налево из правого желудочка в аорту, который продолжается в течение раннего периода релаксации. Шум, генерируемый током крови через дефект во время раннего периода выб! роса, минимален, а в период право!левого шунти! рования он отсутствует.
КЛИНИКА
Состояние больного зависит от размера дефек! та, ЛСС и их изменений с возрастом. Обычно шум обнаруживают в первом полугодии жизни. Он мо! жет быть обнаружен в первые дни после рожде! ния, особенно при малых и средних размерах де! фекта, когда ЛСС быстро снижается. Клиничес! кое течение малых дефектов в младенческом и детском возрасте благоприятное. Единственную угрозу представляет эндокардит, который редко возникает до 2 лет.
Симптоматика у детей в возрасте от 2 нед до 1 года обусловлена недостаточностью левого желу! дочка вследствие лево!правого сброса. Ведущими признаками являются одышка, потливость как проявление повышенного симпатического тонуса и быстрое утомление во время еды. Поскольку прием пищи является самой большой нагрузкой в первые месяцы, этот анамнез очень важен. Младе!
Глава 21. ДЕФЕКТ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ |
281 |
|
|
|
|
|
|
|
нец быстро устает при приеме пищи. Этот симптом |
чину сопротивления току крови слева направо. |
|
появляется в течение 1 мес и усиливается по мере |
Оно может быть обусловлено увеличением ЛСС, |
|
падения ЛСС. Симптоматика у недоношенных де! |
уменьшением относительных рзмеров дефекта |
|
тей появляется раньше, чем у родившихся в срок. |
или развитием гипертрофии выводного тракта |
|
Нередко застой в легких осложняется респиратор! |
правого желудочка с функциональной или анато! |
|
ной инфекцией, и их бывает трудно различить. |
мической обструкцией. |
|
При отсутствии инфекции причиной дыха! |
Для младенцев с большим сбросом крови ха! |
|
тельной недостаточности является отек легких |
рактерно физическое недоразвитие. При больших |
|
различной выраженности с повышением легочно! |
дефектах нередко имеют место сердечный горб и |
|
го венозного давления и снижением легочного |
систолическое дрожание. Аускутьтативная карти! |
|
комплайнса. Снижение растяжимости легких па! |
на очень информативна для оценки размеров де! |
|
тогенетически не связано с увеличенным легоч! |
фекта; II тон нормален при маленьких дефектах и |
|
ным кровотоком и легочной гипертензией. Оно |
усилен при больших. У больных с повышенным |
|
обусловлено увеличением давления в левом пред! |
ЛСС он звонкий, не расщеплен. По левому краю |
|
сердии (33). Хорошо известно, что у больных с |
грудины слышен грубый систолический шум, го! |
|
изолированными ДМПП, большим лево!правым |
лосистолический или занимающий раннюю сис! |
|
сбросом и нормальным или несколько повышен! |
толу. При большом сбросе крови иногда слышен |
|
ным давлением в левом предсердии комплайнс |
диастолический шум на верхушке. При дефекте, |
|
легких нормальный и одышка обычно отсутствует |
расположенном в инфундибулярной части перего! |
|
(34). У взрослых с митральным стенозом растяжи! |
родки и сопровождающемся пролабированием |
|
мость легких обычно нормальна, если давление в |
аортальной створки, определяется убывающий |
|
легочном венозном русле не превышает 15 мм рт. |
диастолический шум. |
|
ст. (35). У младенцев с большим сбросом слева |
При уменьшении объема шунта симптоматика |
|
направо на желудочковом уровне одышка может |
и прирост массы тела улучшаются. Уменьшение |
|
возникнуть при среднем давлении в левом пред! |
размеров дефекта относительно поверхности тела |
|
сердии ниже 15 мм рт. ст. |
отмечается более чем у половины пациентов с |
|
Физиологическая анемия, которая наблюдает! |
большим ДМЖП (6). При стабильноий объемной |
|
ся у младенцев в возрасте 2–5 мес, также сопро! |
перегрузке дети продолжают отставать в росте, |
|
вождается увеличением легочного кровотока (36). |
страдают от одышки и повышенной потливости. |
|
Относительный эритроцитоз при рождении уве! |
Цианоз, наблюдаемый в первые недели жизни, |
|
личивает постнатальное сопротивление легочных |
носит преходящий характер и в последующем про! |
|
сосудов, а последующая анемия способствует сни! |
является при чрезмерной нагрузке. Постоянный |
|
жению сопротивления и увеличению шунта. |
цианоз, наблюдаемый с момента рождения, ука! |
|
У некоторых младенцев с большими дефектами |
зывает на вероятное наличие более сложного по! |
|
в первые несколько месяцев жизни ЛСС снижает! |
рока, чем изолированный ДМЖП. Цианоз, сохра! |
|
ся незначительно, поэтому объем лево!правого |
няющийся больше года, говорит о реверсии шунта |
|
шунта небольшой. Эти дети не проходят фазу сер! |
вследствие прогрессирования обструктивной бо! |
|
дечной недостаточности, связанной с большой |
лезни легочных сосудов или о развитии выражен! |
|
объемной нагрузкой. Благоприятное клиническое |
ного инфундибулярного стеноза. |
|
течение маскирует выраженные физиологические |
Большинство пациентов с комплексом |
|
нарушения, приводящие к обструктивной болезни |
Eisenmenger цианотичны с младенчества. Этот |
|
легочных сосудов с неизбежной реверсией шунта. |
синдром возникает с момента рождения или раз! |
|
Клиническое течение порока после стадии сердеч! |
вивается в течение первых 2 лет жизни. Сущест! |
|
ной недостаточности может быть различным. У |
венное ухудшение наступает у взрослых |
|
некоторых младенцев с большими дефектами |
пациентов молодого возраста. Позу на корточках |
|
ЛСС продолжает снижаться одновременно с уве! |
принимают 15% этих больных, в возрасте старше |
|
личением шунта и усилением сердечной недоста! |
24 лет у каждого третьего возникают эпизоды кро! |
|
точности. Многие из них хорошо поддаются меди! |
вохаркания. В возрасте 40 лет легочные кровотече! |
|
каментозному лечению. Развивающаяся гипер! |
ния возникают у всех больных; в 29% случаев они |
|
трофия левого желудочка позволяет компенсиро! |
являются причиной смерти. |
|
вать объемную перегрузку и достичь улучшения |
|
|
состояния. У многих пациентов постепенно сни! |
|
|
жается объем шунта в период между 6 мес и 24 мес. |
|
|
При таком течении очень важно установить при! |
|
|
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
