
6 курс / Неонатология / Неонатология_Н_П_Шабалов_7_е_издание_Том_1_2020
.pdf
гнойно-септические заболевания), с дыхательной недостаточностью, требующей продленной интубации трахеи, ИВЛ или вспомогательной ВЛ.
Данные литературы и наш опыт показали, что существуют и четкие противопоказания к зондовому питанию. К ним относят некротический энтероколит, парез кишечника, мелену новорожденных, тяжелую гипоксию, не корригируемую ИВЛ, наличие грубых нарушений водно-электролитного и кислотно-основного состояния, использование миорелаксантов при ИВЛ.
Техника. Длина зонда зависит от вида питания. При гастральном способе она составляет 30-50 см, при дуоденальном - 50-70 см. На дистальном конце зонда должно быть 2-3 дополнительных боковых отверстия, а дуоденальный зонд, кроме того, оканчивается оливой из нержавеющей стали. Диаметр зонда, размеры оливы и необходимая глубина введения представлены в табл. 6.21.
Необходимую глубину введения зонда можно определить, пользуясь следующими ориентирами. Для назогастрального питания она соответствует расстоянию от переносицы до пупка, для назодуоденального - от козелка уха до угла рта и до пупка ребенка. Введение назогастрального зонда, как правило, не представляет серьезных трудностей, однако если зонд очень мягкий, можно применить мандрен (леску).
Техника дуоденального введения зонда состоит из ряда операций. Предварительно измеряют необходимую глубину введения и отмечают ее на катетере. Через рот вводят в
желудок катетер большего диаметра, вдувают в него через шприц 1-2 мл воздуха и контролируют положение катетера по наличию урчания в эпигастральной области. Затем через нижний носовой ход проводят в желудок дуоденальный зонд. Ребенка укладывают на правый бок. Через желудочный зонд медленно вводят воздух из расчета 10 мл/кг массы тела, после чего дуоденальный зонд осторожно продвигают до отметки. Если зонд прошел в двенадцатиперстную кишку, то при отсасывании шприцом получают небольшое количество жидкости, окрашенной в желтый цвет. Если при отсасывании получают воздух, значит, зонд находится еще в желудке. В сомнительных случаях можно провести пробу с метиленовым синим либо ультразвуковой или рентгенологический контроль. Как правило, дуоденальное зондирование по этой методике занимает 10-15 мин.
В качестве питательной смеси обычно используют грудное молоко. Возможно применение адаптированных формул («Фрисопре», «Нан», «Нутрилон», «Альфаре» и др.). Элементную смесь, составленную из препаратов для парентерального питания (10% аминона, 20% Липофундина♠, 40% Глюкозы♠, растворенных в дистиллированной воде), используют крайне редко.
Таблица 6.21. Размеры зонда и наконечника (Rhea J. et al., 1973)
Масса тела |
Длина зонда, |
Размеры зонда |
Наконечник |
|
|
||
ребенка, кг |
вводимого через |
внутренний |
внешний |
головка, мм тело, мм |
|
||
|
нос, см |
диаметр, |
диаметр, |
диаметрдлинадиаметрдлина |
|
||
|
|
мм |
|
|
|
|
|
|
|
мм |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
13-21 |
0,81 |
1,41 |
2,2 |
3,6 |
1,6 |
3,6 |
1-2 |
21-26 |
0,81 |
1,41 |
2,5 |
4,5 |
1,6 |
4,5 |
2,5-3,5 |
23-24 |
1 |
1,65 |
3,0 |
5,0 |
1,8 |
5 |
4,0-5,0 |
30-40 |
1 |
1,65 |
3,5 |
5,0 |
1,8 |
5 |
Методика. Суточный и разовый объем пищи обычно определяют по энергетической ценности или по формуле Н.Ф. Филатова в модификации Г.И. Зайцевой [суточное количество молока равно 2% массы тела (г) при рождении, умноженным на число дней жизни]. Однако в условиях интенсивной терапии, когда чаще используют сочетанное питание, целесообразно общий объем вводимых жидкостей (энтерально и парентерально) рассчитывать по минимальным суточным потребностям в воде.
При проведении зондового питания различают три основных этапа: начальный (адаптационный) этап, этап полного (сбалансированного) питания и этап отмены. Задачей I этапа является выбор оптимального режима и способа зон-дового питания и подбор адекватного состава питательной смеси, исходя из толерантности желудочно-кишечного тракта. На II этапе проводится полное питание в объеме, который обеспечивает стабильную прибавку массы тела. На III этапе осуществляется постепенный перевод больного на естественный режим вскармливания.
На схеме 6.1 приведен алгоритм зондового питания у критически больных новорожденных, который в течение ряда лет используют в Санкт-Петербургском центре патологии новорожденных.
Начальный этап: I. Адаптация к объему питания (определение моторно-эвакуаторной толерантности желудочно-кишечного тракта).
1.Начинают гастрально дробно - 7-8 раз в сутки (3-часовые промежутки с ночным перерывом или без него) грудным молоком.
2.Дети с массой тела менее 1000 г, как правило, лучше переносят непрерывное кормление при помощи инфузионного насоса, чем дробное питание, начинают инфузию со скоростью 0,5-1 мл/кг в час.
3.Объем первых 2-3 кормлений определяется исходной массой тела ребенка: менее 2,5 кг - 1-2 мл/кг; 2,5-3,5 кг - 5-10 мл; более 3,5 кг - 10-15 мл (или 3 мл/кг).
4.При хорошей моторно-эвакуаторной функции верхних отделов желудочно-кишечного тракта (отсутствие срыгивания, застоя пищи и вздутия живота) увеличивают объем питания до 2-5 мл каждые 6 ч (через два кормления) до достижения объема, равного физиологическим потребностям новорожденного в воде.
5.В процессе увеличения энтерального объема недостающие ингредиенты (жидкость, электролиты, белки, углеводы) вводят внутривенно, хотя калории и пищевые ингредиенты в этот период принципиального значения не имеют.
6.При появлении признаков замедленного опорожнения верхних отделов желудочнокишечного тракта (срыгивание, застой пищи в желудке 10 мл и более, вздутие живота) дробное кормление заменяют непрерывным (капельным или при помощи инфузионного насоса), оставляя объем и темп увеличения объема (по 10 мл каждые 6 ч) прежним.
7.Одновременно по показаниям назначают медикаментозную (0,05% прозе-рин - 0,05-0,1 мл 1-3 раза в сутки, Мотилиум♠ - 0,5-1 мг/кг 2-3 раза в сутки,
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
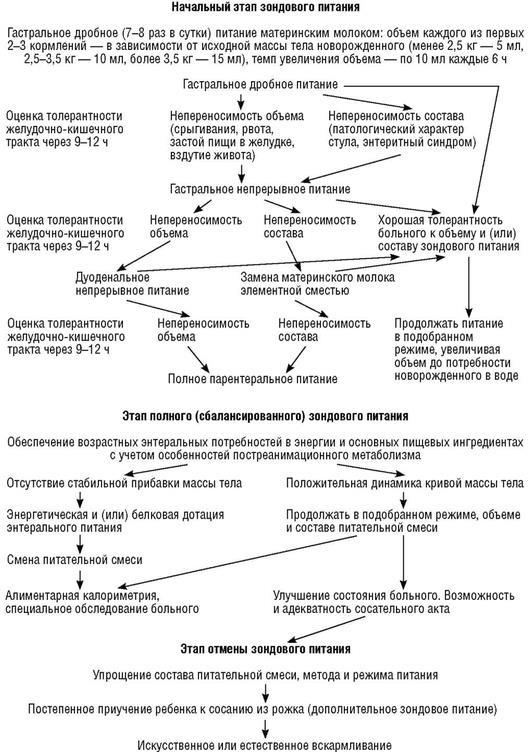
Схема 6.1. Алгоритм зондового питания критически больных новорожденных (Любшис А.К., 1987)
кальция пантотенат - 25 мг 4 раза в сутки, калия хлорид и др.), физиотерапевтическую (лекарственный электрофорез, импульсные токи и др.) и механическую (газоотводная трубка, клизма) стимуляцию деятельности кишечника.
8. При сохраняющихся признаках дисфункции желудочно-кишечного тракта в течение 12 ч переводят больного на непрерывное дуоденальное питание. Суточный объем и темп увеличения энтерального объема - как при предыдущем режиме питания.
9. Если на фоне указанных мероприятий в течение 12 ч сохраняются явления дисфункции кишечника, следует провести «разгрузку» энтерального питания, т. е. начинать непрерывное дуоденальное питание минимальным объемом (как в самом начале зондового питания), сочетая его с парентеральным. Возможен перевод больного на полное парентеральное питание в течение нескольких суток.
II. Определение переваривающей способности (толерантности к грудному молоку)
желудочно-кишечного тракта проводят одновременно с определением толерантности к объему.
1.Критериями адекватности переваривающей способности ЖКТ являются частота и характер стула, данные копрологического исследования.
2.При появлении признаков непереваривания грудного молока или энтеритного синдрома (патологические изменения в копрограмме, частый, жидкий, с примесью слизи стул) дробное кормление следует заменить непрерывным.
3.При положительной динамике суточный объем питания и темп увеличения объема - по схеме.
4.Сохраняющиеся указанные нарушения служат показателем для «разгрузки» энтерального питания на 1-2 сут с переводом больного на сочетанное или полное парентеральное питание.
5.Повторное увеличение объема зондового питания элементной смесью с грудным молоком (соотношение 1:1) или только элементной смесью начинают по исходной схеме, постепенно снижая долю парентерального.
Этап полного (сбалансированного) зондового питания начинается после достижения желательного объема энтеральной нагрузки (грудного молока) и полной отмены парентерального питания. Это этап обеспечения возрастных суточных потребностей больного в жидкости, энергетической ценности, основных пищевых ингредиентах, электролитах и других исключительно энтеральным путем.
1.Основная задача этого этапа - увеличение массы тела.
2.При отсутствии стабильной прибавки массы следует увеличить объем питания до 160-
200мл/кг в сутки. Белковая нагрузка должна составлять 3,0- 3,5 г/кг в сутки.
3.Если масса тела не увеличивается на фоне увеличения объема и белковой нагрузки, необходимо более тщательно обследовать больного (определить азотистый баланс, провести биохимическое исследование кала и др.) или сменить питательную смесь.
Этап отмены зондового питания
1.Критериями отмены являются: улучшение общего состояния больного, положительная динамика массы тела, нормальный характер и частота стула, адекватный сосательный рефлекс.
2.Отмену проводят постепенно: переводят больного на более простой режим и способ питания: капельное - на дробное, дуоденальное - на гастраль-ное, гастральное - на естественное вскармливание.
3.К сосанию ребенка «приучают» постепенно, увеличивая объем разового кормления из рожка и уменьшая объем разового зондового питания через постоянный (тонкий) назогастральный зонд.
С самого начала зондового питания необходимо заселять кишечник новорожденного бифидумили лактофлорой (бифидумили лактобактерин по 2-3 дозы 3 раза в сутки) в связи
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
с тем, что почти у всех тяжелобольных новорожденных имеется дисбактериоз кишечника (особенно на фоне антибактериальной терапии).
Основные трудности применения смеси у новорожденных детей связаны с ее высокой осмолярностью, которая может быть причиной таких осложнений, как диарея и язвеннонекротический энтероколит. Для того чтобы адаптировать желудочно-кишечный тракт новорожденного к высокоосмолярной элементной смеси, приходится вначале ее разводить водой, чтобы осмоляр-ность не превышала 300 ммоль/л. Однако при этом утрачивается ее питательная ценность. И поэтому в некоторых случаях (при сохранении анатомической целостности желудка и кишки) элементную смесь целесообразно «разводить» грудным молоком: это сохраняет ее энергетическую ценность и одновременно функционально «разгружает» пищеварительную систему новорожденного.
Методика питания элементной смесью:
1)начинают с 25-50% исходной концентрации смеси (в зависимости от ее осмолярности) в непрерывном режиме, по возможности - гастрально, и ее объем доводят до суточных потребностей новорожденного в воде;
2)постепенно (в течение 3-5 сут) увеличивают концентрацию смеси до 2,9-4,2 кДж/мл (0,7-1 ккал/мл);
3)нежелательно одновременно увеличивать объем и концентрацию смеси, чтобы знать, от чего произошел «срыв» у больного;
4)если больной плохо переносит увеличение объема или концентрации элементной смеси, необходимо вернуться к тому уровню, к которому он толерантен.
Исследования, проведенные в Ленинградском центре патологии новорожденных ДГБ № 1 (Любшис А.К., 1987), показали, что при проведении полного зондового питания тяжелобольным доношенным новорожденным необходимо обеспечить как минимум в конце первой недели жизни 355 кДж/кг (85 ккал/кг) в сутки энергии и 2,1 г/кг в сутки белка; в конце 2-й недели - 520 кДж/кг (125 ккал/кг) в сутки энергии и 2,6 г/кг в сутки белка; с 3-й недели - 520 кДж/кг в сутки энергии и 2,9 г/кг в сутки белка.
Контроль питания. Адекватность различных режимов зондового питания определяют в повседневной практике по такому рутинному показателю, как кривая нарастания массы тела ребенка (по таблице Фентон), причем оптимально использовать для этого двух-, трехдневный интервал времени, при котором нивелируются случайные колебания массы тела, обусловленные отхо-ждением кала и мочеиспусканием. Отсутствие отеков и олигурии на фоне стабильной прибавки массы тела в сочетании с увеличением толщины кожной складки и ростом новорожденного указывают на адекватность питания. Из биохимических анализов наиболее приемлемо определение альбумина в плазме крови. Снижение уровня альбумина, как правило, указывает на белково-энер-гетическую недостаточность питания и требует его коррекции.
О функциональном состоянии пищеварения судят по количеству, частоте, цвету, запаху и консистенции кала, по копрограмме, которую необходимо делать не реже 1 раза в неделю, а также в случае смены питательной смеси и режима питания.
При появлении энтеритного синдрома, помимо копрологического исследования, необходимо провести посев кала на условно-патогенную микрофлору. Следует начать терапию бифидумпрепаратами.
Специальные исследования показаны при плохой толерантности желудочно-кишечного тракта к энтеральной нагрузке и отсутствии прибавки массы тела на фоне адекватного возрасту объема пищи. В этих ситуациях необходимо определить такие показатели как
содержание азота в суточной моче, состав метаболизирующей смеси, биохимический анализ кала и др.
Осложнения
1. Механические - обусловлены свойствами и положением зонда. При длительном нахождении в желудке (кишечнике) поливинилхлоридного зонда его механические свойства могут существенно нарушаться. Он становится жестким и может травмировать стенки желудка или кишечника (вплоть до перфорации). Однако эти осложнения крайне редки, и их можно избежать, меняя зонд каждые 3-5 дней.
Чаще происходит смещение дуоденального зонда в желудок при различных манипуляциях с ребенком (интубация, люмбальная пункция), в связи с чем необходимо контролировать положение дуоденального катетера.
2. Желудочно-кишечные, обусловленные объемом и характером смеси. При гастральном способе питания, особенно в дробном режиме, часто наблюдаются рвота и срыгивание пищи, что грозит аспирацией пищевых масс. Это осложнение можно предотвратить, укладывая ребенка на правый бок или живот, так как при этом меняется положение газового пузыря в желудке. Переход на непрерывный режим питания и применение препаратов, нормализующих эвакуаторную функцию желудка, также предупреждают подобные осложнения.
При дуоденальном питании чаще, чем при гастральном, может развиться язвеннонекротический энтероколит или понос, обусловленный чрезмерной моторикой кишечника. В последнем случае показан переход на непрерывный режим, а
при первом осложнении необходимо прекратить зондовое питание, удалить зонд и перейти на парентеральное питание.
Метаболические осложнения встречаются крайне редко и могут возникать при поражениях печени и почек (острая печеночная и почечная недостаточность), обусловленных основной патологией.
Лечебные формулы (смеси), применяемые по показаниям. Лактазная недостаточность и галактоземия: «Нутрилон низколактозный» (Голландия), АЛ-110 (Швейцария), «Лактофидус» (Франция; содержит и лактозу, и лактазу); смеси на соевой основе - «Фитолакт» (Россия, Москва), «Беллакт-соя» (Белоруссия), «Прособи» (США), «Хайнцсоя» (США), «Пулева-соя» (Испания), «Симилак-Изомил» (США), «Бона-соя» (Финляндия), «Алсой» (Швейцария), «Нутрии-соя» (Голландия), «Фрисосой» (Голландия), «Соял» (Индия), Соевое молоко и бифилин на сое (Россия, С.-
Петербург); формулы (смеси) на основе гидролизатов белка: «Альфаре» (Швейцария), «Нутрилон Пепти-ТCЦ», «Нутримиген» (США), «Прегестимил» (США), «Алиментум» (США), «Прегомил» (ФРГ), «Пепти-Юни-ор» (Голландия), «Фрисопеп» (Голландия).
Фенилкетонурия: «Фенил-фри» (США), «Лофеналак» (США), «Берлофен» (ФРГ), «Нофемикс» (Польша), «Нофелан» (Польша).
Непереносимость белка коровьего молока: вышеперечисленные смеси на соевой основе, смеси, приготовленные из гидролизатов белка.
Муковисцидоз: МСТ-Oil, «Портаген» (США; обе смеси содержат средне-цепочечные жиры), «Прегестимил» (США; на основе гидролизата казеина), «Альфаре» (Швейцария; на основе гидролизатов белков, содержит среднецепо-чечные жиры).
6.9. ИНФУЗИОННАЯ ТЕРАПИЯ И ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ
Инфузионная терапия. Инфузионная терапия - комплекс лечебных мероприятий, направленных на сохранение параметров гомеостаза (водно-электролитного и кислотно-
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
основного баланса, сердечно-сосудистой системы и др.) организма и коррекцию его нарушений.
Показания к проведению инфузионной терапии у новорожденных:
1)выраженные нарушения гемодинамики - артериальная гипотензия, ги-поволемия, а также обезвоживание, электролитные расстройства;
2)состояния, сопровождающиеся полиорганной недостаточностью (тяжелые асфиксия, сепсис, ДВС-синдром, острые надпочечниковая и почечная недостаточность, декомпенсированная сердечная недостаточность и др.);
3)состояния, сопровождающиеся нарушенной толерантностью к энтераль-ной нагрузке (хирургическая патология и мальабсорбция ЖКТ, кишечные инфекции);
4)незрелость органов и систем регуляции метаболизма, водно-электролитного баланса у недоношенных детей с ЭНМТ и нередко с ОНМТ.
Таблица 6.22. Соотношение площади поверхности тела и массы у новорожденных
(Baumgart S., Chandras S., 2012)
Масса тела |
Поверхность |
Отношение поверхность тела, м2/ |
|
тела, м2 |
масса тела, кг |
Взрослый, 70 кг |
1,73 |
0,0250 |
|
|
|
Недоношенный с массой |
0,13 |
0,0870 |
тела 1500 г |
|
|
Недоношенный с массой |
0,07 |
0,140 |
тела 500 г |
|
|
Естественно, что инфузионную терапию следует рассматривать как экстренное поддержание гемодинамики и гомеостаза, обеспечение парентерального и этап до введения энтерального питания.
При проведении инфузионной терапии необходимо учитывать следующие анатомофизиологические особенности новорожденного:
•новорожденные в связи с низкой способностью к концентрации мочи очень чувствительны к уменьшению объема поступающей жидкости;
•характерное для новорожденных большее отношение площади поверхности тела и респираторного тракта к массе тела (табл. 6.22);
•тонкая и богато васкуляризированная кожа, высокое содержание воды на единицу массы тела при частом дыхании обусловливают значительный уровень «неощутимых» потерь жидкости, вызванных испарением ее с поверхности тела и дыхательных путей;
•почки новорожденного не способны быстро ответить на резкое увеличение водной нагрузки немедленным выведением избытка внеклеточной жидкости;
•клиренс свободной воды может быть снижен в связи с повышением секреции антидиуретического гормона при интранатальной асфиксии, внут-рижелудочковом кровоизлиянии, синдроме дыхательных расстройств, проведении ИВЛ, пневмотораксе; его уровень тем выше, чем тяжелее состояние ребенка при рождении;
•для новорожденных, особенно недоношенных, характерна низкая способность к выведению избытка натрия при перегрузке;
•для новорожденных характерен более высокий уровень калия плазмы крови в первые трое суток жизни, чем в дальнейшем, но и способность к экскреции данного электролита тоже низкая.
При проведении инфузионной терапии у новорожденных необходимо руководствоваться следующими принципами:
1)не столько объем жидкости (см. табл. 6.28-6.30), сколько скорость ее поступления является основным фактором, определяющим адекватность инфузионной терапии;
2)необходимость постепенности (поэтапности) увеличения водной нагрузки и введения в
состав инфузионной программы новых компонентов с учетом индивидуальных особенностей постнатального созревания функции сердечно-сосудистой системы, почек или их восстановления при патологических состояниях;
3)необходимость проведения клинико-лабораторного контроля водно-электролитного баланса, кислотно-основного состояния для оценки адекватности инфузионной программы.
Факторы, определяющие потребности в жидкости у новорожденного
1.«Неощутимые» потери жидкости, обусловленные испарением с поверхности тела и дыхательных путей. Величина этих потерь обратно пропорциональна массе тела при рождении и гестационному возрасту. Как уже указывалось, примерно 30% «неощутимых» потерь происходит в дыхательных путях и 70% - путем испарения с кожи. Хотя у новорожденных количество потовых желез в 6 раз больше, чем у взрослого, максимальная потовая реакция в ответ на тепловую стимуляцию у них составляет лишь 1/3 таковой у взрослых.
2.Потери жидкости со стулом составляют 5-10 мл/кг в сутки. В первые дни жизни они обычно не учитываются, так как потери жидкости с меконием незначительны.
3.Безопасный для новорожденного объем диуреза определяется пределами концентрационной способности почек. Осмолярность мочи около 300 мосмоль/л близка к среднему уровню, который могут продуцировать почки новорожденного, и является показателем безопасной водной нагрузки. Таким образом, осмолярность, в том числе и мочи, является лабораторным показателем, требующим контроля.
4.Патологические потери жидкости и электролитов: с желудочным содержимым при срыгивании, со стулом при диарее, ликворея при ее наличии, кровотечения, «хирургические потери» из ран, дренажей и т. д.
У новорожденных выделяют три периода, в каждом из которых объем вводимой жидкости различен.
Первый период (1-2-е сутки жизни) может быть назван переходным. Он характеризуется большими потерями жидкости за счет испарения и выведения значительного объема внутриклеточной жидкости и электролитов почками. В этот период расчет объема инфузионной терапии у доношенных детей определяется следующими обстоятельствами: в первые двое суток жизни почки доношенного новорожденного,
получающего внутривенно жидкость и электролиты, должны экскретировать около 15 мосм/кг в сутки (Папаян А.В., Стяжкина И.С., 2002), объем диуреза 5 мл/кг в сутки и неощутимые потери воды 20 мл/кг в сутки обусловливают потребность в жидкости, равную 70 мл/кг в сутки. При этом расчете пренебрегают потерей жидкости со стулом и задержкой воды в тканях. С учетом отрицательного водного баланса 5-10 мл/кг в сутки истинная потребность в воде составляет 60-65 мл/кг в сутки.
Естественно, что у недоношенных детей, имеющих большие «неощутимые» потери воды, потребность в жидкости больше. В течение первых дней жизни у недоношенных детей с ОНМТ экскреторная возможность почек мала и составляет 8 мосм/кг в сутки. Для экскреции почками при осмоляльности мочи, равной 300 мосм/л, достаточен диурез 40-50
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
мл/кг в сутки. Таким образом, недоношенные дети с массой тела менее 1500 г требуют 100-160 мл/кг в сутки жидкости в 1-2-е сутки жизни.
У новорожденных, особенно недоношенных, должен осуществляться тщательный контроль водно-электролитного баланса, поскольку выраженные последствия перегрузки жидкостью трудно исправимы.
С увеличением постнатального возраста и началом энтерального питания повышается экскреция электролитов почками и потери воды со стулом, начинается задержка воды в новых тканях, поэтому с 3-4-х суток жизни потребность в жидкости увеличивается.
Второй период характеризуется стабилизацией. Уменьшаются потери жидкости испарением за счет кератинизации кожного покрова. В этот период обычно производят осторожное введение и/или расширение энтеральной нагрузки и компонентов парентерального питания. Начинается положительная динамика массы тела.
Третий период (стабильного роста) начинается со 2-3-й недели жизни. В этот период потребность в жидкости и электролитах у детей различного ге-стационного возраста одинакова.
Обращаем внимание, что при проведении инфузионной терапии должен осуществляться клинико-лабораторный контроль:
1)массы тела (2 раза в сутки);
2)количества поступивших всеми путями жидкости и электролитов;
3)потерь жидкости с диурезом и стулом;
4)уровня глюкозы, электролитов плазмы крови;
5)уровня креатинина и мочевины плазмы крови;
6)патологических потерь воды и электролитов (желудочный застой, срыги-вания, диарея; дренажи и т. д.);
7)функции почек (относительная плотность и осмоляльность мочи).
Инфузионная терапия у недоношенных с ОНМТ и ЭНМТ. Европейский консенсус по трактовке и тактике ведения недоношенных с респираторным дистресс-синдромом (2013) пришел к следующим заключениям по поводу стартовой жидкостной и инотропной терапии недоношенным детям с синдромом дыхательных расстройств (СДР, РДС):
«Лучистый источник тепла может быть использован для начальной стабилизации ребенка в родильной комнате и транспортировки его в отделение интенсивной терапии. Однако при сравнении с помещенными в инкубатор у таких детей повышены неощутимые потери воды, даже если тепловые экраны использованы. Длительность пребывания под лучистым источником тепла должна быть минимальной.
Помещение недоношенных детей в инкубатор с сервоконтролем, поддерживающим температуру кожи на уровне 36,5 °C, приводит к достоверному снижению смертности. Недоношенные дети должны выхаживаться в инкубаторах (ку-везах) с высокой относительной влажностью (60-80%), что снижает неощутимые потери воды, хотя в разных центрах правила несколько различаются. Контакт с матерью "кожа к коже" или метод кенгуру используют как метод поддержания температуры тела, так же как контакт мать-ребенок, даже у детей на ИВЛ.
В большинстве протоколов (рекомендаций) подчеркивается, что жидкостная нагрузка в первые дни жизни должна быть индивидуализирована в зависимости от жидкостного баланса, динамики массы тела и уровня электролитов крови. Наи-

большие ограничения нагрузки жидкостью приводят к большей первоначальной (физиологической) потере массы тела, но имеют позитивный эффект на ОАП, частоту некротических энтероколитов (НЭК). Нет доказательств, поддерживающих использование диуретиков при СДР. Постнатальная потеря массы тела (физиологическая) отмечается у всех детей и на нее влияет питательная поддержка.
Интенсивное питание должно быть начато с рождения, оно снижает как первоначальную потерю массы тела, так и задержки прибавки массы тела в дальнейшем. В начале энтеральные нагрузки должны быть ограничены, но ну-триенты должны поступать парентерально для того, чтобы обеспечить доставку энергии, а аминокислоты для предотвращения отрицательного азотистого баланса, повышения синтеза белков и задержки азота. Как можно раньше должно быть начато минимальное ?трофическое? питание грудным молоком в дозе 10-20 мл/кг в сутки, что способствует созреванию функции желудочно-кишечного тракта. Кокрановские обзоры показывают, что ?трофическое? питание не повышает риск развития НЭК, но ускоряет переход к
достижению нормальных объемов питания. Если у матери нет молока, то питание донорским грудным молоком, по сравнению с питанием смесями, уменьшает риск НЭК». В консенсусе подчеркнуто, что рекомендации даны с позиций доказательной медицины
(табл. 6.23).
Таблица 6.23. Уровень доказательности и качества (надежности) рекомендаций
Уровень доказательности результатов клинических исследований
1++Высококачественные метаанализы, системные обзоры рандомизированных клинических исследований (РКИ) или РКИ с очень низким риском необъективности (пристрастий)
1+ Хорошо контролируемые метаанализы или системные обзоры РКИ с низким риском необъективности
1- Метаанализы, системные обзоры РКИ с высоким риском необъективности
2++Высококачественные системные обзоры РКИ рандомизированных контролируемых или когортных исследований.
Высококачественные контролируемые или когортные исследования с очень низким риском неоднозначных сведений
2+ Высококачественные контролируемые или когортные исследования с низким риском неоднозначных сведений
2- Высококачественные контролируемые или когортные исследования с высоким риском неоднозначных сведений
3Неанализированные описания, результаты исследования типа сравнительного и описание отдельных клинических случаев
4Мнение экспертов
Степень качества (надежности) рекомендаций c учетом дальнейших последствий: GRADE (Grading of recommendations assessment, development and evaluation)
А По крайней мере, один метаанализ, системные обзоры или РКИ уровня 1++ и непосредственно относящиеся к целевой популяции, или группа доказательств, непосредственно относящихся к группе 1+, прямо применимых к целевой популяции и демонстрирующих постоянные результаты
Окончание табл. 6.23
Степень качества (надежности) рекомендаций c учетом дальнейших последствий: GRADE (Grading of recommendations assessment, development and evaluation)
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
