
6 курс / Медицинская реабилитация, ЛФК, Спортивная медицина / Национальное_руководство_по_паллиативной_медицинской_помощи_в_онкологии
.pdf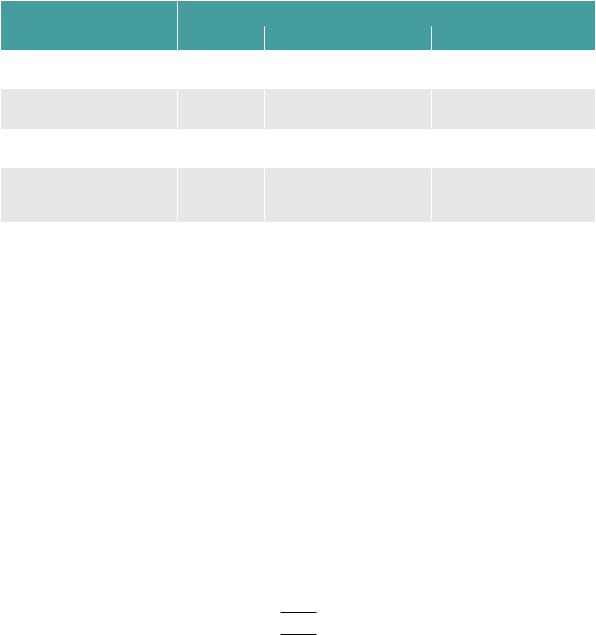
ния при гепатоцеллюлярном раке определяется не только стадией заболевания – размером и локализацией опухоли, поражением лимфатических узлов и наличием отдаленных метастазов, то есть классификацией TNM, но и состоянием печеночной паренхимы, то есть выраженностью гепатита/цирроза печени. Если при наличии резектабельной опухоли определяется циркуляция вирусной РНК в крови пациента, то в первую очередь проводится противовирусная терапия. Рассмотрение вопроса о хирургических методах лечения, даже паллиативных, возможно только при отрицательной ПЦР. При наличии цирроза определяется его степень по классификации Чайльд-Пью (табл.). Она используется для оценки состояния больного с определением возможности операции, прогноза выживаемости и продолжительности жизни.
Таблица. Параметры оценки степени цирроза по Чайльд-Пью
Оцениваемые параметры |
Число баллов, в зависимости от значения параметра |
|||
1 балл |
2 балла |
3 балла |
||
|
||||
|
|
|
|
|
асцит |
отсутствует |
мягкий, легко |
напряженный, плохо |
|
поддается лечению |
контролируемый |
|||
|
|
|||
|
|
|
|
|
общий билирубин |
<34 (<2) |
34–50 (2–3) |
>50 (>3) |
|
плазмы, мкмоль/л (мг/дл) |
||||
|
|
|
||
|
|
|
|
|
альбумин плазмы крови, |
>3,5 |
2,8–3,5 |
<2,8 |
|
г/л |
||||
|
|
|
||
|
|
|
|
|
печеночная |
|
степень I–II (легкая, |
степень III–IV (тяжелая, |
|
отсутствует |
терапевтически |
|||
энцефалопатия |
плохо контролируемая) |
|||
|
контролируемая) |
|||
|
|
|
||
|
|
|
|
|
протромбиновый индекс |
>60 |
40–60 |
<40 |
|
(ПТИ), % |
|
|
|
|
или |
или |
или |
или |
|
протромбиновое время |
|
|
|
|
(ПТВ), с |
1–4 |
4–6 |
>6 |
|
или |
или |
или |
или |
|
международное |
||||
нормализованное |
|
|
|
|
отношение (МНО) |
<1,70 |
1,71–2,20 |
>2,20 |
|
|
|
|
|
|
Данная система является ориентировочной и не учитывает многие другие параметры состояния больного, например, варикозное расширение вен пищевода. Изменения уровней билирубина, альбумина, показателей гемостаза оцениваются в баллах, тяжесть асцита определяется пальпаторно и по эффективности действия диуретиков, выраженность энцефалопатии определяется по шкале West-Haven. Полученные баллы суммируются.
Класс А – 5–6 баллов — компенсированная стадия; выживаемость после трансплантации — 90%.
Класс В – 7–9 баллов — субкомпенсированная стадия; выживаемость после трансплантации 70%.
Класс С – 10–15 баллов — декомпенсация; выживаемость после трансплантации 18–19%. При циррозе класса С невозможно никакое интервенционное воздействие, при В рассматривается вопрос о проведении малоинвазивных вмешательств. При циррозе, оценен-
180

ном в 5–6 баллов, возможно выполнение резекционных технологий, но с обсуждением объема в каждом конкретном случае. Возможность и эффективность трансплантации печени зависят не только от выраженности фиброза паренхимы. Она крайне сомнительна при классе С и бессмысленна при экстраорганных проявлениях рака печени, например, поражении регионарных лимфоузлов.
МЕТАСТАТИЧЕСКОЕ ПОРАЖЕНИЕ ПЕЧЕНИ
При выработке лечебной тактики у больных с метастатическим поражением печени приходится исходить из того, что это уже IV стадия процесса. Понятно, что паллиативные лечебные методики применяются в случае изолированного ее поражения. Однако это не исключает развития других вариантов прогрессирования в процессе лечения – перитонеальной диссеминации, гематогенных метастазов в легкие, кости, головной мозг, лимфогенное распространение опухолевых клеток. Поэтому при применении локальных методов лечения образований в печени должно проводиться комплексное обследование, чтобы вовремя вернуться к системному паллиативному или симптоматическому лечению.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
Основными симптомами опухолевого поражения печени при запущенных формах, когда возможно только паллиативное лечение, являются:
Желтуха
Как правило, она носит смешанный характер. Патогенез ее связан с развитием билиарной гипертензии за счет сдавления внутрипеченочных протоков первичной опухолью или метастазами. Другой причиной может быть компрессия долевых протоков или гепатикохоледоха пораженными лимфоузлами ворот печени или гепатодуоденальной связки. Причем этот вариант возможен как при первичной карциноме печени – эти лимфоузлы являются региональными N1, так и при отдаленных метастазах колоректального рака – М1. По мере поражения паренхимы печени присоединяется второй механизм гипербилирубинемии – нарушение функции гепатоцитов и уменьшение их количества, а также замещение функционирующей паренхимы соединительной тканью при циррозе.
Портальная гипертензия
Синдром портальной гипертензии – это симптомокомплекс, возникающий при повышении давления в системе воротной вены. Фатальным осложнением портальной гипертензии является кровотечение из варикозно-расширенных вен пищевода и желудка. Кроме того, она является причиной развития асцита и печеночной энцефалопатии. В зависимости от уровня нарушения кровотока выделяют подпеченочный блок, внутрипеченочный и надпеченочный. Подпеченочным блоком называют нарушение кровотока в воротной вене до ее впадения в ворота печени. Причиной такого блока может являться опухолевый тромбоз или стеноз воротной вены, ее сдавление метастатически пораженными лимфоузлами ворот печени или опухолью. Внутрипеченочный блок развивается, как правило, при циррозе печени. При этом происходит сдавление фиброзом мелких синусоидных капилляров паренхимы, что значительно увеличивает периферическое сосудистое сопро-
181
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

тивление. Лечение синдрома портальной гипертензии направлено как на устранение самой причины заболевания, так и на уменьшение риска желудочно-кишечного кровотечения.
Болевой синдром
Болевой синдром при опухолях печени не является ведущим и манифистирует уже на некурабельных стадиях заболевания. В паренхиме практически отсутствуют нервные окончания и болевые рецепторы. Именно поэтому на начальных стадиях злокачественные новообразования протекают бессимптомно. Выраженная болезненность наступает при растяжении Глиссоновой капсулы, которая окутывает печень с трех сторон и является производным из висцерального листка брюшины, богатой нервными окончаниями, или при нарушении оттока желчи из внутрипеченочных протоков — состояние, описываемое как печеночная колика.
Опухолевая интоксикация
Так же как и при других локализациях, интоксикация прогрессирует по мере увеличения размеров и количества опухолевых узлов. Детерминирована потреблением новообразованием питательных веществ и кислорода, распадом и выбросом в кровеносное русло калия, мочевой и молочной кислоты, фосфатов, снижением уровня кальция.
Хирургические методы лечения:
●радикальные;
●циторедуктивные;
●паллиативные;
●противоопухолевые.
Устранение осложнений
Единственным методом радикального лечения злокачественных опухолей печени остается хирургический, обеспечивающий длительную выживаемость при комфортном уровне жизни. Однако неудовлетворительная функция печени, билобарное распространение процесса, внепеченочное метастазирование при первичном раке позволяют провести радикальное лечение лишь в 10–20% случаев. При метастатическом поражении печени оперативное вмешательство на первом этапе возможно не более чем у 10–15% больных, с применением периоперационной химиотерапии и использованием двухэтапных резекций у 30–35%. В случае полного удаления первичной опухоли печени с регионарным лимфатическим коллектором можно говорить о радикальном хирургическом вмешательстве. Операции у больных с метастазами в печень, учитывая IV стадию заболевания, даже в случае R0 резекции следует все-таки рассматривать как циторедуктивные. Все остальные инвазивные операции носят паллиативный характер. Из них можно выделить методики, направленные на устранение осложнений и собственно противоопухолевые вмешательства.
ПАЛЛИАТИВНЫЕ ИНВАЗИВНЫЕ МЕТОДЫ ЛЕЧЕНИЯ
Основными методами хирургического лечения опухолевых поражений печени при невозможности выполнения радикальных резекционных вмешательств являются малоинвазивные методики, такие как абляция опухолевых узлов и регионарная лучевая и химиотерапия — химиоэмболизация печеночной артерии (ХЭПА) и воротной вены (ХЭВВ), химиоинфузия в печеночную артерию (ХИПА), радиоэмболизация. Длительная экспозиция препарата за счет внутриартериальных инфузий или создание депо препарата при химиоэмболизации артерий
182

значительно повышает его концентрацию в опухоли без выраженного системного влияния. В настоящее время показана эффективность комбинированного применения данных методов, что позволяет осуществлять эффективное лечение опухолевых узлов размером до 8 см.
АБЛЯЦИОННЫЕ МЕТОДИКИ
Основным механизмом противоопухолевого воздействия этих методик является разрушение клеток под действием высокой или, наоборот, низкой температуры, что морфологически выражается в некрозе опухоли с минимальным повреждением здоровых тканей. С физической точки зрения выделяют следующие виды локального воздействия:
●радиочастотная термоабляция;
●микроволновая абляция;
●СВЧ-абляция;
●лазерная абляция;
●криодеструкция.
Основными показаниями к применению этих методов являются:
●наличие опухолевого поражения печени при имеющихся противопоказаниях к резекции (рецидивная опухоль, печеночная недостаточность, тяжелые соматические заболевания, отказ пациента от резекции);
●целесообразность выполнения циторедуктивного воздействия на очаги, оставшиеся после резекции печени;
●целесообразность малоинвазивного противоопухолевого воздействия в периоде ожидания ортотопической трансплантации печени;
●диаметр образований не более 3 см и количеством не более 3.
Полнота деструкции опухолевых очагов зависит от условий интраоперационной визуализации, техники пункции и местных анатомических особенностей (наличие крупных сосудов вблизи очагов, близость к диафрагме). Использование комбинации РЧА с методиками регионарной химиотерапии (ХЭПА, ХИПА) при олигометастазах позволяет повысить эффективность радиочастотной абляции с 61% при первом воздействии на опухолевый очаг до 83% за счет комбинации ишемического и гипертермического воздействия на опухоль. РЧА является относительно безопасным методом локального противоопухолевого воздействия, при использовании которого частота серьезных осложнений не превышает 5%. Применение радиочастотной абляции повышает выживаемость неоперабельных больных в рамках паллиативного лечения. В исследовании E. Brerber et al. у пациентов, которым проводилась радиочастотная абляция с адъювантной химиотерапией, было выявлено увеличение продолжительности жизни в сравнении с больными, которые получали только лекарственное лечение. При этом в исходе радиочастотной абляции наблюдалось снижение уровня ракового эмбрионального антигена и α-фетопротеина, что является благоприятным прогностическим фактором и может использоваться как маркер успешности лечения. В оценке эффективности РЧА приоритетными методами визуализации являются ПЭТ–ФДГ и МСКТ с внутривенным усилением. Частота достоверной оценки полноты деструкции опухоли после выполнения РЧА, по данным ПЭТ–ФДГ, составляет 95%, при МСКТ с контрастированием она достигает 89%. Определение уровня онкомаркеров в крови, УЗИ, игольная трепан-биопсия опухоли с морфологической оценкой имеют вспомогательное значение. Использование абляции в комбинированном лечении позволяет добиться результатов 1, 2-летней выживаемости больных с метастазами КРР 100% и 67,7% соответственно. При
183
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

гепатоцеллюлярной карциноме на фоне цирроза печени РЧА может продлить период в листе ожидания трансплантации без прогрессирования опухоли в сроки до 9 мес. Локализация очага в непосредственной близости от крупных желчных протоков может сопровождаться термическим повреждением их стенки или полых органов во время РЧ-воздействия, но не является абсолютным противопоказанием к РЧА. Оценка результатов РЧА целесообразна через 1 мес. после операции, так как в более ранние сроки увеличение размеров опухолевого узла по данным методов визуализации, накопление контрастного препарата или изотопного препарата могут быть обусловлены наличием перифокальной зоны воспалительных изменений в месте абляции. Критериями эффективной РЧА служат формирование кон- траст-негативной зоны по данным МСКТ, отсутствие накопления РФП с формированием аметаболической зоны в месте деструкции по данным ПЭТ-ФДГ. Выявление признаков резидуальной опухоли после РЧА является показанием для проведения повторных сеансов. Криодеструкция — прямое воздействие жидкого азота, охлаждающего ткани до температуры минус 180°С. Непосредственное охлаждение опухоли с помощью специального устройства вызывает гибель клеток, а в окружении опухоли формируются микрососудистые тромбы, которые усугубляют повреждение за счет дополнительного нарушения ее питания.
Показания к применению криоабляции при первичном и метастатическом раке печени:
●невозможность радикального оперативного лечения, нерезектабельные опухоли;
●единичные опухоли диаметром до 4 см, множественные до 3 см;
●противопоказания к общему наркозу;
●безуспешность других методов лечения;
●адекватная функция печени;
●отсутствие венозного тромбоза;
●степень тяжести цирроза по классификации Чайлд-Пью: А и Б;
●отсутствие значимой коагулопатии.
Разрушение опухолевых узлов с помощью химических агентов—этанола, уксусной кислоты — в настоящее время практически не используется.
Методики регионарной химио- и радиотерапии:
●химиоинфузия через печеночную артерию (ХИПА);
●химиоэмболизация печеночной артерии (ХЭПА);
●химиоэмболизация воротной вены (ХЭВВ);
●радиоэмболизация печеночной артерии (РЭПА).
Данные методики применяются в основном при первичном раке печени. При метастатическом поражении они используются в случае отсутствия эффекта от нескольких линий системного лечения. Могут применяться в сочетании друг с другом или с полихимиотерапией. Основная цель регионарного лечения — создание высокой концентрации противоопухолевого агента в зоне интереса без выраженного системного воздействия. При химиоинфузии после катетеризации печеночной артерии проводится курсовое введение химиопрепарата, чаще всего оксалиплатина и доксорубицина в афферентные сосуды опухоли. Химиоэмболизация — введение в просвет сосуда эмболов, содержащих химиопрепарат. Таким образом, с одной стороны, происходит закупорка сосудов, кровоснабжающих опухоль, а с другой — цитостатик поступает непосредственно в ткань опухоли и не вызывает побочные эффекты, которые возникают при его введении в вену. При этом в самой опухоли создаются очень высокие концентрации препарата, невозможные при обычном введении. В настоящее время для эмболизации используют частицы поливинилалкоголя (PVA) от 50 до 1000 мкм,
184

сферические эмболы Bead Block и Embozene, спирали из платины и нержавеющей стали с желатиновыми губками. При масляной эмболизации используют контрастный препарат Lipiodol Ultrafluid и после его введения производят окклюзию артерии коллагеновой гемостатической губкой. Радиоэмболизация — введение эмболов, содержащих радиоактивные изотопы. Для этого обычно используют изотоп Итрий-90.
Артериальная химиоэмболизация позволяет достичь субъективного улучшения почти у 90% больных с неоперабельным ГЦР. Объективно определяемый эффект, в виде уменьшения размеров опухолевых узлов, зафиксирован у 30–33% пациентов. Стабилизация процесса имеет место у 28,7% больных. Один год проживают более половины больных — 51,0±7,1 %, 2 года – 24,5±6,1% больных. Медиана выживаемости больных с ГЦР составляет 12 мес. 1 и 2-летняя выживаемость достоверно выше при многократной химиоэмболизации, чем при однократной (р=0,001). Субъективное улучшение отмечено у 15 (50,0%) пациентов этой группы, существенного улучшения не наблюдалось у 8 (26,7%) больных, а у 7 (23,3%) на фоне прогрессирования болезни наступило ухудшение. У больных с метастазами в печень использование эндоваскулярных методик позволяет добиться уменьшения размеров опухолевых узлов у 43,3% пациентов, стабилизации — у 33,3%. Один год проживают более 50%, 2 года – 26,7%, 3 года – 20,0% больных. Медиана выживаемости больных с неоперабельными метастазами в печени колоректального рака составила 13,2 мес. Артериальная химиоэмболизация может считаться методом выбора лечения резистентных к системной химиотерапии метастазов в печени рака толстой кишки. Так, при прогрессировании метастатической болезни объективный ответ был получен более чем у 40% больных, в том числе и при множественном, билобарном поражении печени.
Химиоэмболизация и радиоэмболизация афферентных сосудов хорошо зарекомендовали себя как методы лечения опухолей печени, в том числе нерезектабельных. Перекрытие кровоснабжения опухолевого узла снижает интенсивность роста опухоли, позволяет предотвратить генерализацию онкологического процесса. Доставка с искусственным эмболом химиопрепарата или радиоизотопа способствует гибели патологических клеток и снижает вероятность развития побочных эффектов за счет локального действия повреждающих агентов. При этом сниженный кровоток в опухоли препятствует развитию резистентности к проводимой терапии.
Наибольшей эффективности удается достичь при совместном применении методов химиоэмболизации и радиочастотной или микроволновой абляции. Эмболизация сосудов уменьшает вероятность кровотечения при проведении абляции, а также позволяет редуцировать узлы более крупного размера. По мнению Z. Xu et al., применение химиоэмболизации в комбинации с микроволновой абляцией позволяет повысить выживаемость и улучшить качество жизни пациентов как при малом, так и при большом размере новообразования, свыше 5 см. Кроме того, показана эффективность лечения множественных поражений печени, до 10 узлов.
В настоящее время накоплен значительный опыт применения итрия-90 для радиоэмболизации сосудов печени. Терапевтический эффект достигается высокой суммарной очаговой дозой радиации при облучении самого опухолевого узла до 200 Гр, при незначительном облучении здоровых тканей — не более 30 Гр. Кроме того, в последнее время появились работы, согласно которым высокой эффективностью обладает галлий166. Применение радиоэмболизации позволяет снизить скорость прогрессирования заболевания у пациентов с первичным и метастатическим нерезектабельным раком печени, повысить качество и продолжительность жизни. При этом эффективность данного метода лечения превышает аналогичные показатели, полученные для химиоэмболизации. Данные об эффективности применения радиоэмболизации совместно с паллиативной химиотерапией сорафенибом получены у пациентов с сохранной функцией печени, не выделяя отдельно группу паллиативных пациентов.
185
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

МЕТОДЫ БИЛИАРНОЙ ДЕКОМПРЕССИИ
Под термином «механическая желтуха» подразумевают симптомокомплекс, возникающий при нарушении оттока желчи по желчным протокам и повышении в крови уровня билирубина (гипербилирубинемия), который оказывает токсическое влияние на организм. Причиной механической желтухи, как правило, является сдавление желчных протоков первичными или метастатическими опухолями печени и поджелудочной железы. При наличии механической желтухи невозможно ни хирургическое, ни химиотерапевтическое лечение основного заболевания. Дальнейший рост концентрации билирубина приводит к гибели пациента. Единственным способом снизить его концентрацию является восстановление оттока желчи из печени. Единственным эффективным методом устранения билиарной гипертензии, обусловленной сдавлением желчных протоков опухолями, является дренирование желчных протоков. Они выполняются под контролем рентгенотелевидения и (или) ультразвука. Различают следующие виды дренирования:
●наружное – при котором вся желчь отводится только наружу;
●наружно-внутреннее – при котором дренаж ставится таким образом, что желчь эвакуируется как наружу, так и в естественном направлении, в кишку.
Наружно-внутреннее дренирование более физиологично, поскольку позволяет участвовать желчи в процессе пищеварения. В некоторых случаях, когда опухолевое сдавление изолирует несколько разных сегментов желчного дерева, может потребоваться установка нескольких дренажей. Хотя дренирование и выполняет основную функцию, оно существенно ограничивает качество жизни пациента – дренаж постоянно раздражает брюшную стенку, требует постоянного ухода, есть риск его смещения или даже случайного удаления, а также развития инфекционных осложнений в месте стояния. Этих недостатков лишен метод стентирования желчных протоков. Суть его заключается
вустановке в зону сдавления желчного протока специального (чаще металлического) эндопротеза – стента, который поддерживает желчный проток в открытом состоянии за счет большой радиальной жесткости. При этом отток желчи будет осуществляться по желчному протоку, восстановленному при помощи стента. По мнению T. Ogura et al., M. Fukasava et al., применение эндоскопического стентирования, особенно металлических саморасширяющихся стентов, обеспечивает более высокую выживаемость пациентов за счет малой травматичности и меньшего риска развития воспалительных осложнений в сравнении с пластиковыми конструкциями. Отсутствие дренажа обеспечивает более высокое качество жизни. Возможна установка параллельных стентов при множественном поражении желчных протоков. Так, существуют две основные техники проведения подобных манипуляций: side-by-side и stent-in-stent. В первом случае стенты устанавливаются параллельно в соединяющихся желчных протоках, во втором – один вставляется в другой, так чтобы сформировать Y-образную структуру конечной конструкции. Проведение дренирования возможно в качестве подготовки к следующему этапу паллиативного лечения больного. Устранение билиарной обструкции может быть использовано для подготовки пациента к паллиативной эмболизации или абляции опухолевых узлов: данные методы приводят к значительному повышению продолжительности и качества жизни, однако противопоказаны при нарушении проходимости билиарного дерева.
186

ЭНДОВАСКУЛЯРНЫЕ МЕТОДИКИ ПРИ ПОРТАЛЬНОЙ ГИПЕРТЕНЗИИ
Рентгенхирургические методы в последние годы находят все более широкое применение в лечении больных с портальной гипертензией. К ним относятся:
●эндоваскулярная эмболизация варикозных вен пищевода и желудка;
●TIPS – эндоваскулярное наложение внутрипеченочного порто-кавального шунта;
●эндоваскулярная редукция селезеночного/печеночного кровотока (парциальная эмболизация селезеночной/печеночной артерии).
ЭНДОВАСКУЛЯРНАЯ ЭМБОЛИЗАЦИЯ ВАРИКОЗНЫХ ВЕН ПИЩЕВОДА И ЖЕЛУДКА
Это вмешательство выполняют при кровотечении из варикозно-расширенных вен пищевода и желудка или при угрозе его возникновения. Через небольшой прокол на коже в воротную вену проводят тонкий катетер и устанавливают его в варикозно-рас- ширенных венах. Через катетер вводят эмболизационные спирали, которые полностью закрывают варикозно-расширенные сосуды. Эффективность эмболизации достаточно высока. Практически у всех больных прекращается кровотечение и резко снижается риск его рецидива.
TIPS (transjugular intrahepatic portosystemic stent-shunting) – эндоваскулярное наложение внутрипеченочного порто-кавального шунта. TIPS – это искусственное внутрипеченочное соустье между воротной и печеночной веной. ТIPS создает прямой сброс крови по относительно безопасному пути, обеспечивая декомпрессию системы воротной вены. В образовавшееся соустье устанавливают металлический каркас – стент, который не позволяет шунту закрыться.
ЭНДОВАСКУЛЯРНАЯ РЕДУКЦИЯ СЕЛЕЗЕНОЧНОГО/ПЕЧЕНОЧНОГО КРОВОТОКА (парциальная эмболизация селезеночной/печеночной артерии)
Чрескожным доступом (пункция бедренной артерии) в селезеночную артерию вводят спирали, которые не перекрывают ее просвет полностью, а лишь уменьшают объем кровотока. Таким образом, уменьшается приток, а следовательно, и отток крови от селезенки в воротную вену. Функция селезенки при этом не страдает.
Число больных первичным и метастатическим раком печени, нуждающихся в паллиативном лечении, постоянно увеличивается. Это обьясняется патогенезом развития гепатоцеллюлярной карциномы на фоне гепатита/цирроза и значительной частотой метастазирования в печень злокачественных опухолей. Хирургическое лечение в радикальном объеме возможно не более чем у 20–30% пациентов. Разработанные к настоящему времени паллиативные инвазивные методики направлены как на устранение и профилактику осложнений процесса, так и на увеличение продолжительности жизни больного и улучшение ее качества.
187
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

ПРОФИЛАКТИКА И ПАТОГЕНЕТИЧЕСКАЯ ФАРМАКОТЕРАПИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ ПРИ РЕЗЕКЦИЯХ ПЕЧЕНИ
Согласно современным публикациям наиболее частой причиной смерти больных после расширенной гемигепатэктомии (до 56—77% ) является пострезекционная острая печеночная недостаточность, которая в дальнейшем является препятствием к проведению полихимиотерапии. Наряду с основными методами профилактики этого осложнения, такими как хирургические (тщательный выбор объема и метода резекции, применение кровосберегающих методик и др.) и анестезиологические (предоперационная подготовка, выбор анестезии с минимальным гепатотоксическим эффектом, поддержание относительной гиповолемии во время операции), в послеоперационном периоде в схеме инфузионной терапии широко применяют различные препараты, обладающие гепатопротекторными свойствами. Одним из самых эффективных и часто применяемых в клинической практике является Ремаксол (ООО ПОЛИСАН, СПб.). Каждый компонент Ремаксола обладает антиоксидантными, антигипоксантными и иммуномодулирующими свойствами. Янтарная кислота усиливает процессы клеточного дыхания, повышает устойчивость мембран гепатоцитов к гипоксии, метионин увеличивает синтез холина, обезвреживает токсичные продукты, рибоксин активизирует синтез нуклеотидов и обменные процессы в клетках и повышает их энергетический баланс, никотинамид способствует защите клеточных мембран от разрушения свободными радикалами. Поэтому Ремаксол, обладая многообразными гепатопротекторными свойствами, подтвержденными как в эксперименте, так и в клинической практике, используется в онкологии для профилактики и лечения печеночной недостаточности при хирургических вмешательствах на печени, а также при проведении химиотерапии.
В рекомендациях RUSSCO (версия 2021г.) раздел «Лечение гепатотоксичности у пациентов,получающихпротивоопухолевуютерапию»содержитрекомендациюназначенияРемаксола для профилактики и коррекции гепатотоксических реакций в дозе 400—800 мл/сут внутривенного капельного ведения в течение 3—12 дней при различных типах поражения печени. При этом рекомендован следующий режим введения: 1) для профилактики лекарственного повреждения печени (ЛПП) — 400 мл внутривенно капельно 1 раз в сутки не менее четырех дней; 2) для лечения ЛПП — 400 мл внутривенно капельно 2 раза в сутки не менее четырех дней после каждого курса ПХТ.
Наш собственный опыт использования Ремаксола, а также проведенное в нашем институте сравнительное исследование Ремаксола (ООО ПОЛИСАН, СПб.) и Адеметионина (Гептрал, Hospira S.p.A., Италия) у онкологических больных после обширных резекций печени по поводу метастазов колоректального рака (Хороненко В.Э. и соавт. Анестезиология и реаниматология. 2014. № 4, с. 33—38) показали, что введение препарата Ремаксол по 800 мл в сутки, начиная с интраоперационного этапа и на протяжении пяти суток после операции, «позволило достичь лучших показателей интенсивности цитолитического и холестатического синдромов, белоксинтетической функции печени, пигментного обмена, состояния про- и антиоксидантной систем, а также уровня эндогенной интоксикации, которые были наиболее близкими к исходным.
Литература
1. Долгушин Б.И., Косырев В.Ю., Рампрабанант С. Радиочастотная абляция в онкологии // Практическая онкология. 2007. № 4 (8). C. 219–227.
188
2.Злокачественные новообразования в России в 2019 году (заболеваемость и смертность) / Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М.: МНИОИ им. П.А. Герцена — филиал ФГБУ £НМИЦ радиологии¤ Минздрава России, 2020. 252 c.
3.Au K.P., Ho Chok K.S. Multidisciplinary approach for post-liver transplant recurrence of hepatocellular carcinoma: A proposed management algorithm // World Journal of Gastroenterology. 2018.
№45 (24). p. 5081–5094.
4.Cohen J.T., Miner T.J. Patient selection in palliative surgery: Defining value // Journal of Surgical Oncology. 2019. № 1 (120). p. 35–44.
5.Cunningham S.C. et al. Palliation of hepatic tumors // Surgical Oncology. 2007. № 4 (16). p. 277–291.
6.Fahy B. N. Introduction: Role of palliative care for the surgical patient // Journal of Surgical Oncology. 2019. № 1 (120). p. 5–9.
7.Fukasawa M. et al. Endoscopic biliary stenting for unresectable malignant hilar obstruction // Clinical Journal of Gastroenterology. 2017. № 6 (10). p. 485–490.
8.Galle P.R. et al. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma // Journal of Hepatology. 2018. № 1 (69). p. 182–236.
9.Hanna N.N., Bellavance E., Keay T. Palliative Surgical Oncology // Surgical Clinics of North America. 2011. № 2 (91). p. 343–353.
10.Hartke J. et al. The diagnosis and treatment of hepatocellular carcinoma // Seminars in Diagnostic Pathology. 2017. № 2 (32). p. 153–159.
11.Lebedev D.P. et al. Radioembolization As a Method for the Treatment of Unresectable Primary and Metastatic Liver Cancer (Literature Review) // Journal of Experimental and Clinical Surgery. 2020. № 1 (13). p. 61–69.
12.Moroney M.R., Lefkowits C. Evidence for integration of palliative care into surgical oncology practice and education // Journal of Surgical Oncology. 2019. № 1 (120). p. 17–22.
13.Ogura T. et al. Endoscopic ultrasound-guided biliary drainage for right hepatic bile duct obstruction: novel technical tips 2015. p. 72–75.
14.Pillai A.K. et al. Portal hypertension: a review of portosystemic collateral pathways and endovascular interventions // Clinical Radiology. 2015. p. 1–13.
15.Shah K.N., Clary B.M. Endoscopic and percutaneous approaches to the treatment of biliary tract and primary liver tumors: Controversies and advances // Surgical Oncology Clinics of North America. 2014. № 2 (23). p. 207–230.
16.Vilgrain V. et al. E cacy and safety of selective internal radiotherapy with yttrium-90 resin microspheres compared with sorafenib in locally advanced and inoperable hepatocellular carcinoma (SARAH): an open-label randomised controlled phase 3 trial // The Lancet Oncology. 2017. № 12 (18). p. 1624–1636.
17.Woodrell C.D. et al. Palliative Care for People With Hepatocellular Carcinoma, and Specific Benefits for Older Adults // Clinical Therapeutics. 2018. № 4 (40). p. 512–525.
18.Xu Z. et al. The combination strategy of transarterial chemoembolization and radiofrequency ablation or microwave ablation against hepatocellular carcinoma // Analytical Cellular Pathology. 2019. (2019).
19.Yoon Y. S. et al. Palliative surgery in patients with unresectable colorectal liver metastases: A propensity score matching analysis // Journal of Surgical Oncology. 2014. № 3 (109). p. 239–244.
20.Zhu F., Rhim H. Thermal ablation for hepatocellular carcinoma: What’s new in 2019 // Chinese Clinical Oncology. 2019. № 6 (8).
21.Principles and practice of palliative care and supportive oncology // R.J.H. v Berger A.M, Shuster J.L., Lippincott Williams & Wilkins, a Wolter Kluwer business, 2007. 923 p.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
