
6 курс / Медицинская реабилитация, ЛФК, Спортивная медицина / Национальное_руководство_по_паллиативной_медицинской_помощи_в_онкологии
.pdf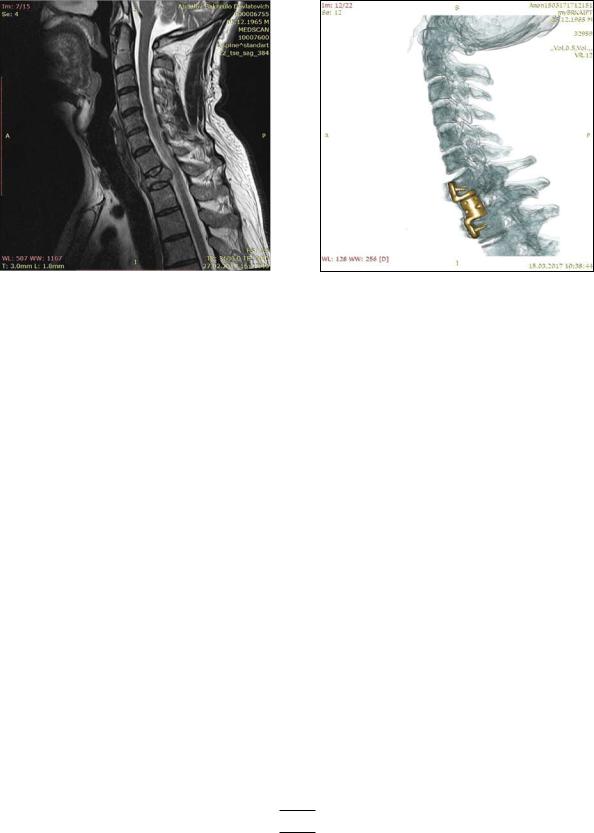
а |
б |
Рис. 6:
а – магниторезонансная томография шейного отдела позвоночника с патологическим переломом С7 позвонка с компрессией спинного мозга на фоне метастатического поражения;
б – компьютерная томография с 3Д-моделированием шейного отдела позвоночника после корпорэктомии С7 позвонка с эндопротезированием раздвижным эндопротезом
кости таза, срастаясь между собой, формируют вертлужную впадину, которая совместно с головкой бедренной кости образует тазобедренный сустав.
Метастатическое поражение костей таза оказывает значительное влияние на снижение качества жизни, не только вызывая болевой синдром, но и существенно ограничивая пациентов в передвижении, зачастую приводя к инвалидизации. Существующие в настоящее время хирургические методики позволяют предотвратить патологические переломы, уменьшить болевой синдром, улучшить качество жизни этой категории больных.
В настоящее время при лечении метастазов в кости таза выполняются такие хирургические вмешательства, как: радикальные резекции с реконструктивно-пластическим компонентом, кюретаж с пластикой цементом, остеопластика и радиочастотная термоабляция под контролем компьютерной томографии.
ПОКАЗАНИЯ ДЛЯ ВЫПОЛНЕНИЯ РАДИКАЛЬНЫХ РЕЗЕКЦИЙ С РЕКОНСТРУКТИВНО-ПЛАСТИЧЕСКИМ КОМПОНЕНТОМ
Основным показанием для выполнения радикальных резекций костей таза является солитарное метастатическое поражение. Так как эти операции являются трудоемкими для выполнения и сопровождаются частым развитием осложнений, то пациент на этапе уточняющей диагностики должен быть полностью обследован для получения данных о степени распространенности опухолевого процесса (рис. 9), что позволит прецизионно выполнить хирургический этап лечения (рис. 10).
130
а |
б |
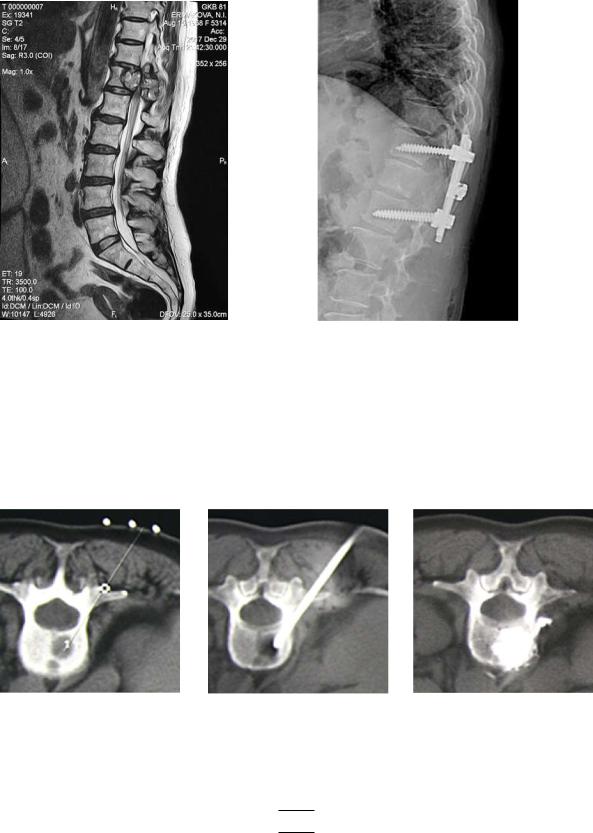
Рис. 7:
а – магниторезонансная томография нижнегрудного и поясничного отделов позвоночника с метастатическим поражением ТН12 позвонка с компрессией спинного мозга;
б – рентгенография нижнегрудного и поясничного отделов позвоночника после декомпрессивной ляминэктомии на уровне ТН12 с транспедикулярной фиксацией
а |
б |
в |
Рис. 8:
а – компьютерная томография L2 позвонка с наличием литического метастаза в теле; б – игла для вертебропластики введена в тело L2 позвонка парапедикулярно;
в – заполненная литическая полость тела позвонка после вертебропластики
131
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
ПОКАЗАНИЯ ДЛЯ МАЛОИНВАЗИВНЫХ МЕТОДОВ ЛЕЧЕНИЯ МЕТАСТАТИЧЕСКОГО ПОРАЖЕНИЯ КОСТЕЙ ТАЗА (ОСТЕОПЛАСТИКА И РАДИОЧАСТОТНАЯ ТЕРМОАБЛЯЦИЯ ПОД КТ-КОНТРОЛЕМ)
Малоинвазивные методики хирургической коррекции наиболее широко используются при метастатическом поражении тазового кольца. Основным показанием к их применению является множественное или единичное поражение с наличием патологического перелома или его угрозой или выраженным болевым синдромом (рис. 11).
МЕТАСТАТИЧЕСКОЕ ПОРАЖЕНИЕ ГРУДНОЙ СТЕНКИ
Метастатическое поражение костей грудной стенки (ребра, грудина), как правило, не приводит к существенному снижению качества жизни, даже в случае патологического перелома ребер, поскольку грудная стенка не несет осевой нагрузки. В связи с этим
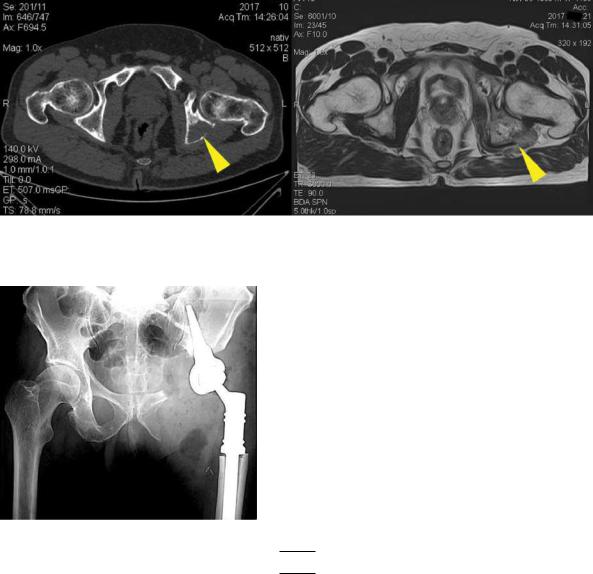
Рис. 9. Компьютерная томография костей таза и магнитно-резонансная томография
костей таза пациента с метастатическим поражением параацетабулярной области до проведения хирургического лечения
Рис. 10. Рентгенография костей таза
в прямой проекции после выполнения параацетабулярной резекции с эндопротезированием модульным эндопротезом на основе конической ножки
132

Рис. 11. Компьютерная томография костей таза до проведенного лечения, во время
радиочастотной термоабляции и после выполненной остеопластики. Литический компонент метастатической опухоли практически полностью заполнен костным цементом
выполнение хирургического лечения с паллиативной и симптоматической целью может выполняться только в случае распада опухоли с угрозой кровотечения. В других случаях рекомендуется применять лучевую терапию.
При солитарном метастатическом поражении грудной стенки возможно выполнение резекций грудной стенки с реконструктивно-пластическим компонентом. В этом случае операция направлена на увеличение выживаемости данной группы больных.
Несмотря на успехи в лечении злокачественных опухолей и неуклонное улучшение общей выживаемости онкологических больных, лечение метастатического поражения костей остается сложной задачей. Помощь данной категории пациентов включает в себя комбинацию медикаментозной терапии, лучевой терапии или хирургического вмешательства.
Достижения современной медицинской диагностической визуализации привели к более раннему выявлению метастазов в кости в ходе лечения онкологического заболевания, что позволяет на сегодняшний день на ранней стадии опухолевого процесса установить объективные показания к возможной хирургической коррекции до свершения патологического перелома. В современной ортопедической хирургии имеется широкий спектр имплантатов и вариантов лечения, которые повышают роль онкоортопедов в принятии решений при рассмотрении стратегии лечения пациентов с метастатическим поражением костей.
Целями хирургического лечения пациентов с метастатическим поражением костей являются облегчение боли, восстановление функции и в конечном счете улучшение качества жизни пациентов. Сложность ведения пациентов с метастазами в кости требует мультидисциплинарного подхода и тщательного планирования для достижения наилучшего качества жизни онкологических больных.
Литература
1.Бухаров А.В., Державин В.А., Ядрина А.В., Голубев П.В. Ортопедическое пособие при метастатическом поражении длинных костей // Исследования и практика в медицине. 2019.
Т.6. № S. С. 58.
2.Бухаров А.В., Алиев М.Д., Державин В.А., Ядрина А.В. Стратегия персонализированного хирургического лечения онкологических больных с метастазами в костях // Онкология. Журнал им. П.А. Герцена. 2020. Т. 9. № 3. С. 61–65.
3.Бычкова Н.М., Хмелевский Е.В. Современные подходы к лучевой терапии метастатических поражений скелета // Онкология. Журнал им. П.А. Герцена. 2019. Т. 8. С. 295–302.
4.Державин В.А., Бухаров А.В., Ядрина А.В., Ерин Д.А. Результаты онкологического эндопротезирования коленного сустава у пациентов с первичными и метастатическими опухолями бедренной и большеберцовой костей // Гений ортопедии. 2020. Т. 26. № 3. С. 347–352.
133
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

5.Державин В.А., Бухаров А.В., Ядрина А.В., Ерин Д.А. Резекция костей таза с модульным эндопротезированием у больного с метастазом колоректального рака в вертлужной впадине // Онкология. Журнал им. П.А. Герцена. 2020. Т. 9. № 4. С. 49–54.
6.Заборовский Н.С., Пташников Д.А., Топузов Э.Э., Левченко Е.В., Михайлов Д.А., Наталенко К.Е. Эпидемиология опухолей позвоночника у пациентов, получивших специализированную ортопедическую помощь // Травматология и ортопедия. 2019.Т. 25. № 1. С. 104–112.
7.Кабардаев Р.М., Мусаев Э.Р., Кулага А.В., Валиев А.К., Карпова Е.С., Алиев М.Д. Результаты хирургического лечения больных с опухолями позвоночника // Саркомы костей, мягких тканей и опухоли кожи. 2018. Т. 10. № 4. С. 29–33.
8.Каприн А.Д., Старинский В.В., Шахзадова А.О. Состояние онкологической помощи населению России в 2019 году. М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2020. 239 с.
9.Карпенко В.Ю., Бухаров А.В., Державин В.А., Илуридзе Г.Д. Интервенционные вмешательства при метастатическом поражении костей // Исследования и практика в медицине. 2017. Т. 4. № 2. С. 58.
10.Карпенко В.Ю., Бухаров А.В., Державин В.А. Хирургическое лечение при солитарном поражении позвоночного столба // Онкология. Журнал им. П.А. Герцена. 2017. Т. 6. № 1.
С.12–18.
11.Кулага А.В., Мусаев Э.Р., Валиев А.К., Борзов К.А., Кабардаев Р.М., Алиев М.Д. Факторы прогноза при метастатическом поражении позвоночника (Литературный обзор) // Саркомы костей, мягких тканей и опухоли кожи. 2018. № 3. С. 23–30.
12.Усманова Е.Б., Щелкова О.Ю., Сушенцов Е.А., Софронов Д.И., Валиев А.К. Качество жизни и выживаемость пациентов с опухолевым поражением костей // Саркомы костей, мягких тканей и опухоли кожи. 2019. Т. 11. № 2. С. 34–39.
13.Abdallah BM. Marrow adipocytes inhibit the di erentiation of mesenchymal stem cells into osteoblasts via suppressing BMP-signaling. J Biomed Sci. 2017; 24(1): 11.
14.Aboulafia AJ, Levine AM, Schmidt D, Aboulafia D. Surgical therapy of bone metastases. Semin Oncol. (2007) 34:206–14.
15.Angelini A, Trovarelli G, Berizzi A, Pala E, Breda A, Maraldi M, Ruggieri P. Treatment of pathologic fractures of the proximal femur. Injury. 2018 Nov;49 Suppl 3:S77-S83.
16.Angileri SA, Granata G, Savoldi AP, Rodà GM, Di Meglio L, Grillo P, Tortora S, Arrichiello A, Papa M, Liguori A, Ierardi AM, De Filippo M, Paolucci A, Carrafiello G. Cooled radiofrequency ablation technology for painful bone tumors. Acta Biomed. 2020 Sep 23;91(10-S):e2020007.
17.Arvinius C, Parra JL, Mateo LS, Maroto RG, Borrego AF, Stern LL. Benefits of early intramedullary nailing in femoral metastases. Int Orthop. (2014) 38:129–32.
18.Ashford RU, Benjamin L, Pendlebury S, Stalley PD. The modern surgical and non-surgi- cal management of appendicular skeletal metastases. Orthop Trauma (2012) 26:184–99. 10.1016/j. mporth.2012.02.002
19.Ashford RU. Palliative orthopaedic surgery for skeletal metastases. Eur Oncol. (2009) 51:30–4. 10
20.Bauer HC. Controversies in the surgical management of skeletal metastases. J Bone Joint Surg Br. (2005) 87:608–17.
21.Bollen L, van der Linden YM, Pondaag W, et al.. Prognostic factors associated with survival in patients with symptomatic spinal bone metastases: a retrospective cohort study of 1,043 patients. Neuro Oncol 2014;16:991-998.
22.British Association of Surgical Oncology Guidelines. The management of metastatic bone disease in the United Kingdom. The Breast Specialty Group of the British Association of Surgical Oncology. Eur J Surg Oncol. (1999) 25:3–23
134

23.Brown JE, Handforth C, Compston JE, Cross W, Parr N, Selby P, Wood S, Drudge-Coates L, Walsh JS, Mitchell C, Collinson FJ, Coleman RE, James N, Francis R, Reid DM, McCloskey E. Guidance for the assessment and management of prostate cancer treatment-induced bone loss. A consensus position statement from an expert group. J Bone Oncol. 2020 Aug 2;25:100311.
24.Bucknor MD, Chan FP, Matuoka JY, Curl PK, Kahn JG. Cost-e ectiveness analysis of magnetic resonance-guided focused ultrasound ablation for palliation of refractory painful bone metastases. Int J Technol Assess Health Care. 2020 Dec 3:1-7.
25.Capanna R, Campanacci DA. The treatment of metastases in the appendicular skeleton. J Bone Joint Surg Br. (2001) 83:471–81.
26.Cappellari A, Trovarelli G, Crimì A, Pala E, Angelini A, Berizzi A, Ruggieri P. New concepts in the surgical treatment of actual and impending pathological fractures in metastatic disease. Injury. 2020 Nov 11:S0020-1383(20)30952-9.
27.Charles T, Ameye L, Gebhart M. Surgical treatment for periacetabular metastatic lesions. European Journal of Surgical Oncology. 2017 Sep;43(9):1727-1732.
28.Choi J, Raghavan M. Diagnostic imaging and image-guided therapy of skeletal metastases. Cancer Control (2012) 19:102–12.
29.Clezardin P, Coleman R, Puppo M, Ottewell P, Bonnelye E, Paycha F, Confavreux CB, Holen I. Bone Metastasis: Mechanisms, Therapies and Biomarkers. Physiol Rev. 2020 Dec 24.
30.Coleman R, Body JJ, Aapro M, Hadji P, Herrstedt J, ESMO Guidelines Working Group. Bone health in cancer patients: ESMO clinical practice guidelines. Ann Oncol. (2014) 25:124–137.
31.Coleman RE. Clinical features of metastatic bone disease and risk of skeletal morbidity. Clin Cancer Res. (2006) 12:6243s–9s.
32.Damron TA, Sim FH. Surgical treatment for metastatic disease of the pelvis and proximal end of the femur. J Bone Joint Surg Am. (2000) 49:114–26.]
33.Daniel AM, Capanna R. The surgical treatment of pelvic bone metastases. Adv Orthop. (2015) 2015:525363 10.1155
34.Dürr HR, Müller PE, Lenz T, et al.. Surgical treatment of bone metastases in patients with breast cancer. Clin Orthop Relat Res 2002;396:191-196.
35.Ehne J, Tsagozis P. Current concepts in the surgical treatment of skeletal metastases. World J Orthop. 2020 Jul 18;11(7):319-327.
36.Enneking W, Dunham W, Gebhardt M, Malawar M, Pritchard D. A system for the classification of skeletal resections. La Chirurgia degli Organi di Movimento (1990) 75:217–40.
37.Forsberg JA, Eberhardt J, Boland PJ, Wedin R, Healey JH. Estimating survival in patients with operable skeletal metastases: an application of a Bayesian belief network. PLoS ONE (2011) 6:e19956. 10.1371.
38.Fuhrman SA, Lasky LC, Limas C. Prognostic significance of morphologic parameters in renal cell carcinoma. Am J Surg Pathol 1982;6:655–663.
39.Hansen BH, Keller JØ. Surgical treatment of skeletal metastases in the pelvis and extremities. Ugeskr Laeger. 2005 Nov 28;167(48):4559-62.
40.Harries M, Taylor A, Holmberg L, et al.. Incidence of bone metastases and survival after a diagnosis of bone metastases in breast cancer patients. Cancer Epidemiol 2014;38:427-434.
41.Harrington KD. New trends in the management of lower extremity metastases. Clin Orthop Relat Res. (1982) 169:53–61.
42.Heindel W, Gübitz R, Vieth V, Weckesser M, Schober O, Schäfers M. The diagnostic imaging of bone metastases. Dtsch Arztebl Int. (2014) 111:741–47.
43.Iib R, Huang Z, Hu C, Yuan L, Li Y, Zhao C, Hu C. Prognostic factors, risk factors, and nomograms for bone metastasis . BMC Cancer. 2020 Nov 27;32 (1):1385.
44.Jacofsky DJ, Papagelopoulos PJ, Sim FH. Advances and challenges in the surgical treatment of metastatic bone disease. Clin Orthop. (2003) (415S):14–8.
135
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
45.Jiao D, Yao Y, Li Z, Ren J, Han X. Simultaneous C-arm Computed Tomography-Guided Microwave Ablation and Cementoplasty in Patients with Painful Osteolytic Bone Metastases: A Singlecenter Experience. Acad Radiol. 2020 Nov 4:S1076-6332(20)30587-0.
46.Jones DH, Nakashima T, Sanchez OH, Kozieradzki I, Komarova SV, Sarosi I. et al. Regulation of cancer cell migration and bone metastasis by RANKL. Nature (2006) 440:692–6.
47.Katagiri H, Okada R, Takagi T, et al.. New prognostic factors and scoring system for patients with skeletal metastasis. Cancer Med 2014;3:1359-1367.
48.Kirkinis MN, Spelman T, May D, Choong PFM. Metastatic bone disease of the pelvis and extremities: rationalizing orthopaedic treatment. ANZ J Surg. 2017 Nov;87(11):940-944.
49.Kumar N, Patel R, Tan JH, Song J, Pandita N, Hey DHW, Lau LL, Liu G, Thambiah J, Wong HK. Symptomatic Construct Failure after Metastatic Spine Tumor Surgery. Asian Spine J. 2020 Oct 29.
50.Laufer I, Rubin DG, Lis E, et al.. The NOMS framework: approach to the treatment of spinal metastatic tumors. Oncologist 2013;18:744-751.
51.Liu D, Wu J, Lin C, Andriani L, Ding S, Shen K, Zhu L. Breast Subtypes and Prognosis of Breast Cancer Patients With Initial Bone Metastasis: A Population-Based Study. Front Oncol. 2020 Dec 2;10:580112.
52.Mirels H. Metastatic disease in long bones. a proposed scoring system for diagnosing impending pathologic fractures. Clin Orthop Relat Res. (1989) 249:256–64.
53.Ratasvuori M, Wedin R, Keller J, Nottrott M, Zaikova O, Bergh P, et al. Insight opinion to surgically treated metastatic bone disease: Scandinavian Sarcoma Group Skeletal Metastasis Registry report of 1195 operated skeletal metastasis. Surg Oncol. (2013) 22:132–38. 10.1016/j.suronc.2013.02.008
54.Ryan C, Stoltzfus KC, Horn S, Chen H, Louie AV, Lehrer EJ, Trifiletti DM, Fox EJ, Abraham JA, Zaorsky NG. Epidemiology of bone metastases. Bone. 2020 Dec 1:115783.
55.Sherry HS, Levy RN, Si ert RS. Metastatic disease of bone in orthopedic surgery. Clin Orthop. (1982) 169:44–52.
56.Soeharno H, Povegliano L, Choong PF. Multimodal Treatment of Bone Metastasis-A Surgical Perspective. Front Endocrinol (Lausanne). 2018 Sep 7;9:518.
57.Szendrői M, Kiss J, Perlaky T, Antal I, Szalay K, Szendrői A. Change of paradigm in the surgical treatment of metastatic diseases of bone. Part I. Bony metastases of the extremities and pelvis. Orv Hetil. 2017 Oct;158(40):1563-1569.
58.Tokuhashi Y, Matsuzaki H, Oda H, Oshima M, Ryu J. A revised scoring system for preoperative evaluation of metastatic spine tumor prognosis.
Spine (Phila Pa 1976). 2005 Oct 1;30(19):2186-91.
59.Tomita K, Kawahara N, Kobayashi T, Yoshida A, Murakami H, Akamaru T. Surgical strategy for spinal metastases. Spine (Phila Pa 1976). 2001 Feb 1;26(3):298-306.
60.Toyoda Y, Shinohara N, Harabayashi T, et al. Survival and prognostic classification of patients with metastatic renal cell carcinoma of bone. Eur Urol 2007;52:163-168.
61.Wang H, Zhang W, Bado I, Zhang XH. Bone Tropism in Cancer Metastases. Cold Spring Harb Perspect Med. 2020 Oct 1;10(10):a036848.
62.Wedin R, Hansen BH, Laitinen M, Trovik C, Zaikova O, Bergh P, Kalén A, Schwarz-Lausten G, Vult von Steyern F, Walloe A, Keller J, Weiss RJ. Complications and survival after surgical treatment of 214 metastatic lesions of the humerus. J Shoulder Elbow Surg. 2012 Aug;21(8):1049-55.

Хирургическое лечение у паллиативных пациентов с опухолями молочной железы
А.Д. Зикиряходжаев, И.М. Широких, А.С. Сухотько
ЭПИДЕМИОЛОГИЯ
Для цитирования: Хирургическое лечение у паллиативных пациентов с опухолями молочной железы / А.Д. Зикиряходжаев, И.М. Широких, А.С. Сухотько // Национальное руководство по паллиативной медицинской помощи в онкологии / Г.Р. Абузарова ; под ред. академика РАН, профессора А.Д. Каприна. — Москва : Молодая гвардия, 2022. — С. 137—145.
Проблема лечения пациентов с диссеминированной формой рака молочной железы (РМЖ), с наличием отдаленных метастазов в настоящее время все также актуальна, так как мнения специалистов о необходимости и целесообразности проведения хирургического лечения с паллиативной целью разрозненны. Из года в год РМЖ занимает лидирующую позицию в структуре онкологических заболеваний у женщин и, по последним данным, составляет 21,2% от доли всех злокачественных новообразований.
Тем не менее, несмотря на стремительную эволюцию в диагностике и лечении РМЖ, попрежнему наблюдается высокий удельный вес больных с поздними стадиями заболевания. Так, в структуре онкологической заболеваемости удельный вес злокачественных новообразований молочной железы, выявленных в III стадии, из числа впервые выявленных злокачественных новообразований в России на 2019 год составил 20,2%, в IV стадии – 7,5%, чем обусловлено значительное количество больных, нуждающихся в паллиативной помощи.
Такие больные представляют собой неоднородную клиническую группу. У одних болезнь быстро прогрессирует, метастазируя в жизненно важные органы, что приводит к быстрому летальному исходу, у других болезнь развивается медленно, значительно ухудшая качество жизни больного (рис. 1–4 — распадающиеся опухоли молочной железы).
При местно-распространенном процессе это происходит за счет возникающего опухолевого лимфагиита, лимфостаза верхней конечности, прорастания опухоли мягких тканей грудной клетки и кожи, сдавления опухолью подключичной вены, кровотечения из опухоли, болевого синдрома и др. При наличии отдаленных метастазов состояние больного значительно ухудшается за счет сопутствующего опухолевого поражения других тканей и органов.
По последним статистическим данным, наиболее часто отдаленные метастатические поражения при генерализованном РМЖ встречаются в костях, что в 70–80% случаев сопровождается патологическим переломом. Также часто встречается поражение легких и плевры, печени и головного мозга.
При оценке морфологической структуры первичной опухоли у таких пациентов наиболее часто встречался инфильтративный протоковый рак (77%), реже инфильтративный дольковый рак (6,6%), в единичных случаях встречаются другие формы рака молочной железы.
При анализе сведений о контингенте больных с РМЖ, состоящих на учете на 2019 год, выявлено, что и в регионах, и в Центральном округе число больных составило примерно равный процент, что говорит об успешном образовании онкологов в регионах и модернизации онкологической помощи на местах. Смертность от данного заболевания на первом году от выявления болезни в Центральном регионе составила 5,2%, в других округах – 5,7%.
Минимальные показатели активного выявления злокачественных новообразований молочной железы наблюдаются в Псковской области (4,4%), Севастополе (14,3%), Калининградской области (15,3%), Кабардино-Балкарской (17,7%) и Чеченской (20,1%) республиках (среднерос-
137
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
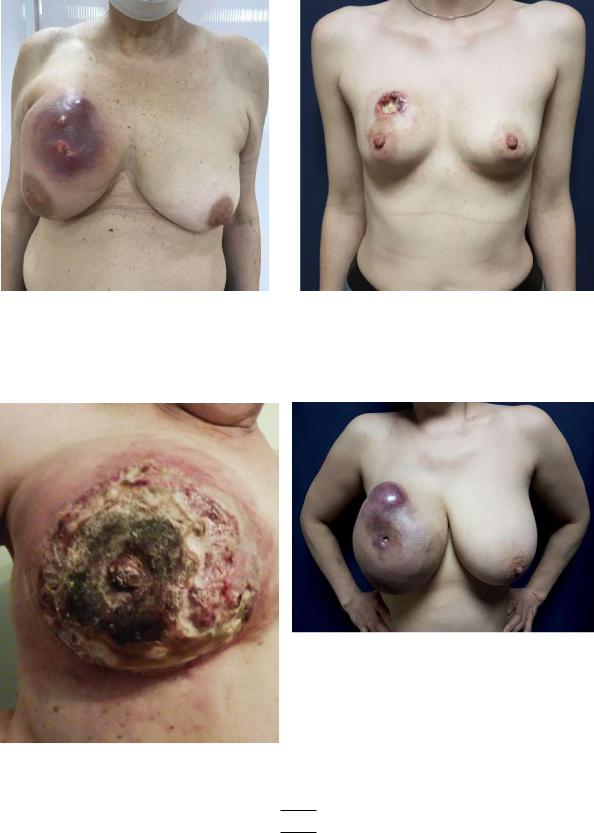
Рис. 1 |
Рис. 2 |
|
Рис. 4
Рис. 3
138

сийский показатель – 44,1%). Максимальные показатели активного выявления злокачественных новообразований молочной железы зафиксированы в Тамбовской (89,4%), Тюменской (69,7%) областях, Чукотском автономном округе (66,7%); шейки матки – в Тамбовской (87,7%), Воронежской (83,8%) областях, республиках Чувашия (75,6%) и Алтай (72,7%).
ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К ХИРУРГИЧЕСКОМУ ЛЕЧЕНИЮ У ПАЛЛИАТИВНЫХ ПАЦИЕНТОВ С ОПУХОЛЯМИ МОЛОЧНОЙ ЖЕЛЕЗЫ, ВЛИЯНИЕ НА КАЧЕСТВО ЖИЗНИ
И ПРОГНОЗ ПОСЛЕ ТАКИХ ОПЕРАЦИЙ
Лечение больных метастатическим РМЖ представляет сложную задачу. Пожалуй, нет другого заболевания, при котором существовало бы такое множество мнений и суждений об эффективности того или иного метода лечения. Согласно известным крупным исследованиям женщины с метастатическим РМЖ, перенесшие хирургическое лечение первичной опухоли, имели лучшую выживаемость, чем группа женщин, которым не выполнялось удаление первичной опухоли. В другом исследовании такая группа женщин имела лучшую выживаемость только в первые три года после хирургического лечения. Однако все эти исследования, включенные в метаанализы, были ретроспективными и имели типичные ограничения для проведения хирургического лечения, и, как правило, операцию выполняли только тем женщинам с метастатическим заболеванием, у которых были лучший прогноз (по клинико-морфологическим данным) и молодой возраст.
В2018 году была опубликована крупная обзорная статья двух исследований, включающих 624 метастатических больных РМЖ, анализирующая необходимость проведения хирургического лечения в сопоставлении с системной терапией. Достоверных различий в общей выживаемости у таких больных не выявлено (0,83, 95% CI 0,53). По результатам исследований авторы делают вывод, что решение о проведении операции на молочной железе
утаких больных должно быть индивидуальным и основываться на мнении врача и пациентки, с учетом потенциальных рисков и выгод, а также последующего качества жизни.
Другое крупное ретроспективное исследование было проведено на основании материалов базы данных National Cancer Data Base of the American College of Surgeons Commission on Cancer. В исследовании проведен анализ 16 тыс. женщин с IV стадией РМЖ на момент постановки диагноза. По результатам исследования авторы обнаружили, что у женщин после удаления первичной опухоли риск летального исхода ниже, чем у неоперированных женщин. Авторы исследования сделали предположение, что общая опухолевая масса оказывает ключевое влияние на продолжительность жизни.
Висследовании, выполненном на базе МНИОИ им. П.А. Герцена, в отделении онкологии и реконструктивно-пластической хирургии молочной железы под руководством д.м.н. А.Д. Зикиряходжаева, проанализировано 196 больных РМЖ с наличием отдаленных метастазов (из них метастазы в кости составили 30,1% больных, в легкие – 21,9%, в печень – 19,9%, сочетанное поражение – 28,1%). Средний возраст больных составил 56,5 лет. Все больные получили комплексное лечение: больным первой группы (n = 124) одним из этапов лечения выполнялось удаление первичной опухоли (мастэктомия), причем в 21,8% случаев хирургическое лечение было выполнено на первом этапе, так как присутствовали такие осложнения, как распад, изъязвление и кровотечение. Больным второй группы (n = 72) были выполнены химиотерапия с включением препаратов антрациклинового и таксанового ряда, лучевая терапия и гормональная терапия.
139
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
