
6 курс / Кардиология / Джон_Кэмм_Болезни_сердца_и_сосудов_2011
.pdfвнешней компрессии метастазами, инфильтрации большой венечной артерии или, реже, эмболии опухолью возможно возникновение ишемии миокарда (вплоть до ИМ). Патологический процесс может затрагивать даже коронарный синус. Карцинома легких может инфильтрировать легочные вены и распространяться на ЛП. При больших размерах метастазы могут блокировать отверстие МК. Можно обнаружить небольшие опухолевые метастазы, рассеянные под эндокардом ПП и ПЖ внутри гребенчатых мышц и трабекул, при этом клинические симптомы отсутствуют. Такие метастазы могут быть следствием прямой гематогенной диссеминации. Следует отметить практически полное отсутствие метастазирования в клапаны, что, вероятно, связано с их недостаточной васкуляризацией и постоянным движением, препятствующим вторичной фиксации злокачественных клеток.
Существует четыре способа распространения метастазов в сердце:
•прямая инфильтрация (например, при новообразованиях средостения и легких);
•гематогенное (при отдаленных первичных опухолях);
•лимфогенное - через трахеомедиастинальное лимфатическое сплетение (например, перикардиальный карциноматоз при карциноме легких);
•внутриполостной выпот (через нижнюю полую вену и легочные вены).
При установлении клинического диагноза и известном первичном источнике визуализация сердца позволяет определить его вторичное поражение. В случае обнаружения перикардиального выпота и внесердечной опухоли неизвестной локализации помощь в диагностике оказывает цитологическое исследование жидкости, полученной при пункции перикарда, или биопсия перикарда посредством торакотомии. Дифференциальную диагностику следует проводить с инфекционно-воспалительными заболеваниями перикарда. При метастазировании аденокарциномы легких в перикард дифференциальную диагностику проводят с доброкачественной мезотелиальной гиперплазией, возникающей при остром неопухолевом перикардите со злокачественной мезотелиомой трубчатого гистологического типа. В этом случае требуется проведение иммуногистохимического исследования. В отличие от аденокарциномы, клетки мезотелиомы дают положительную реакцию на виментин и калретинин.
Биопсия эндомиокарда оказывает помощь в диагностике внутриполостной опухоли (см. рис. 20.9) [25]. Тем не менее выполнение иммуногистохимического исследования - непременное условие определения гистологического типа опухоли.
ХИМИОТЕРАПИЯ И ЛУЧЕВАЯ ТЕРАПИЯ. КАРДИОТОКСИЧНОСТЬ ХИМИОПРЕПАРАТОВ
При злокачественных опухолях сердца и отсутствии внесердечных метастазов можно выполнить хирургическую резекцию и даже трансплантацию сердца [87-91]. В остальных случаях единственным терапевтическим методом лечения служит химио- и лучевая терапия.
При первичных саркомах лучевую терапию проводят до хирургического лечения, что позволяет облегчить полное удаление опухоли, и после вмешательства (адъювантная терапия) для уменьшения (предотвращения) рецидивирования.
Обычно применяют профилактическую дозу 6000-6500 сГр. При неоперабельных опухолях дозу увеличивают до 7000 сГр. При использовании дозы 6000 сГр в 40% случаев отмечают развитие перикардита.
Химиотерапия включает применение антибиотиков с цитотоксической и противоопухолевой активностью, подобных тем, которые используют при лечении опухолей крови и злокачественных опухолей мягких тканей. При лечении сарком сердца по протоколам, описанным в табл. 20.3, обычно назначают антрациклины (эпирубицин и доксорубицин) в комбинации с ифосфамидом [9295].
Таблица 20.3. Протокол лечения саркомы сердца антрациклинами и ифосфамидом
|
Эпирубицин |
Ифосфамид |
|
|
|
Дозирование |
По 60 мг/м2 в день |
По 1800 мг/м2 |
|
|
в день |
|
|
|
Кратность приема |
1-й и 2-й день/каждый 21-й день |
1-5-й день/каждый 21-й день |
|
|
|
|
Доксорубицин |
Ифосфамид |
|
|
|
Дозирование |
По 50 мг/м2 в день |
По 5000 мг/м2 |
|
|
в день |
|
|
|
Кратность приема |
1-й день/каждый 21-й день |
1-й день/каждый 21-й день |
|
|
|
|
Доксорубицин |
Ифосфамид |
|
|
|
Дозирование |
По 25 мг/м2 в день в виде непрерывной инфузии |
По 2000 мг/м2 |
|
|
в день |
|
|
|
Кратность приема |
1-3-й день/каждый 21-й день |
1-5-й день/каж-дый 21-й день |
|
|
|
Назначение этих препаратов особенно рекомендовано при саркомах сердца с высокой степенью дифференцировки, что связано с высокой митотической активностью и некрозом опухоли. При агрессивных саркомах сердца, резидуальной опухоли после оперативного вмешательства и признаках отдаленных метастазов химиотерапия играет паллиативную роль в уменьшении объема образования и ослаблении симптомов, но, к сожалению, незначительно влияет на выживаемость (средняя выживаемость составляет 11 мес). Ранее авторами были опубликованы данные о пятилетней выживаемости пациента с низкодифференцированной злокачественной лейомиосаркомой [79].
Эффективность химиотерапии ограничивается кардиотоксичностью с безопасным порогом для доксорубицина 550 мг/м2, а для эпирубицина - 900 мг/м2. Опубликованы данные о трех видах кардиотоксичности антрациклинов:
•острые или подострые симптомы, возникающие сразу после введения препаратов, преходящие аритмии, синдром перимиокардита, недостаточность ЛЖ;
•хроническая токсичность в форме дилатационной кардиомиопатии, возникающая через год;
•дисфункция желудочков, манифестирующая через годы и десятилетия аритмиями и ХСН [8, 96,
97].
Частота развития декомпенсации сердца напрямую зависит от дозы: при общей дозе доксорубицина 400 мг/м2 она развивается в 0,14% случаев, при дозе 550 мг/м2 - в 7%, а при дозе 700 мг/м2 - в 18% случаев. По данным последних исследований, при введении доксорубицина в дозе 550 мг/м2 в 26% случаев развивается СН, что ставит под сомнение безопасность этой пороговой дозы [8]. Предшествующая лучевая терапия средостения может быть дополнительным фактором риска.
Поражение миокарда представлено распадом мягких тканей и потерей миофибрилл. В качестве возможного механизма этого процесса был предложен повышенный выброс кальция из эндоплазматического ретикулума с продукцией свободных радикалов и высвобождением цитокинов из макрофагов (фактор некроза опухоли-α и интерлейкин-2).
Вместо приема внутрь препаратов в таблетированной форме рекомендовано их длительное в/в введение, применение вместо доксорубицина менее токсичного эпирубицина, использование у пациентов с дозой доксорубицина, превышающей 300 мг/м2, кардиопротектеров, таких как дексразоксан. Селективный выброс доксорубицина липосомами в область опухоли может снизить кардиотоксичность, сохраняя противоопухолевую эффективность [8].
При первичных лимфомах сердца, 80% которых представлены В-клеточным подтипом, назначают химиотерапию, подобную таковой при внеузловых лимфомах (табл. 20.4). Ритуксимаб содержит химерные моно-клональные антитела против CD20-антигена. Кардио-токсичность доксорубицина снижают, применяя более низкие дозы препарата. Побочные эффекты в этом случае менее значимые, возникают в 10% случаев и представлены артериальной гипертензией, ангионевротическим оте-ком, бронхоспазмом с эпизодами гипоксии. Кроме того, развитие негативных эффектов можно контролировать, проводя соответствующее лечение.
Таблица 20.4. Протокол химиотерапии при лимфоме сердца
|
Циклофосфамид |
Доксорубицин |
Винкристин |
Преднизолон |
Ритуксимаб |
|
|
|
|
|
|
Доза, мг/м2 |
750 |
50 |
1,4 |
100 |
375 |
|
|
|
|
|
|
Кратность |
1-й день / каждый |
1-й день / |
1-й день / |
1-й день / |
1-, 8-, 15-, 22-, |
приема |
21-й день |
каждый 21- |
каждый 21- |
каждый 21- |
43-, 60-, 85-, |
|
|
й день |
й день |
й день |
106-й дни |
|
|
|
|
|
|
Следует отметить, что первичные лимфомы сердца - единственные злокачественные новообразования сердца, прогноз которых после химиотерапии относительно хороший [8].
Особая кардиотоксичность развивалась при метастазировании опухоли молочной железы, на которую воздействовали трастузумабом, содержащим моноклональные антитела против белка, кодируемого HER2 (онкоген эпидермального фактора роста человека). Его повышенная экспрессия обусловливает плохой прогноз [98]. В отличие от токсичности доксорубицина, токсичность трастузумаба менее выражена, дозонезависима и обратима. Предполагают, что антитело может препятствовать притоку и оттоку кальция из Т-трубочек и Z-дисков сакромера.
НЕОПУХОЛЕВЫЕ ОБЪЕМНЫЕ ОБРАЗОВАНИЯ
Только гистологическое исследование позволяет определить, является ли образование в сердце доброкачественной или злокачественной опухолью. При использовании визуализирующих методов исследования рекомендовано применять термин "образование", поскольку, помимо опухолей сердца, возможно обнаружение других поражений [8].
•Тромбы. Изолированное образование внутри ушка предсердия, как правило, всегда представлено тромбом. В ЛП свободно плавающее образование, похожее на шаровидный тромб, указывает на патологические изменения МК, обычно ревматической этиологии. Даже при нормальной сократительной способности сердца на верхушке ЛЖ можно обнаружить небольшие пристеночные тромбы. Часто их ошибочно принимают за миксому ЛЖ (см. рис. 20.4). Небактериальный тромботический эндокардит может имитировать папиллярную фиброэластому клапанов. При антифосфолипидном синдроме могут развиваться клапанные и неклапанные эндокардиальные тромбозы [99].
•Кардиомиопатии (см. главу 18). Фибропластический эндокардит Леффлера - рестриктивная
(облитерирующая) кардиомиопатия, обычно ассоциирующаяся с эозинофилией, аллергической реакцией или эозинофильной лейкемией. При этом обнаруживают пристеночный тромб, заполняющий верхушку и участок впадения сосудов и имеющий такие размеры, что он обтурирует МК или ТК. При визуализации сердца можно неверно диагностировать верхушечную форму гипертрофической кардиомиопатии или эндокардиальную опухоль. Эндомиокардиальная биопсия с последующим исследованием ткани поможет в дифференциальной диагностике (рис. 20.21).
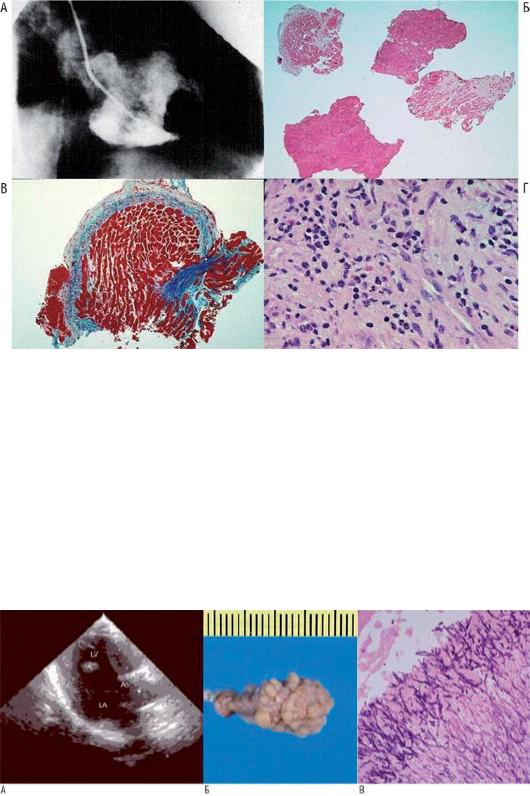
Рис. 20.21. Фибропластический эндокардит Леффлера у 61-летнего мужчины с апикальной опухолью ЛЖ. А - во время ангиографии ЛЖ обнаружена округлая опухоль, занимающая верхушку ЛЖ. Б - эндомиокардиальные биоптаты состоят из тромбов и ткани миокарда (окраска гематоксилином и эозином). В - эндокардиальное фиброзное утолщение, заметное при большом увеличении (окраска трихромом Гейденгайна). Г - в подлежащем миокарде обнаруживают воспалительную инфильтрацию с большим количеством эозинофилов (окраска гематоксилином и эозином). Изменено: Basso C., Valente M., Thiene G. Tumori del cuore. Monografie di Cardiologia. - Società Italiana di Cardiologia, 2005.
• Инфекционное поражение (см. главу 22). Образования на клапанах могут быть вегетациями инфекционного происхождения, имитирующими папиллярную фиброэластому. В области МК они могут достигать огромных размеров и симулировать эмболию миксомой предсердия. Свободно плавающие образования не всегда имеют тромботический характер, но у пациентов с иммуносупрессией могут быть грибковыми (рис. 20.22) [100]. Перикардиальные или миокардиальные кисты нередко представлены гидатидными эхинококковыми кистами, которые во избежание разрыва и распространения инфекции следует аккуратно удалять во время операции.
Рис. 20.22. Внутриполостная аспергиллома ЛЖ у 23-летнего мужчины, перенесшего химиотерапию по поводу острого миелоидного лейкоза. А - при 2D-ЭхоКГ обнаружена подвижная опухоль в полости ЛЖ. Б - удаленная опухоль продолговатой формы с неровной поверхностью на небольшой ножке. В - при гистологическом исследовании (ШИКокраска алцианом) обнаружены грибы и аспергиллы. Изменено: Vida V., Biffanti R., Thiene G. et al. Left ventricular mass after treatment with chemotherapic drugs // Circulation. - 2004. -
Vol. 109. - P. 300-301.
• Кальций. Возможно обнаружение интрамуральных или внутриполостных кальциевых камней [101], которые не всегда служат исходом дистрофического обызвествления инфекционных очагов
или опухолей, как, например, при обызвествлении миксомы. Образования могут быть настолько обширными, что способны превращать сердце в подобие каменоломни. Дистрофическое обызвествление кольца МК во время ЭхоКГ можно ошибочно диагностировать как предсердножелудочковое образование.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Хирургическое лечение новообразований сердца стало доступным с внедрением в 50-х годах XX в. операций на открытом сердце, сопровождающихся остановкой сердца и экстракорпоральным кровообращением. При перикардиальных опухолях резекцию можно выполнять посредством торакотомии без необходимости остановки кровообращения. Принимая во внимание, что 90% первичных опухолей сердца имеют внутриполостной характер, они требуют открытого сердца и (или) исключения из кровообращения больших артерий [102-104].
До разработки неинвазивной визуализации сердца показанием к операции ошибочно считали поражение клапанов, поскольку диагностика часто была основана на простой аускультации, рентгенографии и клинических данных. В клинике Мэйо до введения в 80-х годах ЭхоКГ примерно
в25% случаев хирургического удаления миксом предоперационным диагнозом был стеноз МК ревматической этиологии [5]. В настоящее время благодаря УЗИ ни один пациент с образованием
всердце не был прооперирован без визуализации. КТ и МРТ предоставляют данные о распространении инфильтрации и характеристиках тканей. Описание ПЖ сердца позволяет установить давление в ЛА, а селективная ангиография визуализирует разветвления венечных артерий, обструктивные атеросклеротические бляшки и позволяет определить степень васкуляризации образования.
Типичный доступ к доброкачественным опухолям - медиальная стернотомия, сопровождающаяся подключением экстракорпорального кровообращения с двухполостным дренажем. В связи с хрупкостью большинства внутриполостных сердечных опухолей при операциях на сердце рекомендованы спокойные манипуляции ("техника неприкосновенности"). Интраоперационная трансэзофагеальная ЭхоКГ позволяет определить локализацию опухоли, направить канюлю, открыть полости сердца и следить за целостностью опухоли во время хирургических манипуляций.
После запуска экстракорпорального кровообращения достигают умеренной гипотермии туловища (28-32 °С), после чего сердце отключают от системного кровообращения путем накладывания клипс на восходящую аорту и останавливают во время диастолы путем введения в коронарное русло большого количества калия (антероградно через венечные артерии из аортального русла или ретроградно через коронарный синус), тем самым вызывая паралич органа.
В дальнейшем в соответствии с локализацией опухоли хирургический доступ меняют на правую, левую или комбинированную атриотомию. В любом случае желателен тщательный обзор всех отделов сердца.
Широкий хирургический доступ - непременное условие резекции опухоли одним блоком, включая имплантационную основу. Аспирированную кровь, окружающую опухоль, не возвращают в экстракорпоральную циркуляцию во избежание возможной диссеминации злокачественных эмболов.
При подозрении на миксому ЛП, часто связанную с овальной ямкой, хирургический доступ можно выполнить через ПП или транссептально. Для расширения доступа к образованию часто применяют левую атриотомию. Область резекции вокруг основания опухоли расширяют минимум на 5 мм, что позволяет соблюсти радикальность удаления с целью предотвращения рецидива. В случае фиксации миксомы к свободной стенке последнюю удаляют с опухолью на всю толщину или, если это невозможно, с глубокой эндомиокардиальной экскавацией. Во время резекции во избежание распада с образованием следует обращаться аккуратно. После резекции для удаления фрагментов злокачественного новообразования полости сердца обильно орошают изотоническим раствором хлорида натрия. После удаления право- и левосторонних образований обследование ЛА и аорты рекомендовано выполнять через отдельные артериотомические отверстия, что исключает миграцию фрагментов злокачественного образования. Закрытие удаленного дефекта перегородки предсердия осуществляют собственным перикардиальным лоскутом или лоскутом из политетрафторэтилена.
При внутриполостном новообразовании желудочка хирургический доступ осуществляют через ипсилатеральную атриотомию, если образование локализуется в месте впадения сосудов в желудочек, или через аортальную либо пульмональную артериотомию при его расположении в месте выхода сосудов из желудочка. При подозрении на новообразования клапанов хирургическая техника должна быть направлена на сохранение нативных клапанов с полным удалением опухоли и места ее прикрепления. При этом можно применять реконструктивные методики с
использованием собственного перикарда. Если консервативный подход недоступен, то необходима замена клапанов биологическими протезами или механическими устройствами.
При интрамуральном расположении новообразования в желудочках необходима вентрикулотомия с энуклеацией опухоли.
Если при энуклеации существует риск значительного уменьшения миокарда желудочка или повреждения важных структур сердца (клапаны, проводящая система, перегородка), то в качестве крайней меры выполняют трансплантацию сердца [105]. При больших опухолях желудочков альтернативой пересадке сердца [106] служит кардиомиопластика (см. главу 23).
После отключения от экстракорпорального крово-обращения следует провести чреспищеводную ЭхоКГ, позволяющую оценить объем резекции, целостность клапанов, функционирование миокарда и отсутствие остаточных анастомозов. Для исключения злокачественного поражения обязательным считают гистологическое исследование удаленного образования.
Госпитальная летальность после операций, выполненных по поводу доброкачественных внутриполостных опухолей, таких как миксома и папиллярная фиброэластома, не превышает 5%, а выживаемость и качество жизни при спорадических доброкачественных новообразованиях очень высоки.
Рецидив миксомы может быть следствием неполного удаления или диссеминации фрагментов новообразования, но чаще возникает при семейной форме миксомы генетического происхождения, которая часто представлена многоцентровыми поражениями.
При злокачественных новообразованиях сердца следует принимать во внимание несколько вариантов лечения. Удаление, которое редко бывает полным при инфильтрирующих саркомах, можно выполнять даже при глубокой гипотермии (17 °С) с остановкой сердца, что позволяет очистить операционное поле насколько это возможно. Также проводят полное удаление сердца с восстановлением ex vivo и последующей установкой аутотрансплантата. Одновременное применение хирургической резекции и адъювантной химиотерапии может улучшить выживаемость.
В редких случаях правосторонних злокачественных опухолей операцию по Фонтену (наложение кавопульмонального или атриопульмонального анастомоза для шунтирования правых отделов сердца) можно считать паллиативной процедурой.
Ортотопическую трансплантацию сердца (см. главу 23) также выполняют в нерезектабельных случаях, но ее можно рекомендовать только при отсутствии метастазов.
Хорошие результаты получают при доброкачественных опухолях. При злокачественных новообразованиях средняя выживаемость низкая. В настоящее время обсуждаются показания к пересадке сердца, но, учитывая недостаток донорских сердец, прогноз обычно очень плохой. При метастазировании в легкие комбинированную пересадку сердца и легких можно считать крайней мерой.
Вторичные опухоли сердца также можно удалить хирургическим путем. Возможно проведение паллиативных процедур, направленных на облегчение симптомов и установление диагноза (субксифоидная перикардиотомия с наружным дренажем и биопсией, плевроперикардиальный дренаж).
Поддиафрагмальные опухоли (карцинома почек, гепатокарцинома, карцинома яичника) могут прорастать в нижнюю полую вену и распространяться до ПП. 10% карцином почек инфильтрируют нижнюю полую вену и 40% из них достигают ПП. Опухолевый тромб обычно прилипает к эндотелию полой вены или эндокарду ПП. Цель операции - удаление первичного поражения и предотвращение его распространения по нижней полой вене к ПП. При карциноме почки в первую очередь выполняют селективную катетеризацию верхней полой вены и восходящей аорты, а затем в условиях глубокой гипотермии и остановки сердца вскрывают ПП и удаляют образование из предсердия и нижней полой вены с эндокардиальным (эндотелиальным) расщеплением и ровным расслоением. После проверки полости ПП и аспирации крови, которую не возвращают в систему экстракорпорального крово-обращения, выполняют поперечный разрез почечной вены и нефрэктомию. Результаты нефрэктомии, совмещенной с резекцией опухолевого тромба из нижней полой вены и ПП, хорошие. В 75% случаях регистрируют пятилетнюю выживаемость [107, 108].
ДАЛЬНЕЙШИЕ ПЕРСПЕКТИВЫ
В ближайшем будущем планируется предпринять следующие шаги.
Улучшение диагностики. Опухолевую природу и гистологический тип образований сердца в настоящее время можно определить только гистологически. При совершенствовании технологий
контрастная ЭхоКГ, МРТ и КТ с высокой чувствительностью и специфичностью позволят определить патогномоничные характеристики тканей и дать фундаментальные диагностические, терапевтические и прогностические заключения.
Совершенствование хирургического и интервенционного лечения. Резекцию опухолей сердца выполняют через стернотомию с помощью экстракорпорального кровообращения и остановки сердца. Для минимизации хирургической травмы при поражении клапанов и венечных артерий в настоящее время применяют мини-инвазивную технику и роботизированную хирургию. В дальнейшем небольшие опухоли можно будет удалять без торакотомии.
Прогресс в понимании развития и прогрессирования рака. Лечение злокачественных новообразований основано на гистологической дифференцировке, резектабельности и существовании или отсутствии метастазов. Общепризнано, что выполнение вмешательства после возникновения метастазов неэффективно, в связи с чем приложены большие усилия для определения молекулярных механизмов, регулирующих злокачественную трансформацию, и понимания молекулярной основы метастазирования. Использование в качестве модели трансгенных мышей может пролить свет на патогенез саркомы сердца и позволит применить новые терапевтические достижения. Помимо этого, необходима разработка менее токсичных химиотерапевтических препаратов.
Знания об эпидемиологии. Опухоли сердца, особенно первичные злокачественные новообразования, обнаруживают редко. Для оценки эпидемиологии, распространения, гистологических типов и терапевтической эффективности необходима национальная и международная регистрация клинических исследований схем химиотерапии с последующим наблюдением и прогнозом. Необходимо учредить центральные базовые лаборатории клинической визуализации и гистопатологического исследования. Эта задача поставлена перед Европейским обществом кардиологов.
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Basso C., Valente M., Poletti A. et al. Surgical pathology of primary cardiac and pericardial tumours // Eur. J. Cardiothorac. Surg. - 1997. -
Vol. 12. - P. 730-737.
Burke A.P., Virmani R. Tumours of the Heart and Great Vessels, 3rd edn., 1996. Washington DC: Armed Forces Institute of Pathology.
Butany J., Nair V., Naseemuddin A. et al. Cardiac tumours: diagnosis and management // Lancet Oncol. - 2005. - Vol. 6. - P. 219-228.
Travis W.D., Brambilla E., Muller-Hermelink H. et al. Pathology and Genetics of Tumours of the Lung, Pleura, Thymus and Heart. - 2004. - Lyon: IARC Press.
СПИСОК ЛИТЕРАТУРЫ
1.Mahaim I. Les Tumeurs et les Polypes du Coeur: Etude Anatomoclinique. Paris: Masson.
2.Prichard R.W. Tumors of the heart: review of the subject and report of 150 cases // Arch. Pathol. - 1951. - Vol. 51. - P. 98-128.
3.Goldberg H.P., Glenn F., Dotter C.T. et al. Myxoma of the left atrium: diagnosis made during life with operative and post-mortem findings // Circulation. - 1952. - Vol. 6. - P. 762-767.
4.Craafoord C. Panel discussion on late results of mitral commissurotomy. In Lam CR (ed.). International Symposium on Cardiovascular Surgery. - 1955. - Philadelphia, PA: Saunders. - P. 161-178.
5.Wold L.E., Lie J.T. Cardiac myxomas: a clinicopathologic profile // Am. J. Pathol. - 1980. - Vol. 101. - P. 219-240.
6.Columbi R. De Re Anatomica. Lib. XV, 1559. Venetiis: Nicolai Bevilacquae. - P. 267.
7.Lam K.Y., Dickens P., Chan A.C. Tumors of the heart. A 20-year experience with a review of 12,485 consecutive autopsies // Arch. Pathol. Lab. Med. - 1993. - Vol. 117. - P. 1027-1031.
8.Basso C., Valente M., Thiene G. Tumori del cuore. Monografie di Cardiologia. Società Italiana di Cardiologia, 2005. Novate-Milan: Arti Grafiche Color Black.
9.Travis W.D., Brambilla E., Muller-Hermelink H. et al. Pathology and genetics of tumours of the lung, pleura, thymus and heart. - 2004. - Lyon: IARC Press.
10.Basso C., Valente M., Poletti A. et al. Surgical pathology of primary cardiac and pericardial tumours // Eur. J. Cardiothorac. Surg. - 1997. - Vol. 12. - P. 730-737.
11.Burke A.P., Virmani R. Tumours of the heart and great vessels, 3rd edn. - 1996. - Washington DC: Armed Forces Institute of Pathology.
12.Butany J., Nair V., Naseemuddin A. et al. Cardiac tumours: diagnosis and management // Lancet Oncol. - 2005. - Vol. 6. - P. 219-228.
13.Burke A., Jeudy J., Virmani R. Cardiac tumours: an update // Heart. - 2008. - Vol. 94. - P. 117-123. 14.Shapiro L.M. Cardiac tumours: diagnosis and management // Heart. - 2001. - Vol. 85. - P. 218-222.
15.Meng Q., Lai H., Lima J. et al. Echocardiographic and pathologic characteristics of primary cardiac tumors: a study of 149 cases // Int. J. Cardiol. - 2002. - Vol. 84. - P. 69-75.
16.Perez de Isla L., De Castro R., Zamorano J.L. et al. Diagnosis and treatment of cardiac myxomas by transesophageal echocardiography // Am. J. Cardiol. - 2002. - Vol. 90. - P. 1419-1421.
17.Lombardi M., Bartolozzi C. Risonanza Magnetica del cuore e dei vasi. - 2004. - Milan: Springer Verlag.
18.Kiaffas M.G., Powell A.J., Geva T. Magnetic resonance imaging evaluation of cardiac tumor characteristics in infants and children // Am. J. Cardiol. - 2002. - Vol. 89. - P. 1229-1233.
19.Hoffman U., Globits S., Schima W. et al. Usefulness of magnetic resonance imaging of cardiac and paracardiac Masses // Am. J. Cardiol. -
2003. - Vol. 92. - P. 890-895.
20.O’Sullivan P.J., Gladish G.W. Cardiac tumors // Semin. Roentge-nol. - 2008. - Vol. 43. - P. 223-233.
21.Tatli S., Lipton M.J. CT for intracardiac thrombi and tumors // Int. J. Cardiovasc. Imaging. - 2005. - Vol. 21. - P. 115-131.
22.Chiles C., Woodard P.K., Guiterriez R. et al. Metastatic involvement of the heart and pericardium: CT and MR imaging // Radiogra-phics. - 2001. - Vol. 21. - P. 439-449.
23.Poletti A., Cocco P., Valente M. et al. In vivo diagnosis of cardiac angiosarcoma by endomyocardial biopsy // Cardiovasc. Pathol. - 1993. -
Vol. 2. - P. 89-91.
24.Basso C., Stefani A., Calabrese F. et al. Primary right atrial fibrosarcoma diagnosed by endocardial biopsy // Am. Heart J. - 1996. - Vol. 131. - P. 399-402.
25.Testolin L., Basso C., Pittarello D. et al. Cardiogenic shock due to metastatic cardiac lymphoma: still a diagnostic and therapeutic challenge // Eur. J. Cardiothorac. Surg. - 2001. - Vol. 19. - P. 365-368.
26.Reynen K. Cardiac Myxomas // N. Engl. J. Med. - 1995. - Vol. 333. - P. 1610-1617.
27.Salyer W.R., Page D.L., Hutchins G.M. The development of cardiac myxomas and papillary endocardial lesions from mural thrombus // Am. Heart J. - 1975. - Vol. 89. - P. 4-17.
28.Valente M. Structural profile of cardiac myxoma // Appl. Pathol. - 1983. - Vol. 1. - P. 251-263.
29.Pucci A., Gagliardotto P., Zanini C. et al. Histopathologic and clinical characterization of cardiac myxoma // Am. Heart J. - 2000. - Vol. 140. - P. 134-138.
30.Ferrans V.J., Roberts W.C. Structural features of cardiac myxomas. Histology, histochemistry, and electron microscopy // Hum. Pathol. - 1973. - Vol. 4. - P. 111-146.
31.Orr J.W. Endothelioma (pseudomyxoma) of the heart // J. Path. Bacteriol. - 1942. - Vol. 54. - P. 125128.
32.Pucci A., Bartoloni G., Tessitore E. et al. Cytokeratin profile and neuroendocrine cells in the glandular component of cardiac myxoma // Virchows. Arch. - 2003. - Vol. 443. - P. 618-624.
33.Bortolotti U., Mazzucco A., Valfrè C. et al. Right ventricular myxoma: review of the literature and report of two patients // Am. Thorac. Surg. - 1982. - Vol. 33. - P. 277-284.
34.Basso C., Fasoli G., Casarotto D. et al. Unusual left ventricular mass // Circulation. - 1998. - Vol. 98. - P. 1036-1037.
35.Jourdan M., Bataille R., Seguin J. et al. Constitutive production of interleukin-6 and immunologic features in cardiac myxomas // Arthritis. Rheum. - 1990. - Vol. 33. - P. 398-402.
36.Orlandi A., Ciucci A., Ferlosio A. et al. Increased expression and activity of matrix metalloproteinases characterize embolic cardiac myxomas // Am. J. Pathol. - 2005. - Vol. 166. - P. 1619-1628.
37.Basso C., Valente M., Casarotto D. et al. Cardiac lithomyxoma // Am. J. Cardiol. - 1997. - Vol. 80. - P. 1249-1251.
38.Carney J.A. Differences between non-familial and familial cardiac myxoma // Am. J. Surg. Pathol. - 1985. - Vol. 9. - P. 53-55.
39.Carney J.A., Hruska L.S., Beauchamp G.D. et al. Dominant inheritance of the complex of myxomas, spotty pigmentation, and endocrine overactivity // Mayo. Clin. Proc. - 1986. - Vol. 61. - P. 165-172.
40.Kirschner L.S., Sandrini F., Monbo J. et al. Genetic heterogeneity and spectrum of the PRKAR1A gene in patients with the Carney complex // Hum. Mol. Genet. - 2000. - Vol. 9. - P. 3037-3046.
41.Sun J.P., Asher C.R., Yang X.S. et al. Clinical and echocardiographic characteristics of papillary fibroelastomas: a retrospective and prospective study in 162 patients // Circulation. - 2001. - Vol. 103. - P. 2687-2693.
42.Ngaage D.L., Mullany C.J., Daly R.C. et al. Surgical treatment of cardiac papillary fibroelastoma: a single center experience with eighty-eight patients // Ann. Thorac. Surg. - 2005. - Vol. 80. - P. 1712-1718.
43.Valente M., Basso C., Thiene G. et al. Fibroelastic papilloma: a not-so-benign cardiac tumor // Cardiovasc. Pathol. - 1992. - Vol. 1. - P. 161-166.
44.Basso C., Bottio T., Valente M. et al. Primary cardiac valve tumours // Heart. - 2003. - Vol. 89. - P. 1259-1260.
45.Scalia D., Basso C., Rizzoli G. et al. Should right-sided fibroelastomas be operated upon? // J. Heart Valve Dis. - 1997. - Vol. 6. - P. 647-650.
46.Shirani J., Roberts W.C. Clinical, electrocardiographic and morphologic features of massive fatty deposits (‘lipomatous hypertrophy’) in the atrial septum // J. Am. Coll. Cardiol. - 1993. - Vol. 22. - P. 226238.
47.Heyer C.M., Kagel T., Lemburg S.P. et al. Lipomatous hypertrophy of the interatrial septum: a prospective study of incidence, imaging findings, and clinical symptoms // Chest. - 2003. - Vol. 124. - P. 2068-2073.
48.Basso C., Barbazza R., Thiene G. Images in cardiovascular medicine. Lipomatous hypertrophy of the atrial septum // Circulation. - 1998. - Vol. 97. - P. 1423.
49.Burke A.P., Johns J., Virmani R. Hemangiomas of the heart: a clinico-pathologic study of 10 cases // Am. J. Cardiovasc. Pathol. - 1991. - Vol. 13. - P. 283-290.
50.Rizzoli G., Bottio T., Pittarello D. et al. Atrial septal mass: transesophageal echocardiographic assessment // J. Thorac. Cardiovasc. Surg. - 2004. - Vol. 128. - P. 767-769.
51.Nojima Y., Ishibashi-Ueda H., Yamagishi M. Cystic tumour of the atrioventricular node // Heart. - 2003. - Vol. 89. - P. 122.
52.Paniagua J.R., Sadaba J.R., Davidson L.A. et al. Cystic tumour of the atrioventricular nodal region:report of a case successfully treated with surgery // Heart. - 2000. - Vol. 83:E6.
53.Gallucci V., Stritoni P., Fasoli G. et al. Giant blood cyst of tricuspid valve. Successful excision in an infant // Br. Heart J. - 1976. - Vol. 38. - P. 990-992.
54.Freedom R.M., Lee K.J., MacDonald C. et al. Selected aspects of cardiac tumors in infancy and childhood // Pediatric. Cardiology. - 2000. - Vol. 21. - P. 299-316.
55.Becker A.E. Tumours of the heart and pericardium. In Fletcher CDM (ed.) Diagnostic histopathology of tumours. - 1995. - Edinburgh: Churchill Livingstone. - P. 7-41.
56.Padalino M., Basso C., Milanesi O. et al. Surgically treated primary cardiac tumors in early infancy and childhood // J. Thorac. Cardiovasc. Surg. - 2005. - Vol. 129. - P. 1358-1363.
57.Padalino M.A., Basso C., Moreolo G.S. et al. Left atrial myxoma in a child: case report and review of the literature // Cardiovasc. Pathol. - 2003. - Vol. 12. - P. 233-236.
58.Bosi G., Lintermans J.P., Pellegrino P.A. et al. The natural history of cardiac rhabdomyoma with and without tuberous sclerosis // Acta. Pediatr. - 1996. - Vol. 85. - P. 928-931.
59.van Slegtenhorst M., de Hoogt R., Hermans C. et al. Identification of the tuberous sclerosis gene TSC1 on chromosome 9q34 // Science. - 1997. - Vol. 277. - P. 805-808.
60.De Dominicis E., Frigiola A., Thiene G. et al. Subaortic stenosis by solitary rhabdomyoma. Successful excision in an infant following 2D echocardiogram and Doppler diagnosis // Chest. - 1989. - Vol. 95. -
P. 470-472.
61.Uzun O., Wilson D.G., Vujanic G.M. et al. Cardiac tumours in children // Orphanet. J. Rare. Dis. - 2007. - Vol. 2. - P. 11.
62.Valente M., Cocco P., Thiene G. et al. Cardiac fibroma and heart transplantation // J. Thorac. Cardiovasc. Surg. - 1993. - Vol. 106. -
P. 1208-1212.
63.Padalino M.A., Basso C., Thiene G. et al. Images in cardiovascular medicine: Giant right ventricular fibroma in an infant // Circula-tion. - 2002. - Vol. 106. - P. 386.
64.McKenney H. Congenital teratomas // Am. J. Surg. Pathol. - 2005. - Vol. 29. - P. 29-38.
65.Ferrans V.J., McAllister H.A., Jr., Haese W.H. Infantile cardiomyopathy with histiocytoid change in cardiac muscle cells. Report of six patients // Circulation. - 1976. - Vol. 53. - P. 708-719.
66.Burke A.P., Ribe J.K., Bajaj A.K. et al. Hamartoma of mature cardiac myocytes // Hum. Pathol. - 1998. - Vol. 29. - P. 904-909.
67.Burke A.P., Gatto-Weis C., Griego J.E. et al. Adult cellular rhabdomyoma of the heart: a report of 3 cases // Hum. Pathol. - 2002. -
Vol. 33. - P. 1092-1097.
68.Rose A.G., McCormick S., Cooper K. et al. Inflammatory pseudotumor (plasma cell granuloma) of the heart. Report of two cases and literature review // Arch. Pathol. Lab. Med. - 1996. - Vol. 120. - P. 549554.
69.Burke AP, Cowan D, Virmani R. Primary sarcomas of the heart // Cancer. - 1992. - Vol. 69. - P. 387395.
70.Donsbeck A.V., Ranchere D., Coindre J.M. et al. Primary cardiac sarcomas: an immunohistochemical and grading study with long-term follow-up of 24 cases // Histopathology. - 1999. - Vol. 34. - P. 295-304.
71.Fletcher C.D.M., Unni K.K., Mertens F. World Health Organization Classification of Tumours. Pathology and genetics of tumours of soft tissue and bone. - 2002. - Lyon: IARC Press.
72.van Unnik J.A., Coindre J.M., Contesso C. et al. Grading of soft tissue sarcomas: experience of the EORTC soft tissue and bone sarcoma group // Eur. J. Cancer. - 1993. - Vol. 29. - P. 2089-2093.
73.Trojani M., Contesso G., Coindre J.M. et al. Soft-tissue sarcomas of adults: study of pathological prognostic variables and definition of a histopathological grading system // Int. J. Cancer. - 1984. - Vol. 33. - P. 37-42.
74.Hermann M.A., Shankerman R.A. Edwards W.D. et al. Primary cardiac angiosarcoma: a clinicopathologic study of six cases // J. Thorac. Cardiovasc. Surg. - 1992. - Vol. 103. - P. 655-664.
75.Garcia J.M., Gonzalez R., Silva J.M. et al. Mutational status of K-ras and TP53 genes in primary sarcomas of the heart // Br. J. Cancer. - 2000. - Vol. 82. - P. 1183-1185.
76.Okamoto K., Kato S., Katsuki S. et al. Malignant fibrous histiocytoma of the heart: case report and review of 46 cases in the literature // Intern. Med. - 2001. - Vol. 40. - P. 1222-1226.
77.Hui K.S., Green L.K., Schmidt W.A. Primary cardiac rhabdomyosarcoma: definition of a rare entity // Am. J. Cardiovasc. Pathol. - 1988. - Vol. 2. - P. 19-29.
78.Hajar R., Roberts W.C., Folger G.M. Jr. Embryonal botryoid rhabdomyosarcoma of the mitral valve // Am. J. Cardiol. - 1986. - Vol. 57. - P. 376.
79.Mazzola A., Spano J.P., Valente M. et al. Leiomyosarcoma of the left atrium mimicking a left atrial myxoma // J. Thorac. Cardiovasc. Surg. - 2006. - Vol. 131. - P. 224-226.
80.Pessotto R., Silvestre G., Luciani G.B. et al. Primary cardiac leiomyosarcoma: seven-year survival with combined surgical and adjuvant therapy // Int. J. Cardiol. - 1997. - Vol. 60. - P. 91-94.
81.Paraf F., Bruneval P., Balaton A. et al. Primary liposarcoma of the heart // Am. J. Cardiovac. Pathol. - 1990. - Vol. 3. - P. 175-180.
82.Hazelbag H.M., Szuhai K., Tanke H.J. et al. Primary synovial sarcoma of the heart: a cytogenetic and molecular genetic analysis combining RT-PCR and COBRA-FISH of a case with a complex karyotype // Mod. Pathol. - 2004. - Vol. 17. - P. 1434-1439.
83.Gowda R.M., Khan I.A. Clinical perspectives of primary cardiac lymphoma // Angiology. - 2003. - Vol. 54. - P. 599-604.
