
- •Молекулярная физика определение вязкости воздуха методом истечения из капилляра
- •Лабораторная работа № 19. "определение вязкости воздуха методом истечения из капилляра".
- •Внутреннее трение (вязкость)
- •2.Явление внутреннего трения. Коэффициент внутреннего трения.
- •Рассмотрим ламинарное движение газа при котором движущейся газ как бы разделяется на слои, которые при своем направленном движении не перемешиваются, как бы скользят относительно друг друга.
- •3. Формула пуазейля.
- •Описание установки и метода измерения.
- •Порядок проведения работы.
- •Учебное издание
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ДИЗАЙНА И ТЕХНОЛОГИИ
КАФЕДРА ФИЗИКИ
C.М.РАЗИНОВА, И.П.ШАПКАРИН
Молекулярная физика определение вязкости воздуха методом истечения из капилляра
Методические указания к лабораторной работе №19
Утверждено в качестве методического пособия
Редакционно-издательским советом МГУДТ
МГУДТ 2004
УДК [001:53] (07)
Р - 20
Куратор РИС Козлов А.С.
Работа рассмотрена на заседании кафедры физики и рекомендована к печати.
Зав. кафедрой Шапкарин И.П.
Авторы: С.М.Разинова, доц.
И.П.Шапкарин, к.т.н., доц.
Рецензент: доц. Родэ С.В., к.ф.-м.н.
Р-20Разинова С.М. Молекулярная физика. Определение вязкости воздуха методом истечения из капилляра: методические указания к лабораторной работе №19 / Разинова С.М., Шапкарин И.П. - М.: ИИЦ МГУДТ, 2004 – 19 стр.
Методические указания к выполнению лабораторной работы №19 по теме «Молекулярная физика. Определение вязкости воздуха методом истечения из капилляра» содержит теоретический раздел, посвященный основам внутреннего трения (вязкости) газов и жидкостей, а также описание установки и принципа измерений, порядок выполнения работы, контрольные вопросы для допуска и защиты лабораторной работы.
Предназначен для студентов специальностей: 06.08, 17.07, 21.02, 22.03, 25.06, 25.08, 25.09, 28.10, 28.11, 28.12, 33.02.
УДК [001:53] (07)
© Московский государственный университет
дизайна и технологии, 2004
Лабораторная работа № 19. "определение вязкости воздуха методом истечения из капилляра".
ЦЕПЬ РАБОТЫ: ознакомление с теорией вязкого трения, определение опытным путем вязкости воздуха, длины свободного пробега и эффективного диаметра молекул воздуха.
ПРИБОРЫ И ПРИНАДЛЕЖНОСТИ: установка для определения вязкости
воздуха, секундомер, барометр, термометр.
ВВЕДЕНИЕ
Внутреннее трение (вязкость)
Длина свободного пробега. Эффективный диаметр молекулы.
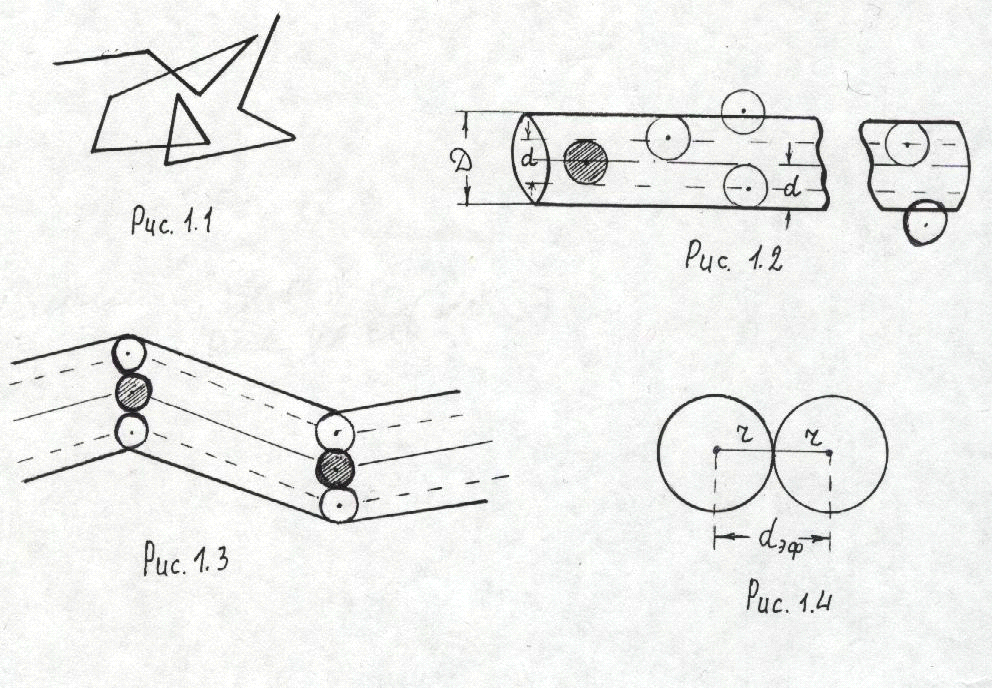
Рассмотрим идеальный газ, в котором пренебрегают силами взаимодействия между молекулами. Тогда можно считать, что молекулы между столкновениями движутся прямолинейно. В результате столкновения направление скорости молекулы изменяется, после чего она снова движется прямолинейно. Траектория движения молекулы в газе представляет собой, таким образом, ломаную линию, подобную, изображенной на рис. 1.
Среднее
число столкновений z,
испытываемых молекулой газа в единицу
времени, можно вычислить из весьма
простых соображений. Молекулы будем
считать твердыми упругими шариками
радиуса r.
Пусть одна молекула движется по прямой
в газе, в котором частицы равномерно
распределены по объему, так что в единице
объема находится n
молекул. Предположим сначала, что все
молекулы, кроме одной, (она на рис. 2
заштрихована) находятся в покое. Тогда
движущаяся молекула, пройдя за время
t
путь, равный произведению ее средней
скорости
![]()
на время t,
столкнется со всеми молекулами, которые
окажутся на ее пути. Это будут те молекулы,
центры которых расположены в объеме
цилиндра длиной
на время t,
столкнется со всеми молекулами, которые
окажутся на ее пути. Это будут те молекулы,
центры которых расположены в объеме
цилиндра длиной
![]() t
и диаметром D,
вдвое большем диаметра молекулы d
(рис .2). Траектория молекулы "зигзагообразная",
как это показано на рис. 3, однако,
результат рассуждений не изменится,
если мысленно выпрямить ломаный цилиндр,
изображённый на рис. 3. Объём V
этого цилиндра равен V=ctD2/4=cd2t,
а число молекул в нём N=
nV
= cd2nt.
Таким образом, число столкновений z,
которые испытывает движущаяся молекула
в единицу времени, будет равно
t
и диаметром D,
вдвое большем диаметра молекулы d
(рис .2). Траектория молекулы "зигзагообразная",
как это показано на рис. 3, однако,
результат рассуждений не изменится,
если мысленно выпрямить ломаный цилиндр,
изображённый на рис. 3. Объём V
этого цилиндра равен V=ctD2/4=cd2t,
а число молекул в нём N=
nV
= cd2nt.
Таким образом, число столкновений z,
которые испытывает движущаяся молекула
в единицу времени, будет равно
![]()
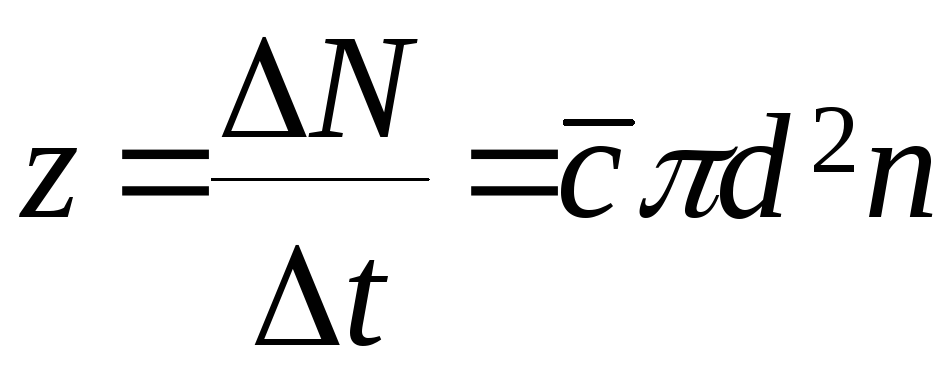 . (1)
. (1)
Входящий в формулу (1) диаметр d молекулы называется ЭФФЕКТИВНЫМ ДИАМЕТРОМ ( dэф ). Он равен минимальному расстоянию на которое сближаются при столкновении центры двух молекул. Молекулы идеального газа подобны упруго сталкивающимся шарам, поэтому эффективный диаметр равен удвоенному радиусу молекулы (рис. 4). В случае реального газа при сближении молекул начинают действовать силы отталкивания, поэтому в момент их столкновения dэф 2r.
Следует
учесть, что на самом деле движется не
одна, а все молекулы газа. Это значит,
что в выражении (1) для Z
должна входить не просто скорость
![]() молекулы относительно стенок сосуда,
а скорость сотн.
относительно тех молекул, с которыми
она сталкивается. Приняв во внимание
максвелловское распределение молекул
по скоростям, можно доказать, что эти
скорости связаны соотношением:
молекулы относительно стенок сосуда,
а скорость сотн.
относительно тех молекул, с которыми
она сталкивается. Приняв во внимание
максвелловское распределение молекул
по скоростям, можно доказать, что эти
скорости связаны соотношением:
сотн.
=![]()
![]() .
(2)
.
(2)
Тогда для среднего числа столкновений молекулы в единицу времени получим формулу:
z
=
![]()
![]()
d 2эф
n .
(3)
d 2эф
n .
(3)
Зная
число столкновений, испытываемых одной
молекулой в единицу времени, легко
вычислить среднюю
длину
свободного
пробега
![]() ,
которая определяется средним расстоянием,
которое проходит молекула между двумя
последовательными столкновениями
с другими молекулами. За время t
молекула проходит некоторый зигзагообразный
путь, равный
,
которая определяется средним расстоянием,
которое проходит молекула между двумя
последовательными столкновениями
с другими молекулами. За время t
молекула проходит некоторый зигзагообразный
путь, равный
![]() t
. Изломов на этом пути столько, сколько
произошло столкновений, так как каждый
излом вызван столкновением. Тогда
среднюю длину свободного пробега
t
. Изломов на этом пути столько, сколько
произошло столкновений, так как каждый
излом вызван столкновением. Тогда
среднюю длину свободного пробега
![]() можно вычислить, разделив пройденный
за время t
путь на число столкновений z
за это время:
можно вычислить, разделив пройденный
за время t
путь на число столкновений z
за это время:
![]() ,
(4)
,
(4)
или, подставив вместо z его значение из (3), получим для длины свободного пробега выражение:
![]() , (5)
, (5)
т.е. чем больше концентрация молекул n и больше перекрываемая каждой молекулой площадь (чем больше d2эф) тем меньше свободный пробег.
Концентрация n молекул газа, давление газа p и его термодинамическая температура Т связаны с основным уравнением состояния идеального газа
p = n к T, (6)
где к = 1,3810-23 Дж/К - постоянная Больцмана; Т - термодинамическая температура по Кельвину.
С учетом выражения (6) выражение (5) примет вид:
![]() .
(7)
.
(7)
Следовательно, длина свободного пробега обратно пропорциональна давлению газа.
