
Полезные материалы за все 6 курсов / Учебники, методички, pdf / учебник-1-часть-2017
.pdf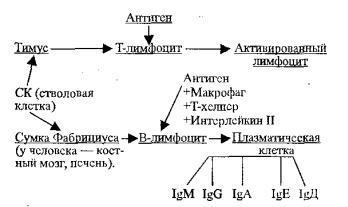
тигена (антегеннезависимая дифференцировка). В последующем на мембране Т и В-лимфоцитов появляются рецепторы, с помощью которых они распознают антиген и на него реагируют. Для В-лимфоцитов это IgM, а для Т-лимфоцитов – α и β-цепи иммуноглобулинов.
Рис. 6.2. Образование сенсибилизированных лимфоцитов и иммуноглобулинов
Вселезенке, пейеровых бляшках кишечника находятся преимущественно В-лимфоциты, а в коже и периферических узлах Т- лимфоциты (регуляторные и цитотоксические). Интересно, что В- лимфоциты, секретирующие IgA находятся в основном в слизистых оболочках, а секретирующие IgM, IgG в органах.
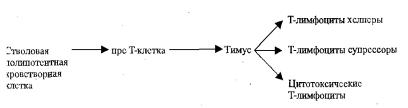
Внастоящее время известно, что в результате созревания Т-
лимфоцитов образуются три группы клеток (рис. 6.3).
Все эти клетки, созревшие в тимусе, поступают в кровь и ткани, составляя т.н. периферическую популяцию, имеющую характерные антигенные рецепторы на своих мембранах. На поверхности всех Т- лимфоцитов имеются антигенраспознающие рецепторы, позволяющие распознавать любой чужеродный антиген, попадающий в организм. Кроме того, в зависимости от наличия гликопротеинов на поверхности Т-лимфоцитов, они подразделяются на СD-4 и CD-8. Это трансмембранные белки. В тимусе имеются обе эти группы Т-лимфоцитов. Зрелые же клетки имеют на своей поверхности либо CD-4, либо CD-8, но не оба. По современным данным CD-4+ Т-лимфоциты-хелперы превращаются в Th-1 или Th-2. Th-1 принимает участие в формировании гиперчувствительности замедленного типа, а Th-2 включает синтез IgE и их фиксацию на тучных клетках, эозинофилах (гиперчувствительность наследственного типа), CD-4 рецептор обнаружен также и на мембранах макрофагов, эозинофилов, а CD-8+ - Т-лимфоциты-киллеры. CD-8+ лимфоциты обеспечивают отторжение трансплантата, аутоиммунные реакции и разрушение опухолевых и вирусинфицированных клеток. В крови первых содержится 55-60%, а вторых 20-30%. Их соотношение определяет силу иммунного ответа. Изменилось представление о Т- лимфоцитах-супрессорах. Супрессия иммунного ответа связана с рядом процессов (элиминация антигена, секрецией, торможением, пролиферацией, апоптоз активировнных лимфоцитов)После распознавания Т- лимфоцит размножается, образуя клон (группу) клеток, обладающих
81
специфичностью и обеспечивающий иммунный ответ. В крови человека содержится 75 % Т-лимфоцитов, 15 % В-лимфоцитов и 10 % нулевых клеток. Последние – это большие гранулярные лимфоциты, вызывающие гибель клеток, несущих чужеродную генетическую информацию. Выделяют две группы таких лимфоцитов: естественные киллеры, которые распознают опухолевые клетки, лимфоциты, активированные на пищевые антигены, аллоантигены плода и разрушают их; и лимфоциты, обладающие антитело-зависимой клеточной токсичностью. На их поверхности имеются Fc-рецепторы. Они взаимодействуют с клетками на поверхности которых фиксированы антитела и разрушают их. Последние лимфоциты циркулируют преимущественно в крови.
В морфологическом отношении Т-цитотоксические лимфоциты также имеют особенности, т.е. на мембране такого сенсибилизированного лимфоцита содержится около 100 000 антиген-связывающих рецепторных молекул, которые никогда не секретируются во внутреннюю среду, но при связывании которых с антигеном выделяются переваривающие лизосомальные энзимы, оказывающие цитотоксический эффект. Полагают, что Т-цитотоксическая клетка сама не лизируется и может участвовать в нескольких циклах лизиса цитокинами. Причем первоначально атакуемая клетка набухает, вероятно, за счет изменения проницаемости мембран и водно-электролитного обмена. Такого рода сенсибилизированные лимфоциты играют огромную роль в разрушении опухолевых клеток, клеток инфицированных вирусами, а также при формировании гиперчувствительности замедленного типа, в том числе и при пересадке органов.
Рис. 6.3. Основные группы Т-лимфоцитов (У. Пол)
Кроме цитотоксических Т-лимфоцитов, наиболее многочисленными являются Т-лимфоциты — хелперы. Основное их назначение заключается в активации В-клеток, Т-клеток и супрессорных Т-клеток в присутствии антигена.
Известно, что в отсутствии Т-лимфоцитов — хелперов, все вышеперечисленные клетки очень плохо активируются антигеном. Это связано с тем, что Т-хелперы образуют вещества, названные лимфокининами, с помощью которых и увеличивается синтез антител, с участием интерлейкина II стимулируются Т-цитотоксические и Т- супрессорные клетки, а также с помощью такого лимфокина, как фактор, ингибирующий миграцию макрофагов, активируется система макрофагов, в том числе в направлении усиления их фагоцитарной активности. Что касается Т-супрессоров, то они подавляют активность и цитотоксических Т-лимфоцитов и Т-хелперных, в результате чего они названы как регулирующие клетки. Функционируют они, вероятно, по
82
принципу обратной связи и обеспечивают наряду с подавлением иммунитета иммунологическую толерантность.
Как показано на рис. 6.2, в формировании гуморальной формы иммунитета принимают участие клетки, образуемые полипотентной стволовой кроветворной клеткой, но они у птиц проходят через сумку Фабрициуса (Bursa Fabricius) — отсюда и название — В-лимфоциты. У человека такую функцию выполняет костный мозг.
В-лимфоциты образуются из стволовой клетки в костном мозге и не требуют, в отличие от Т-лимфоцитов, прохождения через тимус.
Выделяют В1 и В2-лимфоциты (на мембране имеется рецептор CD-5). CD-5 В-лимфоциты продуцируют иммуноглобулины без кооперации с Т-лимфоцитами.
Первая фаза созревания В-лимфоцитов – антигеннезависимая и заключается в образовании зрелого покоящегося В-лимфоцита, на поверхности которого имеется антигенраспознающий рецептор (мономерный IgM), который взаимодействует с одним или группой близкородственных антигенов. В организме каждого человека имеется 107-109 специфических рецепторов.
Считают, что находящиеся на поверхности покоящихся В- лимфоцитов иммуноглобулины секретируются в кровь, образуя так называемые естественные антитела. Они взаимодействуют с любым попадающим в организм антигеном (бактерии, вирусы, растворимые антигены), образуя иммунный комплекс, активирующий систему комплемента и увеличивает интенсивность фагоцитоза. Выделяют тимуснезависимый и тимус-зависимый иммунный ответ. Первый формируется В-лимфоцитами при контакте их с полисахаридами капсулы бактериальной клетки с образованием клона специфически реагирующих В- клеток и при этом происходит быстрое увеличение в крови антител только одно класса (IgM). Клетки иммунологической памяти не накапливаются и через 1-2 недели секретирующие антитела клетки погибают и элиминируются. При втором (тимус-зависимом) иммунном ответе для продукции антител с Т-лимфоцитами-хелперами (CD4+клетки). При этом антиген соединяется с антигенраспознающим рецептором В- лимфоцита, поглощается им и переваривается с последующим появлением компонентов антигена на поверхности мембраны и образованием комплекса с молекулами гистосовместимости класса II. Этот комплекс распознается рецепторами Т-лимфоцитов-хелперов (CD4+), а последний образуя интерлейкины (ИЛ-2, 4, 5) стимулирует образование клона В- лимфоцитов их дифференциацию в плазматические клетки. Для этого кроме образующих интерлейкинов необходима связь белков находящихся на мембране Т- и В-лимфоцитов (костимулирующие факторы). На Т-лимфоцитах – это CD40 L, а на В-лимфоцитах CD40. только в этом случае образуются плазматические клетки, которые секретируют вначале IgM, а затем синтез иммуноглобулинов переключается на IgG, IgA, IgE, через несколько дней они погибают.
При формировании Т-зависимого иммунного ответа обязательно накапливаются клетки иммунологической памяти (В-лимфоциты), имеющие на мембране рецептор к IgG и в меньшей мере IgM. Поэтому при
83
повторном контакте с антигеном происходит быстрое и более сильное накопление антител.
Как уже говорилось, первыми синтезируются IgM, которые представляют 5 иммуноглобулинов G, соединенных в области Fc компонента. Количество IgM увеличивается при вакцинации, воспалении, системных заболеваниях. Они соединяются с мембраной грамотрицательных бактерий. На каждый новый антиген вначале образуется IgM. IgM это естественные антитела и у ребенка они образуются до контакта его с антигеном. Затем синтезируются IgG, которые циркулируют в крови и представлены четырьмя классами. IgG1-IgG4. IgG1 больше всего в сыворотке крови (70 %). Важным их свойством является проникновение через плаценту (IgG1, 3, 4) и обеспечение защиты плода и способность их активировать комплемент по классическому и альтернативному пути (IgG4). IgG – образуется в процессе гипосенсибилизации (блокирующие антитела). Образующиеся IgE антитела фиксируются на мембранах тучных клеток и базофилов и играют важную роль в развитии немедленного типа аллергических реакций, иммунитете против гельминтов. Это важный фактор защиты внутренней среды простив чужеродных антигенов, ибо если IgA на поверхности слизистых не способны инактивировать его, после проникновения он связывается с IgE на поверхности тучных клеток и базофилов с выделением вазоактивных веществ и стимуляции фагоцитоза. IgA антитела обнаружены на поверхности слизистых желудочно-кишечного, дыхательного, урогенитального тракта, а также в молоке, слезной жидкости, слюне. Они выполняют важную защитную функцию, предотвращая проникновение инфекции во внутреннюю среду организма. Особенно это важно при кормлении новорожденных детей материнским молоком, что предупреждает заселение кишечника грам-отрицательной микрофлорой, что и обеспечивает иммунитет у детей первых месяцев жизни к кишечным инфекциям. Функция IgD не совсем ясна. Полагают, что они выполняют функцию рецепторов на мембране В-лимфоцитов. Снижение уровня иммуноглобулинов в сыворотке крови (IgM, IgG, IgA) не сопровождается развитием определенных заболеваний, но закономерно ведет к склонности к инфекционным, воспалительным заболеваниям, хронизации процесса.
Развивающаяся гиперглобулинемия имеет различное патогенетическое значение. При аллергии и аутоиммунных процессах – это важный фактор повреждения. При злокачественных опухолях, их метастазах, воспалении, интоксикациях однозначную трактовку этого феномена дать трудно. Это и компенсаторная реакция организма и, возможность, дополнительного повреждения.
Имеются различия в иммунологическом ответе при первичном и вторичном контакте организма с антигеном. Это также делает понятным, почему при вакцинации требуется неоднократное введение антигена, точно так же и степень выраженности аллергической реакции будет более выражена при повторном контакте с аллергеном (рис. 6.4).
84

Рис. 6.4. Динамика титра антител при первичном (1) и вторичном (2) контакте с антигеном (Гайтон)
Нарушения иммунитета могут проявляться:
1)в снижении иммунологических реакций (иммунодефицит);
2)активации иммунологических реакций (аллергия);
3)дисфункции (гаммапатия);
4)толерантности.
Нарушения иммунитета:
А) Активация:
1.повышение иммунитета (вакцинация, воспаление, лихорадка).
2.активация иммунитета (аллергия).
Б) Снижение иммунитета (иммунодефицит): 1. врожденный (гумормальный и клеточный): а) агаммаглобулинемия
б) недостаточный синтез IgG, IgA. Последствия – склонность к инфекцмм у детей.
Врожденный клеточный – склонность к опухолям, вирусным, грибковым процессам.
При поражении стволовой клетки – нарушается клеточный и гуморальный иммунитет – плод нежизнеспособный, завершается выкидышем или гибель в раннем постнатальном периоде.
Приобретенный иммунодефицит
По механизму развития:
1.Поражение органов иммунитета (СККД, цитостатики, облучение)
2.Опосредованное подавление иммунитета (стресс, сахарный диабет, опухоли)
3.При недостатке белка (обширные ожоги, голодание, нефротический синдром, гепато-ренальная недостаточность).
85

Иммунологическая толерантность
Способность иммунной системы распозновать антиген, специфически реагировать без патологических проявлений.
1.Естественная. В 1945 году Оуэн обнаружил у телят близнецов эритроцты другого теленка. Циркулировали в крови. Введенные чужеродные эритроциты разрушались.
2.Индуцированная (вызванная) – большие дозы глюкокортикоидов, цитостатиков, введение больших дох антигена (иммунологическаий паралич, малые дозы антигена).
Дисфункция иммунитета (гаммапатия)
Наблюдается при злокачественных новообразованиях (злокачественная лимфома, плазмацитома, лимфома Вальденстрома).
Характеризуется избыточным образованием иммуноглобулинов с измененной структурой или отдельные их цепи.
Классифицируется на:
1.Моноклональные (IgG, IgA) – увеличивается один класс иммуноглобулинов.
2.Поликлональные (более часто). При этом образуется много участков плазмоклеточного перерождения костного мозга.
Следствие: повышение вязкости крови, протеинурия, возможные переломы и склонность к инфекции.
Главное назначение иммунной системы заключается в поддержании гомеостаза организма за счет формирования реакций в ответ на попадание в организм чужеродного антигена, в том числе и инфекционного происхождения, уничтожения и элиминации опухолевых клеток в организме (иммунологический надзор с подключением в последующем не только системы комплемента, но и формирования воспаления).
Иммунодефициты. Снижение интенсивности иммунитета может быть первичным (врожденным) или вторичным (приобретенным). Врожденные или наследственно обусловленные иммунодефицитные состояния могут возникать на различных уровнях формирования клеточного или гуморального иммунитета с различными последствиями для организма. При поражении стволовой клетки развитие ребенка невозможно и во внутриутробном периоде завершается выкидышем или гибелью в раннем постнатальном периоде. По данным А. Роит, иммунная система может быть восстановлена пересадкой костного мозга от брата или сестры. К моменту рождения ребенка иммунологическая система не сформирована, также как и система комплемента, т.е. у ребенка имеются явления первичного иммунодефицита. В.В. Чиркин с соавт., 2002 г. отметили интересное не зависимое от погоды колебание приобретенной иммунологической реактивности и склонность к заболеваниям, которое регистрируется ежегодно примерно за две недели до и после дня рождения и через 6 месяцев после рождения.
Впервые врожденная недостаточность гуморального типа иммунитета описана Бруттоном в 1952 году у мальчика, в крови которого отсутствовали γ-глобулины. Дети с таким дефектом склонны к повторяющимся гнойным инфекциям.
Обнаружена врожденная недостаточность IgA и IgG. Причем у детей выявляется склонность к инфекциям дыхательных путей. Кстати, де-
86
фицит IgG отмечен и у недоношенных детей, повышенная склонность к инфекции у которых хорошо известна. Нарушение переключения синтеза IgM на IgG, как первичный иммунодефицит характеризуется длительным синтезом IgM. Считают, что возбудители кишечных инфекций, поэтому не дают длительного иммунитета, т.к. не формируются клетки иммунологической памяти. Нарушения гуморального и клеточного иммунитета выявляются, как правило, сразу после рождения или в первые годы жизни. Недостаточность гуморального иммунитета проявляется рецидивирующими тяжело протекающими инфекционными процессами, вызванными инкапсулированными микроорганизмами, а недостаточность клеточного иммунитета тяжелыми, прежде всего, оппортунистическими инфекциями, вирусными и грибковыми процессами. При обследовании детей с иммунодефицитом обнаруживается снижение массы тела, задержка развития, органомегалия, дерматиты и кандидоз слизистой оболочки рта.
Вторичные (приобретенные) иммунодефициты наблюдаются:
1.При старении организма (после 60 лет возрастает склонность к инфекционным и опухолевым процессам).
2.При действии неблагоприятных экологических факторов (загрязнение воздуха, пищи) и производственных вредностей.
3.При недостаточном и избыточном питании, дефиците витаминов.
4.При инфицировании вирусом СПИДа.
5.При стрессе (у спортсменов), при шоке, опухолях.
6.Сахарном диабете.
7.При потере больших количеств белка (нефротический синдром, обширные ожоги, энтеропатии).
8.Голодании.
9.При действии ионизирующих излучений и интоксикациях (бензол, толуол).
10.Передозировке лечебных воздействий (γ-облучение, цитостатики, стероиды).
11.При хроническом лимфолейкозе, миеломе, макроглобулинемии Вальдестрема нарушается преимущественно В-система иммунитета.
12.При лимфагрануломатозе, лепре, вирусных инфекциях старадает преимущественно Т-система иммунитета.
Вцелом по механизму развития иммунодефициты можно раз-
делить на следующие группы:
1.В результате непосредственного поражения системы иммунитета (СПИД, действие цитостатиков, бензола, ионизирующих облучений, лейкозах).
2.Опосредованном подавлении иммунитета (стресс, сахарный диабет, опухоли).
3.При недостатке, потере белка или нарушении его синтеза (экзо- и эндогенное голодание, нефротический синдром, печеночная недостаточность).
Вклассическом виде приобретенный иммунодефицит развивается при инфицировании вирусом СПИДа, происходящим половым путем или при различных инъекциях жидкостей. 80 % инфицированных СПИДом погибает в первые два года, особенно вследствие пневмонии. Это связано с поражением Т-хелперов. Поэтому вследствие ослабления кооперации
87
имммунокомпетентных клеток нарушается гуморальный иммунитет. При СПИДе человек становится беззащитным, в том числе и к действию условно-патогенных микроорганизмов и цитомегаловируса.
Становится понятным, почему у больных СПИДом снижается количество лимфоцитов, невозможна или становится очень слабой иммунизация любым антигеном.
При действии ионизирующих излучений, ряда химических факторов или лечебных воздействий, типа цитостатиков или стероидов, на первый план выступает подавление иммунитета за счет торможения процессов митоза в тимусе и лимфоидных узлах.
При стрессе, сахарном диабете, вследствие активации системы гипоталамус—гипофиз—кора надпочечников, увеличении количества глюкокортикоидов, тормозятся процессы митоза в тимусе и лимфоидных узлах. Поэтому на первый план выступает нарушение антителообразования. Именно поэтому и при шоках различного генеза и опухолях отмечается склонность к инфекционным процессам.
При потере больших количеств белка, при голодании возникают нарушения, особенно белкового обмена, также обязательно активируется система гипоталамус—гипофиз—кора надпочечников. Превалирует распад эндогенного белка в тканях и торможение митоза в тимусе и лимфоидных узлах, следствием которого и будет формирование приобретенного иммунодефицита.
Иммунологическая толерантность — это способность иммуно-
логической системы распознавать антиген и специфически реагировать на него без внешних патологических проявлений. Известны следующие формы иммунологической толерантности:
1.Естественная или врожденная (Оуэн, Медауэр).
2.Приобретенная:
а) высокодозовая (иммунологический паралич). (Фелтон); б) низкодозовая (Дрессер); в) лекарственно индуцированная.
В 1945 году Оуэн обнаружил у близнецов-телят эритроциты с антигенами другого близнеца, причем нормально функционирующие. В то время, как введение чужеродных эритроцитов заканчивается достаточно быстро их элиминацией. Было сделано предположение, что во внутриутробном периоде чужеродный антиген, контактируя с иммунной системой, в последующем воспринимается как собственный антиген. Действительно, исследованиями Медавара было показано, что введение антигена в преили неонатальном периоде вызывает такое изменение иммунологической реактивности, что в последующем у взрослых введение того же самого антигена не сопровождается его элиминацией. Именно таким образом удалось добиться отсутствия отторжения трансплантанта кожи после предварительного введния этого антигена в пренатальном периоде. Механизмы врожденной иммунологической толерантности неясны. Предложено несколько гипотез: элиминация во внутриутробном периоде клона клеток, способных реагировать специфически, активация Т-супрессоров.
Иммунологический паралич. Иммунологический паралич можно индуцировать у взрослых животных введением и очень высоких и низких доз антигена. Причем белковые антигены более толерантны в растворимом, нежели агрегированном состоянии, поскольку контакти-
88
руют с лимфоцитами без предварительной обработки их макрофагами. При этом было показано, что при высоких дозах Т-лимфоциты неспособны отвечать на антиген, а при низких — Т- и В-клетки. Полагают, что основное значение в иммунологической толерантности принадлежит Т-клеткам. Вероятно, и естественная иммунологическая толерантность связана с постоянным контактом циркулирующих аутоантигенов. Однако при небольшой концентрации антигена и слабой склонности к нему В-клеток активация Т-клеток может также происходить.
Лекарственно индуцированная толерантность воспроизводится введением больших доз глюкокортикоидов или цитостатиков и направлена на угнетение иммунитета.
Гаммапатии. Гаммапатии представляют собой расстройства иммунной системы, наблюдаемые при различных патологических процессах и характризующиеся увеличением гамма-глобулинов в крови. Это обусловлено появлением клона клеток, синтезирующих отдельные группы иммуноглобулинов или иммуноглобулины с измененной структурой или же, наконец, отдельные их цепи (Р.В. Петров).
По происхождению иммуноглобулины классифицируются на моно- и поликлональные. При моноклональных гаммапатиях увеличивается один класс иммуноглобулинов или их цепи. Клинически это проявляется в виде злокачественных новообразований (миелома Вальденстрема, злокачественная лимфома, плазмоцитома). При моноклональных гаммапатиях увеличиваются преимущественно IgG и IgA.
Чаще встречаются поликлональные гаммапатии, при которых наблюдается много участков плазмоклеточного перерождения костного мозга. Обычно увеличение гамма-глобулинов в крови повышает вязкость крови, кровоточивость (из-за связывания с плазменными факторами крови), нарушает микроциркуляцию, усиливает преципитацию ниже 37 °С, протеинурию. Возможны переломы костей и присоединение инфекции.
ГЛАВА 7. ФОРМИРОВАНИЕ АЛЛЕРГИЧЕСКИХ РЕАКЦИЙ
Учение об аллергии возникло в начале XX века, но ему предшествовало активное накопление знаний. Так, древнегреческие врачи описали гибель человека от укуса пчелы. Загадочная смерть сегодня рассматривается нами как печальный финал анафилактического шока. В средние века Авиценна дал классическое описание заболевания, именуемого сегодня бронхиальной астмой. Джон Босток систематизировал клинические признаки сенной лихорадки, а английский врач Чарльз Блекли в 1873 году установил ее причину, указав на этиологическое значение пыльцы цветов и трав.
Однако до начала XX века аллергические заболевания описывались только эпизодически. С 90-х годов XIX века, когда с целью лечения стали применять лечебные сыворотки, которые назначались неоднократно одному и тому же больному, врачи смогли отметить появление тяжких клинических признаков в виде резкого испуга, побледнения, падения артериального давления. Такое состояние настораживало
89
врачей, ибо создавалось впечатление, что вместо безвредной сыворотки больному введен яд.
Повышение чувствительности морских свинок к лошадиной сыворотке было отмечено в лабораториях, где эти животные использовались для титрования лечебных сывороток. В эксперименте подобные явления впервые целенаправленно исследовались французскими учеными Рише и Портье. С 1902 года они пытались найти меры предохранения против ядовитых веществ. Вот как описывает это сам Рише: «Во время специальной морской экспедиции нами было сделано несколько опытов с ядовитыми щупальцами. Вернувшись в Париж, я хотел продолжить свои изыскания, но не мог этого сделать из-за отсутствия тропических водных животных. Тогда я стал собирать актиний, которых можно добывать в любом количестве. Сначала надлежало определить токсическую дозу экстракта актиний. Я довольно быстро нашел смертельную дозу, однако необходимо было для ее воздействия выждать несколько дней, т.к. яд актиний вызывал смерть собаки лишь через довольно долгий срок — 3, 4—6 дней и 8 дней. Естественно, среди собак выжили те, которые не получили полной смертельной дозы; из экономии я сохранил их в лаборатории, чтобы позднее сделать им вторую инъекцию, ибо через 3—4 недели они оказались абсолютно выздоровевшими и ничем не отличались от нормальных собак. И вот случился экстраординарный факт. Весьма слабая доза экстракта убивала этих «выздоровевших собак». Чтобы убедиться в том, что я не ошибаюсь, я вновь проделал решающий опыт, большой сильной собаке привил 1 мл на кг веса глицеринового экстракта яда актиний. Она выжила, и через четыре недели к ней вернулась вся ее красота и сила. Однако спустя четыре недели этой собаке впрыснули 0,1 мл яда на кг веса, она через две минуты свалилась и погибла при резком кишечном кровотечении и параличе нервной системы».
Таким образом, вместо предохранения против действия ядовитых веществ ученые обнаружили повышение чувствительности, отсутствие защиты. Это состояние Рише и Портье назвали анафилаксией, что дословно означает беззащитность (ana — против, filaxis — защита). За это открытие им была присуждена Нобелевская премия.
В 1903 году Артюс, а двумя годами позже русский ученый П.П. Сахаров отметили, что повторные подкожные введения сыворотки крови с интервалами в 6—7 дней дают развитие местного воспаления после 3—6-го введения.
К тому времени относятся исследования И.И. Мечникова и его учеников, которые показали возможность выработки антител у кроликов и морских свинок по отношению к собственным сперматозоидам, эритроцитам и тканям почки.
Австрийский педиатр Пирке, изучая реакции детей при сывороточных и инфекционных заболеваниях, заметил, что переболевшие дети иначе реагируют на сыворотку и инфекционных агентов, чем здоровые: чувствительность их повышается. Это изменение реактивности Пирке в 1906 году предложил назвать аллергией. Таким образом, под аллергией Пирке подразумевал измененную, а точнее, повышенную чувствительность.
90
