
Полезные материалы за все 6 курсов / Учебники, методички, pdf / учебник-1-часть-2017
.pdf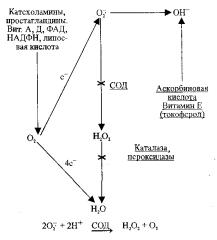
тельного заряда мембраны. Проницаемость мембраны клетки при этом повышается и, также как и в других случаях, в повреждение мембраны вовлекаются и иные механизмы (например, действие продуктов перекисного окисления липидов).
4.Повреждение мембраны может быть вызвано коагуляцией белков мембраны клетки, например, при действии кислот и щелочей, электрического тока, высокой температуры.
5.Передозировка наперстянки, используемой при лечении недостаточности сердца, нарушающей активность АТФ-азы, а следовательно, и перенос через мембрану ионов калия, натрия и кальция.
6.Наследственно-обусловленное нарушение синтеза компонентов цитоплазматической мембраны (например, акантоцитоз, при котором имеет место дефект синтеза бета-липопротеина). При этом меняются свойства мембраны, эритроциты приобретают звездчатый характер (акантоз). Позже имеет место нарушение мембран нервных клеток и
сетчатки, что в конечном итоге ведет к гибели организма.
7. Наконец, в последнее время, особенно большое значение в механизме повреждения клетки придают действию продуктов свободнорадикального окисления, перекисного окисления липидов (ПОЛ). Рассмотрим этот механизм подробнее.
Так как процессы окисления (пероксидации) в клетке осуществляются постоянно, в ходе эволюции сформировался ряд механизмов, направленных на их подавление (антиоксидация). Вещества, с одной стороны, стимулирующие окислительные процессы, а с другой, подавляющие их, получили название про- и антиоксидантов. Как показано на рис. 2.3 для усиления окисления требуется наличие, с одной стороны, кислорода, а с другой — ряда прооксидантов: катехоламинов, витаминов А и D, НАДФН, липоевой кислоты.
Рис. 2.3 Образование свободных радикалов и перекиси водорода. Основные этапы их инактивации (Ю.Э. Швинка)
21
Под влиянием вышеуказанных прооксидантов образуются такие высокохимическиактивные радикалы, как супероксид кислорода (О2-) и гидроксил (ОН-). С другой стороны, супероксид кислорода может превращаться в перекись водорода, а последняя также становится источником гидроксила.
Указанные выше радикалы кислорода и перекись водорода разрушаются с образованием сравнительно инертных в химическом отношении веществ. Как видно из рис. 2.3, супероксид кислорода в присутствии СОД (супероксиддисмудаза) и двух протонов превращается в перекись водорода и молекулу кислорода. Перекись водорода под влиянием каталазы и пероксидазы превращается в воду. Под влиянием аскорбиновой кислоты и токоферола дезактивируется гидроксил.
Если кислород присоединяет четыре электрона с дыхательных ферментов, то он способен в присутствии протонов превращаться в воду, что и происходит в норме в ходе тканевого дыхания.
Есть и некоторые другие механизмы компенсации, направленные на уменьшение содержания кислорода в клетке за счет более интенсивной его утилизации в ходе сопряжения дыхания и окислительного фосфорилирования. Это при обязательном участии таких тканевых витаминов, как А (ретинол), В2 (рибофлавин).
Вслучае действия на организм избытка кислорода, ионизирующих излучений, стресса, поступления избытка витаминов А и D или высокоактивных акцепторов электронов типа НАДФН, липоевой кислоты и других образование свободных радикалов кислорода и перекиси водорода резко возрастает. Этот первый этап т.н. «кислородной инициации» является начальным в формировании каскада реакций, в результате которых и повреждается мембрана клетки. В результате действия продуктов кислородного этапа ПОЛ на органические и неорганические компоненты цитоплазмы, ядра, мембран образуются также их высокоактивные свободнорадикальные продукты.
Причем первоначально супероксид кислорода, гидроксил, перекись водорода, а также свободные радикалы органических и неорганических соединений взаимодействуют с белками и особенно фосфолипидами мембран, вызывая, с одной стороны, их повреждение, а с другой, образуются перекиси липидов, тоже очень высокоактивные в химическом отношении. Если количество их небольшое, они инактивируются под влиянием глютатионпероксидазы и каталазы.
Если концентрация липидных перекисей высокая, то это дополнительный фактор повреждения мембраны.
Таким образом, в результате действия свободных радикалов перекисей, в том числе липидов, нарушается структура белка клеточной мембраны, а следовательно, и ферментов, при этом нарушается целостность фосфолипидного двойного слоя с образованием каналов (кластеров).
Врезультате действия радикалов и перекисей, как сказано выше, нарушается функция ферментов мембраны клетки. Поэтому следует ожидать повреждения АТФ-азы, невозможность использования АТФ для поддержания водно-электролитного баланса. При повреждении аденилатциклазы полностью нарушается рецепторная функция мембран и т.д. Это ведет к нарушению рецепции и повышению проницаемости
22
мембран клетки, изменению водно-электролитного баланса, отечности не только самой клетки, но и внутриклеточных органелл — митохондрий, лизосом с далеко идущими последствиями, вплоть до лизиса клетки (некроза).
Жизнедеятельность клеток тесно связана с функционированием ее рецепторного аппарата, особенно мембранных рецепторов. Именно за счет взаимодействия с ними осуществляется регуляция функции клетки. Известно, что мембранные рецепторы являются гликопротеидами, часть рецепторов строго фиксирована, ибо связана с цитоскелетом клетки, другие достаточно подвижны и могут не только появляться над поверхностью мембраны клетки, но и полностью исчезать за счет погружения в мембрану. С рецепторами мембраны клетки взаимодействуют все гормоны (кроме тироксина и стероидов), биологически активные вещества, опиаты, лекарства и др.
Механизм такого взаимодействия заключается в том, что первоначально активируется фермент аденилатциклаза, что способствует образованию 3,5 цАМФ и цГМФ с последующей активацией протеинкиназ клетки, что способствует изменению биохимических и функциональных процессов в клетке. Это обычно проявляется в клетке в виде изменения мембранного потенциала, биосинтеза, сокращения, секреции, размножения, с другой стороны, образование в клетке кальмодулина ингибирует активность ферментов.
Нарушение рецепторного аппарата клетки является важнейшим механизмом повреждения. Так, в ходе прогрессии опухоли снижается количество мембранных рецепторов, что делает клетки нечувствительными к регулирующим, например, гормональным влияниям. Поэтому такие клетки приобретают злокачественные свойства (инфильтративность, метастазирование, нечувствительность к лечебным воздействиям).
Наличие рецепторов к патогенным факторам — важное условие повреждения. Так, сравнивая действие дифтерийного и столбнячного токсина у холоднокровных и теплокровных, было отмечено более выраженное повреждающее действие у теплокровных, особенно морских свинок. Такое различие патогенного действия вышеназванных токсинов связано с различием мембранной рецепции клеток.
Нарушение рецепторов, а, следовательно, и функции клетки может быть связано с избытком ионов, особенно водорода. При местной ацидемии невозможен сосудосуживающий эффект адреналина.
При врожденных изменениях рецепторов клеточных мембран такие клетки становятся нечувствительными к ряду регуляторных влияний. Например, задержка роста может быть связана с нечувствительностью диафизарных клеток трубчатых костей к соматотропину. Снижение чувствительности эпителия канальцев почек нарушает реабсорбцию воды в почках.
Изменение водно-электролитного баланса в клетке и повреждение генома клетки также являются важными механизмами повреждения. При повреждении клеток возможна компенсация на уровне клеток и органов, которая проявляется в виде регенерации, гипертрофии, гиперплазии и атрофии.
23
Регенерация
Р е г е н е р а ц и я — это процесс восстановления повреждения. Этот процесс лежит в основе восстановления повреждения органелл и клеток. Поэтому в зависимости от уровня регенерации выделяют внутриклеточную и клеточную регенерацию.
При повреждении отдельной клетки хорошо восстанавливаются, например, митохондрии. Если же повреждаются многие клетки, то восстановление возможно за счет размножения клеток. Однако в ходе эволюции эта способность к размножению сформировалась неодинаково у различных клеток.
Механизмы регенерации связывают с нарушением контактного ингибирования снижением количества кейлонов в клетках и образованием специальных химических веществ — трефонов, стимулирующих размножение клеток. Кейлоны обычно вызывают ингибирование пролиферации. При повреждении клеток количество кейлонов в них уменьшается, и они приобретают способность к размножению.
Хорошо регенерируют эпителий, эндотелий сосудов, фибробласты, клетки костного мозга, лимфоидных узлов, костные клетки, надкостница, могут регенерировать печеночные клетки, клетки эндокринных желез, эпителий канальцев почек.
Ограниченная регенераторная способность характерна для миофибрилл клеток скелетных, гладких мышц.
Практически не регенерируют нервные клетки. Регенерация возможна, если повреждены аксоны нервной клетки (нервы), но этот процесс идет очень медленно. Такой вариант возможен, т.е. дистальный конец нерва (например, после травмы или перерезки) регенерирует. Если нейролемма совмещена с отделом роста аксона в дистальном направлении, регенерация идет со скоростью 20 мм в неделю.
В связи с тем, что в поврежденном участке восстановление идет не за счет специализированных клеток, а за счет эпителиальных, эндотелиальных, фибробластов, восстановление часто идет с образованием соединительнотканного, а при повреждении нервных клеток — глиального рубца. Поэтому в мышцах, нервной ткани, да и в других органах восстановление (заживление) поврежденного участка происходит за счет формирования рубца.
Гипертрофия и гиперплазия
Гиперплазия является составным элементом гипертрофии и характеризуется увеличением числа структурных элементов клетки, например, михотондрий, лизосом, эндоплазматического ретикулума и т.д. Гипертрофия (hyper — увеличение, trophe — питаю) характеризу-
ется не только увеличением внутриклеточных органелл, самой клетки, но и органа в целом. В зависимости от происхождения она подразделяется на физиологическую и патологическую. Физиологическая гипертрофия наблюдается у спортсменов (гипертрофия поперечно-полосатых мышц и сердца), беременных и рожениц (гипертрофия матки и молочных желез). Патологическая гипертрофия возникает при повреждении
24
клеток органа или увеличении функциональной нагрузки, например, гипертрофия сердца (при инфаркте миокарда), парного органа (удаление почки, легкого).
В основе механизма гипертрофии лежит дефицит энергии с последующей активацией генетического аппарата клетки. Вследствие этого усиливается синтез белка, возникает гиперплазия митохондрий и улучшение образования макроэргов, с дальнейшим усилением синтетических процессов в клетках органа.
Атрофия - это такой процесс в клетке, который характеризуется уменьшением размеров не только всех ее органелл, но и самой клетки, что обычно связано с недостатком питательных веществ, уменьшением функциональной нагрузки и регуляторных влияний. По происхождению она подразделяется на физиологическую и патологическую.
Физиологическая атрофия наблюдается с возрастом в различных тканях и органах человека (коже, слизистых, половых железах и т.д.). В условиях патологии атрофия наблюдается при голодании (в жировых и мышечных клетках), при периферическом (атрофическом) параличе, в периферических железах внутренней секреции при дефиците тиротропина, кортикотропина, гонадотропинов. Атрофия мышц развивается также при гиподинамии (например, она возможна у космонавтов) или у обездвиженных больных. Кроме того, она формируется при перерезке двигательного нерва (периферический паралич).
Таким образом, в классическом виде патологическая атрофия развивается при дефиците питательных веществ, ограничении движения, денервации, нарушении регуляции периферических желез. К этому следует добавить, что если атрофия может рассматриваться как компенсаторный процесс в выше указанных условиях на уровне клетки, то на органном, системном и организменном уровне она является фактором повреждения и вызывает серьезные расстройства.
Итак, в результате непосредственного действия повреждающего фактора или вовлечения вышеуказанных общих механизмов повреждения нарушается структура клетки. Основными морфологическими признаками повреждения являются: дистрофия, дисплазия, нарушение строения внутриклеточных органелл, некробиоз и некроз. Одновременно с этим меняется и функция клетки. Например, снижается фагоцитарная активность лейкоцитов, изменяется потенциал покоя и действия, что может проявляться изменением электрокардиограммы, миограммы, энцефалограммы и т.д.
Дистрофия (dis — расстройство, trophe — питаю) — процесс,
возникающий в клетках и тканях, в основе которого лежит нарушение питания клеток, характеризуется количественными и качественными изменениями обменных процессов.
Основу дистрофии любого происхождения составляют расстройства регуляции питания (трофики) клетки. В зависимости от характера нарушения обмена выделяют следующие дистрофии: белковые, углеводные, жировые и минеральные. Дистрофические процессы могут происходить как в специализированных клеточных элементах паренхимы, так и в строме. В зависимости от распространенности дистрофии могут быть местными или системными.
25
Белковая дистрофия связана с избыточным накоплением белка в клетках или межклеточном веществе. Накопление белка в паренхиме может проявляться образованием зернистости, капель гиалина, вакуолей. В мезенхиме это проявляется слизистым отеком, фибриноидными изменениями, фибринолизом, накоплением гиалина и амилоида. Например, при амилоидной дистрофии, которая возникает при хроническом воспалении или моноклональной пролиферации плазматических клеток, при опухолях эндокринных желез с избыточной секрецией, например, кальцитонина, инсулина. Обычно в этих случаях могут накапливаться амилоид А или Л.
Поражаются, как правило, все ткани и органы, но особенно почки, желудочно-кишечный тракт и сердце. Причем амилоид накапливается вокруг капилляров и по ходу мышечных волокон, в базальной мембране канальцев почек. За счет механического давления возникает атрофия клеток (канальцев, кардиомиоцитов), повышается проницаемость капилляров. Вследствие этого в почках за счет повышенной проницаемости капилляров и нарушения реабсорбции с мочой теряется большое количество белка, в желудочно-кишечном тракте нарушается всасывание. Поэтому развивается диарея с потерей большого количества жидкости, питательных веществ и электролитов. В кардиомиоцитах происходит сморщивание и нарушение их сократительной способности. Таким образом, амилоидоз в свою очередь является важнейшим звеном дальнейшего повреждения клетки.
Смешанные формы белковых дистрофий связаны с накоплением таких сложных продуктов, как гемосидерин, меланин, билирубин, нуклеопротеин, гликопротеин. Такие дистрофии развиваются при гемолизе эритроцитов, желтухах, подагре. Например, меланин является пигментом и в норме обнаруживается в коже, радужной оболочке глаза, надпочечниках. Образуется он меланоцитами, захватывается эпителиальными клетками, и они становятся темнее.
Разрушается меланин меланофорами, которые фагоцитируют его. Накопление меланина в клетках может носить локальный характер, например, при опухолях типа меланомы или при беременности, когда появляются пигментные пятна на лице. Возможен генерализованный характер пигментации, например, при ультрафиолетовом облучении или первичной недостаточности надпочечников. Механизм таких системных изменений обусловлен избыточной секрецией меланотропина гипофиза, который стимулирует меланоциты.
Жировая дистрофия или липидоз. Характеризуется изменением количества нейтрального жира. Это, как правило, проявляется увеличением (ожирение) или уменьшением (исхудание, кахексия) количества жира не только в жировых депо, но и других органах. Местное истощение жировой ткани (липодистрофия) наблюдается в зоне подкожного введения инсулина, при атрофии органа.
Особенно часто нарушение липидного обмена, как и белкового, встречается в таких органах, как почки, сердце, печень. В старческом возрасте, при диабете, системном ожирении жировая дистрофия развивается в клетках эндотелия сосудов (атеросклероз, где липиды откладываются в интиме, образуя бляшку, которая подвергается фиброзу).
26
Углеводная дистрофия связана с нарушением обмена сложных углеводов типа поли-, мукополисахаридов, гликопротеидов.
В классическом варианте этот вид дистрофии связан с изменением количества такого полисахарида, как гликоген. Содержание его в клетках может увеличиваться при т.н. наследственных энзимопатиях, когда из-за нарушения образования ферментов (например, глюкозо-6- фосфатазы) гликоген откладывается в клетке, но не может быть мобилизован. Эти дистрофические изменения получили названия гликогенозов. Они, как правило, характеризуются резким увеличением печени и почек и снижением количества глюкозы в крови.
С другой стороны, при голодании, сахарном диабете содержание гликогена в клетках резко уменьшается. Содержание гликопротеидов в виде муцинов возрастает в клетке при недостатке гормонов щитовидной железы. Большое накопление муцинов ведет к слизистому отеку, одному из наиболее характерных проявлений микседемы.
Минеральные дистрофии связаны с нарушением обмена железа, меди, калия, кальция. Накопление в клетках этих минералов (железа, меди, калия, кальция) наблюдаем при гемосидерозе, гепатоцеребральной дистрофии, кальцинозе, кортикостероидной недостаточности.
Потеря кальция клетками костной ткани — основа остеопороза.
Дисплазия (dis — расстройство, plaseo — образую). Это такое нарушение клетки, в основе которого лежит нарушение ее генома, следствием которого является стойкое изменение структуры и функции клетки. На первый план выступает нарушение дифференцировки клетки. Поэтому как структура, так и функция такой клетки отличается от материнской. Дисплазия наиболее характерна для опухолевых клеток, которые в ходе опухолевой прогрессии (селекции) изменяют размеры, форму, количество органелл, активируются биохимические процессы. Такие клетки, размножаясь, способны инфильтрировать здоровые ткани
иметастазировать. Нарушения внутриклеточных органелл могут проявляться в изменении их структуры, количества и, следовательно, их функциональной активности.
Некроз. В результате прямого действия разрушающего фактора на мембрану клетки или же при незначительном изменении ее проницаемости в первую очередь в клетку входят ионы натрия и кальция, вода, и она набухает. Набухание отмечается и со стороны внутриклеточных органелл с последующим разрывом их мембран, дезинтеграцией
игибелью клетки. Гибель части клеток органа или ткани в живом организме получила название некроза. При этом активированные ферменты
икалий поступают в кровеносное русло и могут использоваться как диагностический тест.
Различают две разновидности некроза:
1.Коагуляционный.
2.Колликвационный.
27
Коагуляционный некроз связан с прекращением притока крови (инфаркт) и микроскопически характеризуется изменениями ядра типа кариолизиса или кариорексиса, цитоплазмы, которая вследствие коагуляции белка становится непрозрачной. В зависимости от характера нарушения кровообращения (ишемия или венозная гиперемия) инфаркт получил название ишемического или венозного (застойного).
Колликвационный некроз возникает в органах, содержащих большое количество жидкости, наличие которой способствует активации лизосомальных ферментов, которые лизируют компоненты клетки с полным нарушением ее структуры, в результате чего некротизированный участок подвергается размягчению. Классическим примером такого некроза является абсцесс, некроз кишечника, клеток мозга.
Если клетки после некроза подвергаются самоперевариванию под действием активированных ферментов, такой процесс получил название аутолиза. Они могут также резорбироваться под влиянием фагоцитарной активности лейкоцитов.
Осложнением некроза является гангрена, при которой некротизированный участок подвергается мумификации или воздействию микроорганизмов, вызывающих гниение. При этом в последнем случае образуются неприятно пахнущие газы, а участок гангрены становится черным вследствие распада гемоглобина. Гангрена обычно развивается на фоне нарушенного кровообращения, (например, при диабете на стопе; в кишечнике при его завороте или инвагинации). При инфицировании специальным организмом возникает газовая гангрена.
Если погибают только отдельные клетки, окруженные здоровыми, это явление получило название некробиоз. При этом за счет активных метаболических процессов в клетке возникает деструкция ядра, цитоплазмы и даже клеточная дезинтеграция. Рядом лежащие клетки фагоцитируют продукты распада. Это физиологический процесс, и поэтому воспаление не развивается. В условиях патологии такое явление наблюдается при атрофии и в опухолях.
28
ГЛАВА 3. ПАТОГЕННОЕ ДЕЙСТВИЕ ФАКТОРОВ ВНЕШНЕЙ СРЕДЫ
Влияние высокой и низкой температуры на организм
Выживание человека и животных возможно при значительных колебаниях внешней температуры. Однако выраженные изменения температуры внешней среды и, следовательно, тела выше или ниже критических пределов нарушают температурный гомеостаз клеток, тканей, органов и организма в целом, что может вести не только к нарушению их функции, но и к гибели.
Степень повреждения при этом определяется интенсивностью, продолжительностью, локализацией температурного воздействия, а также реактивностью организма.
Действие низкой температуры
Основными проявлениями повреждающего действия низкой температуры являются: отморожение, гипотермия и ее крайний вариант — замерзание, холодовой шок, переохлаждение. Причем отморожение является местным процессом, а все остальные системными, т.к. проявляются на уровне целостного организма.
Отморожение. Ему предшествует местная гипотермия, т.е. снижение температуры кожи или слизистых, при котором первоначально возникают такие сосудистые расстройства микроциркуляции, как спазм сосудов, замедление кровотока, агрегация форменных элементов, стаз. В связи с уменьшением доставки кислорода и питательных веществ к поврежденному участку и расстройством его температурного гомеостаза нарушается обмен веществ в клетках, накапливаются кислые продукты, биологически активные вещества. При длительном действии низкой температуры возможно замерзание воды в клетках с последующим их разрывом.
Клинически отморожение первоначально проявляется побледнением пораженного участка кожи или слизистых, а после прекращения действия низкой температуры появляются симптомы развивающегося воспаления.
В зависимости от интенсивности и глубины повреждения кожи выделяют три степени отморожения. Первая степень характеризуется повреждением только верхнего слоя дермы и клинически проявляется покраснением. Вторая степень характеризуется повреждением всего участка дермы, резким повышением эксудации из сосудов, накоплением эксудата с образованием пузырьков. Третья степень характеризуется не только некрозом клеток дермы, но и поражением клеточных элементов мышц, соединительной ткани, костей.
Отморожение обычно развивается в выступающих частях тела — пальцах рук и ног, кончиках ушей, носа, щеках, лбу и пр., т.е. там, где расстройства кровообращения, а вместе с этим и обменные нарушения в клетках, проявляются быстрее.
29
Способствуют отморожению не только низкая температура, но и такие факторы, как высокая влажность, сильный ветер, ограничение движений, истощение организма.
Общая гипотермия. Развивается при снижении температуры тела ниже 36 °С. В клинических условиях она возможна у обездвиженных больных в состоянии наркоза, при шоке, кровопотере, часто наблюдается у детей, особенно недоношенных, температурный гомеостаз которых несовершенен, а также при длительном действии низкой внешней температуры в сочетании с высокой влажностью, ветром, ограничением движений, сниженной реактивностью организма.
Формированию гипотермии предшествует мобилизация компенсаторных реакций. В связи с раздражением холодовых рецепторов кожи и слизистых, поток информации, поступающий в ЦНС, изменяет активность различных зон коры мозга и подкорковых образований. Это ведет к активации адаптационных систем организма - симпатоадреналовой, гипоталамо-гипофизарно-надпочечниковой, щитовидной железы. Первоначально изменяются поведенческие реакции (человек уменьшает поверхность отдачи тепла — застегивает одежду, съеживается, уходит в помещение и т.д.). Одновременно с этим включаются физиологические механизмы компенсации: уменьшается частота дыхания, в связи с активацией симпато-адреналовой системы возникает спазм сосудов кожи, уменьшается кровоток, что ограничивает отдачу тепла в окружающую среду. В крови увеличивается количество глюкозы — основного энергетического субстрата. Это связано со стимуляцией процессов гликогенолиза и глюконеогенеза в печени и почках, под действием усиленного выброса в кровь контринсулярных гормонов — катехоламинов и глюкокортикоидов.
Если ограничения теплоотдачи недостаточно для поддержания температурного гомеостаза, включаются механизмы усиления теплопродукции. Появляется гусиная кожа, а затем и мышечная дрожь. Известно, что при мышечном сокращении выделяется большое количество тепла. Кроме того, за счет избытка тироксина, с одной стороны, усиливаются окислительно-восстановительные процессы, с образованием первичной теплоты, а с другой, под действием избытка катехоламинов и тироксина наблюдается набухание митохондрий с формированием разообщения сопряжения дыхания и окислительного фосфорилирования и также увеличение продукции первичной теплоты. Сочетается это обычно с потреблением большого количества кислорода. Если и эти процессы остаются недостаточными для обеспечения температурного гомеостаза, возможен распад АТФ до АДФ с выделением так называемой «вторичной теплоты».
Одновременно с этими изменениями за счет активации симпатоадреналовой системы отмечается увеличение системного артериального давления.
Если вышеописанные поведенческие, физиологические, биохимические компенсаторные реакции недостаточны для поддержания температурного гомеостаза, температура тела начинает снижаться и только в этом случае начинает формироваться гипотермия.
30
