
Полезные материалы за все 6 курсов / Учебники, методички, pdf / учебник-1-часть-2017
.pdf
|
|
|
Таблица 14.1 |
Основные клинико-лабораторные проявления |
эректильной и |
||
торпидной стадий шока |
|
|
|
|
|
|
|
Показатель |
Эректильная стадия |
|
Торпидная стадия |
АД |
повышение |
|
снижение |
|
|
|
|
Окраска кожи |
бледная |
|
бледная с синюшным от- |
|
|
|
тенком |
Пульс |
учащен |
|
учащен |
Состояние ЦНС |
возбуждение |
|
торможение |
Зрачки |
расширение |
|
|
Температура кожи |
не изменена |
|
снижена |
Выделение мочи |
олигурия |
|
олиго-анурия |
Частота дыхания |
увеличена |
|
увеличена |
Ацидоз |
нет |
|
есть |
Уменьшение секреции и моторики ЖКТ |
есть |
|
есть |
|
|
|
|
Этиология шока
Существует много классификаций, в основу которых положены различные принципы (этиологии, патогенеза). В целом по этиологическому принципу можно выделить следующие основные виды шока
(табл. 14.2).
Таблица 14.2
Этиология основных видов шока
|
Вид шока |
Этиология |
|
|
|
1. |
Травматический |
Механическая травма |
|
|
|
2. |
Геморрагический |
Кровопотеря |
|
|
|
3. |
Кардиогенный |
Инфаркт миокарда |
|
|
|
4. |
Ожоговый |
Ожоги |
|
|
|
5. Холодовой |
Низкая температура |
|
|
|
|
6. |
Анафилактический |
Иммунологический конфликт |
|
|
|
7. |
Септический |
Эндотоксины |
1. Травматический и геморрагический шок. Наблюдается при тяжелой механической травме, кровопотере, оперативных вмешательствах (при недостаточном наркозе). В клинической практике, как показывает опыт Великой Отечественной войны, врач чаще всего имеет дело с травматическим, геморрагическим шоком или их сочетанием. В мирное время эти виды шока также встречаются нередко при тяжелых травмах в результате несчастных случаев, автомобильных катастроф и т.д.
211
В эксперименте травматический шок воспроизводится, как правило, по методу Кеннона, а геморрагический путем кровопотери различной интенсивности.
2. Кардиогенный шок наблюдается при инфаркте миокарда или тяжелой и длительной стенокардии. Возникающие при этом ишемия и гипоксия миокарда являются причинами сильнейшего болевого синдрома и резкого снижения сократительной способности миокарда. Боли могут быть настолько сильными, что больной может сознательно замедлять дыхание, несмотря на предпринимаемые современные лечебные мероприятия. Летальность при кардиогеином шоке даже при современных методах лечения составляет 80-90% (Х.П.Шустер и соавт.). В эксперименте кардиогенный шок воспроизводится при моделировании тяжелого инфаркта миокарда.
3. Шок при действии физических факторов - высокой и низ-
кой температуры (ожоговый и холодовой шок). Тепло и холод вызывают чрезвычайно сильное раздражение рецепторных образований нервной системы и афферентацию. Кроме того, характерны, особенно для ожогового шока, острая плазмопотеря и гемолиз эритроцитов. Очень часто формируется острая почечная недостаточность и развивается анурия. Развитие ожогового шока зависит от интенсивности теплового воздействия и величины обожженной поверхности. Шок возникает в 39% случаев, если ожог занимает 10% поверхности тела (Д.Г.Тагдиси).
4. Анафилактический, гемотрансфузионный, анафилактоид-
ный шок. Основной причиной первых двух является иммунологический конфликт. Гемотрансфузионный шок связан с переливанием несовместимой крови. Анафилактическому шоку предшествует предварительная сенсибилизация организма аллергенами, что сопровождается иммунологическими сдвигами с преимущественным накоплением иммуноглобулинов Е, основной особенностью которых является повышенная фиксация на мембранах клеток. Шок возникает при повторном действии аллергена на такой сенсибилизированный организм. Наиболее часто анафилактический шок у человека развивается при повышенной чувствительности к лекарственным веществам-антибиотикам (пенициллин, стрептомицин), витаминам, новокаину. Описаны случаи анафилактического шока при интраназальной вакцинации против гриппа.
Наибольшая возможность развития шока наблюдается при парентеральном и ингаляционном пути проникновения аллергена в сенсибилизированный организм. Энтеральный путь проникновения аллергена также может вести к развитию анафилактического шока, но только через несколько часов.
Таким образом, в основе анафилактического шока лежит иммунологический конфликт, и процесс протекает по типу немедленной аллергической реакции.
Анафилактоидный шок развивается при введении в интактный организм либераторов гистамина и других биологически активных веществ, благодаря которым нарушается регуляция сосудистого тонуса, возникают отеки и гипотензия. Например, анафилактоидный шок у интактных крыс моделируется внутривенным введением яичного белка. Для анафилактоидного шока иммунологический конфликт не характерен.
212
5. Септический или токсико-инфекционный шок наблюдается при тяжелых инфекционных процессах (сепсисе, пневмонии). Считают, что интенсивное применение антибиотиков привело к повышению устойчивости микроорганизмов, увеличению случаев септицемии, особенно граммотрицательными микроорганизмами и, в конечном итоге, септического или токсико-инфекционного шока. Такой шок менее распространен, чем геморрагический, травматический, но занимает первое место по летальному исходу.
Чаще всего септический шок обусловлен граммотрицательной микрофлорой и примерно в 1/3 граммположительной, может быть вызван также вирусами. Граммотрицательные бактерии-кишечная палочка, протей, сальмонелы и др. образуют эндотоксины. Основной причиной шока как раз и является интенсивное поступление в кровоток экзо- и эндотоксинов, а также продуктов многих ферментов типа уреазы, декарбоксилазы, липолитических ферментов. Например, протеолитическая активность крови при сепсисе в три раза превышает активность гноя из септического очага (М.И. Лыткин и соавт.).
Эндотоксины — это липополисахаридные комплексы, они обладают цитотропизмом, нарушают проницаемость мембран клеток, лизосом, митохондриальные окислительные процессы. Прямо или опосредованно активируют четыре протеолитические ферментные системы — коагуляции, фибринолиза, комплемента и кининообразования. Они также способствуют освобождению вазоактивных веществ — гистамина, катехоламинов, кининов, простагландинов.
Указанные биологические эффекты нарушают регуляцию системного артериального давления, вызывают расстройства микроциркуляции, нарушения свертываемости в виде диссеминированного внутрисосудистого свертывания и многие другие изменения.
Шок может развиваться вследствие действия сразу нескольких этиологических факторов (механического, термического, лучевого, бактериального и т.д.), что усложняет клиническую картину и изменяет динамику и исходы шокового процесса.
В зависимости от превалирующих патогенетических расстройств при шоке выделяют три основных патогенетических звена (стадии) в развитии этого процесса: стадию нейро-эндокринных расстройств, стадию сердечно-сосудистых расстройств и стадию нарушений метаболизма.
По клиническим проявлениям выделяют эректильную, торпидную и терминальную фазы шока. Для травматического, кардиогенного, особенно ожогового, характерен интенсивный поток болевых импульсов, в то время как при септическом, анафилактическом, анафилактоидном шоке болевой эффект значительно менее выражен или отсутствует. Вероятно поэтому и клинически для первых разновидностей шока стадия возбуждения (эректильная стадия) становится значительной и более продолжительной, с подъемом системного артериального давления, в то время как для второй группы шока стадия возбуждения или очень кратковременная, или практически не заметна и сразу переходит во вторую, характерную для всех видов шока, торпидную стадию или стадию торможения, основной особенностью которой является снижение
213
системного артериального давления с резко выраженными явлениями расстройств микроциркуляции и обмена.
Шок классифицируется также и по степени тяжести, на 4 стадии: на легкий, средней тяжести, тяжелый и крайне тяжелый. В основу такой классификации положена величина системного артериального давления, хотя отмечено, что тяжесть шока не всегда соответствует степени шоковой гипотензии. Например, при легком травматическом шоке артериальное давление снижается до 100/60 мм рт.ст., и эректильная стадия переходит в торпидную, при второй — до 80/60 мм рт.ст., при третьей
— до 60/30 мм рт.ст.; при четвертой стадии состояние больного крайне тяжелое, и артериальное давление не определяется.
Общий патогенез шока
Центральная нервная система интегрирует и контролирует деятельность целостного организма. При шоке нарушается как интегративная, так и контролирующая ее деятельность. Существенным является чрезмерная мобилизация механизмов активной защиты.
Несмотря на то, что шок имеет различную этиологию, тем не менее, можно выделить четыре общих механизма-нейрогенный, гуморальный, гемодинамический и метаболический, которые являются основополагающими в возникновении и формировании шокового процесса.
В настоящее время важнейшей теорией, объясняющей механизмы формирования шокового процесса, является нейрогенная теория. Основная заслуга в ее развитии принадлежит советским ученым Э.А. Асратяну, И.Р. Петрову, А.Н. Гордиенко, СА. Селезневу и др. Согласно нейрогенной теории, шок возникает при действии экстремальных (чрезвычайно сильных) факторов внешней и внутренней среды, вызывающих расстройство гомеостаза организма вследствие нарушений нейроэндокринной регуляции. Таким образом, пусковым механизмом всех нарушений в организме при шоке является нарушение функции нервной и эндокринной систем. По мнению В.А. Долинина и В.К. Кулагина, оценка роли нервной системы в формировании шока должна включать все ее звенья — афферентное, нервные центры, эфферентное звено, эффекторы, а также эндокринные железы, которые функционируют в тесной связи и зависимости с нервной системой.
Пусковым в возникновении шока является чрезмерная афферентная импульсация, причем, она может быть болевой (из места первичного повреждения тканей) и неболевой (за счет раздражения рецепторов органов и тканей вследствие нарушений кровообращения, гипоксии, расстройств метаболизма). Избыточная информация, особенно болевая, является универсальным сигналом опасности и, поступая по афферентным путям в различные отделы нервной системы
— ретикулярную формацию, гипоталамус, кору мозга, вызывает их возбуждение с формированием защитных реакций, интенсивность которых становится избыточной. В частности, имеет место активация ретикулярной формации, повышение возбудимости дыхательного и сосудодвигательного центров. При шоке, особенно травматическом, установлена мозаичность изменений в нервной системе, заключающаяся в наличии очагов торможения, наряду с превалированием процессов
214
возбуждения. Это свидетельствует об отсутствии тотального генерализованного возбуждения, наличие которого ранее считалось доказанным.
Возбуждение центральных аппаратов нервной системы приводит к активации ряда эндокринных систем, в первую очередь, симпатоадреналовой и гипоталамо-гипофизарно-адренокортикальной. Следствием этого является резкое увеличение содержания в крови катехоламинов, кортикостероидных гормонов, вазопрессина; активируется ре- нин-ангиотензин-альдостероновая система.
Следствием указанных изменений является вазоконстрикция периферических сосудов, в том числе прекапиллярных сфинктеров за счет активации а-адренорецепторов. Генерализованный спазм сосудов, как правило, не наблюдается. Считают, что в одних органах он может быть наиболее выраженным, в других — отсутствовать. Вазоконстрикции подвергаются не только резистивные (артериальные), но и емкостные сосуды (венозный отдел), в котором даже в норме сосредоточено около 80 % всего внутрисосудистого объема крови.
Вазоконстрикторная реакция на уровне микроциркуляторного русла является причиной централизации кровообращения, когда кровь, минуя капилляры, из артериол поступает по артериоло-венулярным анастомозам в венозный отдел микроциркуляторного русла. Например, в эректильной фазе травматического шока Ю.М. Штыхно наблюдал полное прекращение капиллярного кровотока в брыжейке крыс и защечном мешке хомячков.
Изучению централизации кровообращения и ее биологической роли посвящены исследования профессора Селезнева С.А. и его учеников. Считают, что централизация кровообращения обеспечивает лучшее снабжение кровью наиболее жизненно важных органов-сердца, мозга, печени.
Наблюдается учащение ритма сердца, которое достигается путем стимуляции β-адренорецепторов, и, как следствие, увеличение ударного и минутного объема сердца. Поэтому, в целом системное артериальное давление повышается как за счет повышения общего периферического сопротивления в результате спазма сосудов, так и за счет увеличения минутного объема сердца. Отражением возбуждения коры головного мозга и подкорковых образований является повышенная речевая и двигательная активность. Именно для данного периода шока и характерна клинически эректильная фаза шока.
215
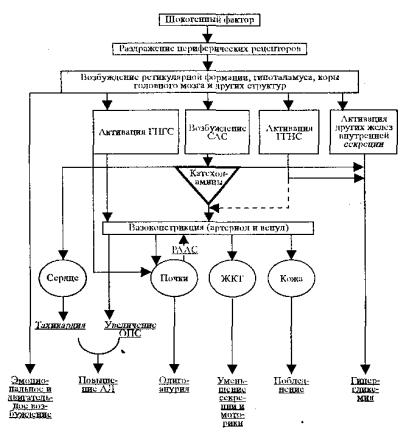
Рис 14.1. Основные звенья патогенеза и клинико-лабораторные проявления эректильной фазы шока
АД — системное артериальное давление ГГНС — гипоталамо-гипофизарно-надпочечниковая система
ГНГС — гипоталамо-нейрогипофизарная система САС — симпато-адреналовая система РААС — ренин-ангиотензин-альдостероновая система
— — → Пермиссивный эффект
Таким образом, эректильная фаза шока (рис. 14.1) обусловлена возбуждением коры и подкорковых образований, резкой активацией симпато-адреналовой системы и проявляется у больных увеличенной речевой и двигательной активностью, жалобами на сильные боли, повышением рефлексов, расширением зрачков, учащением пульса, повышением системного артериального давления. Кожные покровы, как
216
правило, бледные вследствие интенсивного сосудистого спазма. Сознание больного обычно сохранено. Считают, что чем более выражены признаки эректильной фазы шока, тем быстрее и выраженнее становится торпидная фаза. Врачи скорой медицинской помощи наиболее часто сталкиваются с больными, находящимися в эректильной фазе шока. Как мы уже говорили, эректильная фаза достаточно выражена и длительна при ожоговом, травматическом, кардиогенном шоке. Так, при травматическом шоке продолжительность ее колеблется от 10 минут до 1 часа. При ожоговом и кардиогенном шоке продолжительность этой фазы может быть большей. При некоторых других видах шока (анафилактическом, токсико-инфекционном) эректильная фаза практически неуловима, а превалирует торпидная фаза шока.
Таким образом, на начальных этапах шока пусковыми являются нарушения нейро-эндокринных механизмов. Особенно наглядно это демонстрируется наблюдениями В.Б. Лемуса. Изучая различные разновидности шока, он заключает, что в «рефлекторной регуляции системного артериального давления наиболее уязвимым оказалось афферентное звено собственных и сопряженных сосудистых рефлексов. При этом особенно рано нарушалась функция афферентных звеньев, перегруженных раздражителями, свойственных данному патологическому процессу. Этот момент многопланово отражается на состоянии системной и регионарной гемодинамики при шоке. И естественно, он препятствует и первичному афферентному синтезу, и формированию аппарата акцептора действия, и его оптимальной для организма функции. Ослабление и извращение сосудистых рефлексов, по-видимому, усиливает значение гормонального и метаболического контролей кровообращения и лишает эти влияния достаточного центрального контроля...». Последующее понижение тонуса микрососудов происходит вследствие накопления биологически активных веществ, нарушения чувствительности - адренорецепторов к катехоламинам; определенную роль играет снижение перфузнойного давления. Все это приводит к развитию феномена патологического депонирования крови, усугублению циркуляторных расстройств и гипоксических явлений.
Продолжающаяся афферентная информация с места травмы, с одной стороны, а с другой - раздражение рецепторов внутренних органов в результате развивающейся гипоксии вследствие продолжающейся централизации кровообращения и образования продуктов нарушенного обмена веществ, накопление биологически активных веществ (гистамин, кинины, простагландины, ацетилхолин и др.) — вызывают снижение возбудимости различных структур головного мозга, формирование процессов торможения и, как следствие, нарушение регуляции системного артериального давления и микроциркуляции. Это одна из причин снижения системного артериального давления. Так, по данным В.Б. Лемуса, отмечено раннее ослабление, извращение и даже исчезновение синокаротид-
217
ных прессорных рефлексов, что позволяет предположить невозможность участия их в регуляции артериального давления.
В формировании многих видов шока (особенно анафилактического, анафилактоидного, септического) образующимся биологически активным веществам (гистамину, серотонину, кининам, простагландинам, МРС-анафилаксии и др.) принадлежит особенно важная роль в расстройствах системной гемодинамики и микроциркуляции. Они вызывают повышение проницаемости сосудов и, таким образом, уменьшение объема циркулирующей крови (гиповолемия). Значительная часть крови депонируется в сосудах микроциркуляторного русла.
Кроме того, при шоке наблюдается агрегация форменных элементов, сладж-синдром, образование тромбов и эмболов, что ухудшает текучесть (т.е. реологические свойства крови), микроциркуляцию и усугубляет гипоксию. Учитывая большую возможность развития ДВС-синдрома и формирование пониженной свертываемости крови, это может стать причиной вторичных кровотечений и уменьшения объема циркулирующей крови. Кроме указанных выше расстройств микроциркуляции в торпидной фазе шока наблюдается стаз во многих сосудах (капилляров, венул, вен). Кровоток сохраняется только в крупных сосудах. Регистрируется только маятникообразное, толчкообразное движение крови, обнаруживаются плазматические капилляры и другие микрососуды. С развитием гемодинамических расстройств изменяется соотношение между свободной и связанной водой в крови. По данным В.И. Шипотиновского и З.И. Микашинович, у животных с легким шоком на 20 % увеличивается содержание свободной воды и снижается на 40 % связанной. При тяжелом шоке увеличение связанной воды отмечено на 127 %.
Таким образом, снижение системного артериального давления обусловлено нарушением регулирующего влияния нервной системы, уменьшением объема циркулирующей крови из-за плазмопотери и депонирования крови в микрососудах, нарушения реологических свойств крови. Кроме того, во многом снижению системного артериального давления способствует понижение чувствительности а-адренорецеп- торов сосудов к катехоламинам и другим вазопрессорам в условиях ацидоза при шоке. Наконец, исследователями отмечено снижение сократительной способности миокарда при шоке. Не менее важное значение в формировании шоковой гипотензии принадлежит уменьшению венозного возврата крови к сердцу из-за резкого депонирования ее в кишечнике, печени и других органах (В.Г. Овсянников).
Для торпидной стадии шока характерно развитие кортикостероидной недостаточности, механизмы формирования которой имеют сложный генез (С.А. Еремина). Наиболее рано выявляется относительная кортикостероидная недостаточность, определяющаяся преобладанием резко возросших потребностей организма в кортикостероидах над возможностями удовлетворения этих потребностей даже при
218
крайнем напряжении процессов синтеза и секреции в коре надпочечников. В дальнейшем развивается абсолютная кортикостероидная недостаточность вследствие истощения желез, а также нарушения стероидогенеза в коре надпочечников с торможением синтеза важнейшего глюкокортикоидного гормона-кортизола. При тяжелом шоке может развиваться вненадпочечниковая кортикостероидная недостаточность, в основе которой лежит снижение способности тканей к элиминации и утилизации гормонов.
Указанные расстройства характеризуют торпидную фазу шока. Клинически для торпидной стадии характерны проявления угнетения функции коры мозга и подкорковых образований. Больной обычно заторможен. Кожные покровы бледные, холодные, температура тела снижена. Наблюдается тахикардия и снижение системного артериального давления. Дыхание слабое и частое. Именно в торпидной фазе шока имеет место генерализованная гипоксия, дефицит макроэргических соединений, сложные нарушения обмена и, как следствие, развитие метаболического ацидоза (рис. 14.2).
Нарушение функций органов и систем при шоке
Снижение системного артериального давления и формирование генерализованной гипоксии нарушает функцию практически всех органов и систем организма, но особенно тех, которые на фоне централизации кровообращения имеют недостаточное кровообращение - это легкие, почки, печень. Учитывая наибольшую их поражаемость при шоке, они получили название «шоковых органов». Функциональные и морфологические изменения при шоке определяются степенью выраженности и длительностью расстройств микроциркуляции.
Если при шоке расстройства кровообращения не очень тяжелые и продолжительные, то после самопроизвольного или в результате лече-
ния восстановления кровообращения, функция органов |
и систем |
также полностью восстанавливается. |
|
При длительном и выраженном расстройстве микроциркуляции и гипоксии особенно страдает образование макроэргических соединений, накапливаются кислые продукты (пируват, лактат, аминокислоты). Дефицит АТФ ведет к сложным нарушениям функций клетки, особенно калий-натриевого насоса и транспорта электролитов, синтеза белка; повреждаются мембраны многих органелл, особенно митохондрий, лизосом, что сопровождается выходом и активацией около 40 лизосомальных ферментов.
219
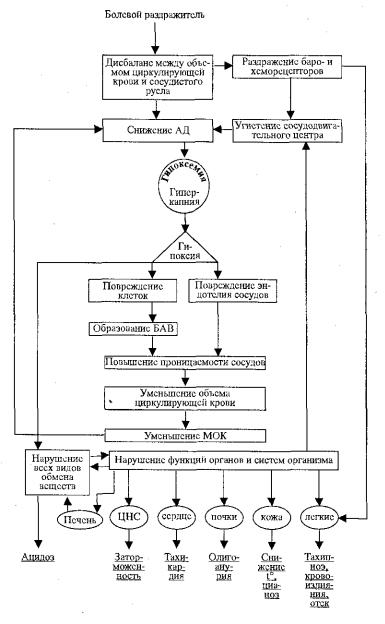
Рис 14.2. Основные звенья патогенеза и клинико-лабораторные проявления торпидной фазы шока
220
