
Полезные материалы за все 6 курсов / Учебники, методички, pdf / учебник-1-часть-2017
.pdfНарушения липидного обмена
Нарушения гидролиза и всасывания жиров. Липиды, преиму-
щественно в виде нейтральных триглицеридов, поступая с пищей в двенадцатиперстную кишку, подвергаются эмульгированию желчью, с образованием хиломикронов диаметром 5 ммк. Под влиянием липазы поджелудочной железы и кишечного сока триглицериды гидролизуются до жирных кислот, моноглицеридов и образуют мицеллы. Жирные кислоты образуют с желчными кислотами водорастворимые комплексы (холеинаты), которые, поступая в кишечный эпителий, снова распадаются до образования жирных кислот. В кишечном эпителии при наличии АТФ осуществляется ресинтез триглицеридов, которые поступают в лимфу в составе липопротеинов. Часть триглицеридов всасывается без гидролиза. Ненасыщенные жирные кислоты с короткой углеродной цепью поступают в систему воротной вены. Триглицериды, поступая в венозную кровь, частично задерживаются в легких и в дальнейшем в кровеносном русле расщепляются липопротеиновой липазой, образующейся эндотелием сосудов до жирных кислот и глицерина. Жирные кислоты адсорбируются на альбумине и доставляются в жировые депо, где снова ресинтезируются в триглицериды, а частично доставляются к различным органам, особенно к печени, где в качестве энергетического субстрата подвергаются окислению. Глицерин подвергается фосфорилированию с образованием глицеральдегидфосфата, являющегося общим продуктом углеводного и жирового обмена. Жирные кислоты подвергаются β-окислению, при котором углеродная цепь укорачивается на два углеродных атома и образуется молекула ацетилКоА за каждый цикл, β-окисление свободных жирных кислот происходит внутри митохондрий. В результате окисления и сопряженного с ним окислительного фосфорилирования очень большое количество химической энергии свободных жирных кислот аккумулируется в виде АТФ. Так, при окислении одной молекулы пальмитиновой кислоты образуется 130 молекул АТФ, в то время как при окислении одной молекулы глюкозы, одного из наиболее важных в энергетическом отношении субстратов, синтезируется только 38 молекул АТФ. Нарушение гидролиза жира может быть обусловлено недостаточным поступлением желчи в двенадцатиперстную кишку и эмульгированием жира, что наблюдается при механической желтухе, гепатите, интоксикациях, расстройствах кровообращения, гипоксии. Но даже при полном отсутствии желчи стеаторея не превышает 20 г/сутки, так как дистальные отделы тощей подвздошной кишки компенсируют пониженную абсорбцию в проксимальном отделе тощей кишки, но всасывание холестерина и жирорастворимых витаминов невозможно без желчных кислот (Г. Галлер с соавт.). Воспаление, опухоли поджелудочной железы и кишечника приводят к дефициту липазы. Снижение кислотности желудка и усиление перистальтики желудочно-кишечного тракта не обеспечивают достаточно эффективного гидролиза жира, даже если он эмульгирован.
Нарушение всасывания наблюдается при недостаточном расщеплении жиров, а также при воспалении, расстройствах кровообращения в кишечнике, нейроэндокринных расстройствах. В этих случаях нарушается транспорт и ресинтез триглицеридов из жирных кислот в кишечном эпителии. При дефиците витаминов А и В имеет место
171

нарушение образования ферментов, участвующих в ресинтезе триглицеридов в эпителии кишечника. При отравлении флоридзином и монойодацетатом блокируются процессы фосфорилирования и использование АТФ для ресинтеза триглицеридов в кишечнике. Нарушение расщепления обнаруживается и при избыточном содержании кальция и магния, ибо они образуют с жирными кислотами нерастворимые в воде соединения.
Расстройства гидролиза жиров способствуют формированию стеатореи, т.е. выделению с калом большого количества жира. В норме взрослый человек, потребляя 60—120 г жира, выделяет с калом не более 7 г за стуки. При нарушении расщепления количество жира в кале возрастает.
При нарушении расщепления жира жирорастворимые витамины А, Д, Е, К поступают в организм в меньшем количестве, что и способствует их дефициту. Отсюда, возможно нарушение образования протромбина в печени при недостатке витамина К и остеопороз при дефиците витамина Д.
Нарушения расщепления и всасывания триглицеридов способствуют снижению их в крови и, что особенно важно, дефициту ненасыщенных жирных кислот, которые в организме не синтезируются. Нарушения расщепления и всасывания жира представлены в таблице
12.10.
|
|
Таблица 12.10 |
|
|
Нарушение расщепления и всасывания жира |
|
|
|
|
|
|
|
НАРУШЕНИЕ |
НАРУШЕНИЕ |
|
|
ГИДРОЛИЗА |
ВСАСЫВАНИЯ |
|
|
|
|
|
ПРИЧИНЫ |
Поражения печени (гепатит, меха- |
Воспаление и расстройства кро- |
|
|
ническая и паренхиматозная желту- |
вообра-щения в кишечнике, не- |
|
|
ха, нарушения кровообращения), |
достаточность |
надпочечников, |
|
поджелудочной железы, кишечника, |
дефицит вит. А и В, избыток Са |
|
|
(воспаление, некроз, опухоли), уси- |
и Mg, отравления флоридзином и |
|
|
ление перистальтики, прием анти- |
монойодацетатом + все причины, |
|
|
биотиков (номицин, хлортетрацик- |
вызывающие |
нарушение гидро- |
|
лин) |
лиза |
|
|
|
|
|
МЕХАНИЗМЫ |
Нарушения эмульгирования жиров, |
Нарушения транспорта и фос- |
|
|
дефицит липазы поджелудочной |
форилирования жиров в ки- |
|
|
железы и тонкого кишечника |
шечнике |
|
|
|
|
|
ИЗМЕНЕНИЯ |
Стеаторея (увеличенное вы-деление |
Недостаточное |
поступление ви- |
В ОРГАНИЗМЕ |
нерасщепленного жира с калом) |
таминов А, Д, Е, К. Нарушение |
|
|
|
синтеза протромбина в печени. |
|
|
|
Дефицит ненасыщенных жирных |
|
|
|
кислот в организме. Снижение |
|
|
|
жира в крови и лимфе |
|
Гиперлипопротеинемии. Повышенный уровень липидов в крови является важным фактором в появлении и развитии дегенеративных изменений сосудов, особенно сердца. Гиперлипопротеинемии способ-
172
ствуют нарушения в поступлении, образовании, транспорте и расщеплении липопротеинов. Это сопровождается увеличением в крови триглицеридов и холестерина.
Уровень липидов крови в норме зависит от возраста, пола, характера питания. У взрослых о гиперлипопротеинемии свидетельствует увеличениея холестерина свыше 300 мг % (7,8 ммоль/л), или триглицеридов более 250 мг % (Г.Галлер с соавт.).
Сочетание избыточного приема жиров и холестерина со снижением образования и активности липопротеиновой липазы крови служат причиной гиперлипопротеинемии. Нарушение расщепления липидов крови обусловлено дефицитом гепарина, стимулирующего образование эндотелиальными клетками сосудов липопротеиновои липазы, а также при атеросклеротических изменениях сосудов, когда образование ее снижено.
Нередко гиперхолестеринемия наблюдается при ряде заболеваний (сахарный диабет, нефротический синдром, уремия, холестаз, алкоголизм, гипотиреоз, гипофизарная недостаточность). Это обусловлено понижением активности липопротеиновои липазы, мобилизацией жира из жировых депо, нарушением транспортной функции альбуминов.
Гиперлипопротеинемия сопровождается образованием атероматозных бляшек сосудов, повышением свертывания крови и образованием тромбов, способствует формированию гипертензии.
Нарушения межуточного обмена жиров
Нарушения межуточного обмена жиров включают: увеличение синтеза жира в жировых депо, торможение и усиление мобилизации жира из жировых депо, нарушения мобилизации жира из печени, а также расстройства превращения жирных кислот.
Этиология и патогенез общего ожирения. Общее ожирение обусловлено усилением синтеза и торможением мобилизации жира из жировых депо. Во многом этому способствует снижение энергозатрат в условиях гиподинамии.
Синтез жира в жировых депо резко увеличивается при избыточном поступлении в организм жира и углеводов, чему способствует повышение аппетита и переедание. Показано, что в жировой ткани повышен липогенез, если пища принимается большими дозами. Лица с ожирением днем едят редко и мало, но зато вечером очень много, что получило название «синдрома ночного питания». Синтез жира требует достаточно большого количества инсулина, который тормозит активность липазы жировых клеток и жиромобилизующие эффекты контринсулярных гормонов.
В опытах на крысах отмечено повышение аппетита при разрушении вентро-медиальных ядер гипоталамуса. Вероятно, аналогичные изменения имеют место и при диэнцефальном ожирении, обусловленном воспалением, расстройствами кровообращения, кровоизлияниями в этой области.
Известно, что избыточное образование глюкокортикоидов (синдром или болезнь Иценко-Кушинга) также приводит к отложению жира в области туловища и лица. Это объясняется усилением секреции желудочного сока, повышением аппетита, что ведет к избыточному приему
173
пищи. Кроме того, регионарность ожирения свидетельствует о роли расстройств гипоталамической области.
Развитие общего ожирения наблюдается при недостаточности гипофиза, щитовидной и половых желез, так как уменьшаются жиромобилизующие эффекты соматотропина, тироксина и половых гормонов.
Усиление мобилизации жира из жировых депо. Отложение и мобилизация жира регулируются нейроэндокринными и метаболическими влияниями. Важное значение во взаимоотношении между липолизом и липогенезом в жировой клетке имеет цикл глюкоза — жирная кислота. Увеличение концентрации глюкозы в крови ведет к торможению липолиза в жировой ткани. Снижение концентрации глюкозы крови способствует распаду жира и поступлению глицерина и жирных кислот в кровеносное русло. Решающее значение имеет соотношение между инсулином и контринсулярными гормонами. Количество инсулина увеличивается в крови при гипергликемии, и глюкоза интенсивно используется для образования жира в жировых депо. Инсулин тормозит липолиз путем включения глюкозы в жировую клетку и за счет связывания аденилциклазы с рецепторами мембран клеток, что тормозит образование цАМФ и активность липазы в жировой клетке.
Гипогликемия, а также дефицит инсулина, способствуют усиленному образованию контринсулярных гормонов (катехоламины, глюкагон, глюкокортикоиды, кортикотропин, соматотропин, тироксин), которые, как и вазопрессин, активируют аденилатциклазу жировых клеток, синтез цАМФ из АТФ и, в конечном итоге, активируется липаза. Липолитическим эффектом обладают и ряд фармакологических средств (кофеин, теофилин и др.).
Антилиполитическое действие характерно для простагландинов, β- и γ-липотропинов гипофиза. Торможение липолиза отмечено также при действии на организм а- и β-симпатолитиков, никотиновой и нуклеиновых кислот, салицилатов (Г. Галлер с соавт.).
Мобилизация жира из жировых депо происходит при дефиците углеводов как важнейшего энергетического субстрата (сахарный диабет, углеводное голодание), что ведет к усиленному образованию и превалированию эффектов контринсулярных гормонов. Катехоламины, соматотропин, кортикотропин, глюкокортикоиды, воздействуя на мембраны клеток жировых депо, активируют аденилциклазу, которая обеспечивает образование цАМФ. Последняя активирует гормончувствительную липазу, обеспечивающую расщепление триглицеридов. Жирные кислоты и глицерин поступают в кровь.
Именно интенсивная мобилизация жира и недостаточное использование углеводов и жирных кислот для липогенеза при диабете и углеводном голодании способствуют исхуданию.
Нарушения превращения жирных кислот. Жирные кислоты поступают в кровь из пищи и из жировых депо, а также при гидролизе β-липопротеинов печени. Основная масса жирных кислот доставляется в печень, где используется для ресинтеза триглицеридов, а последние входят в состав более сложных липидов — β-липопротеинов. Часть жирных кислот окисляется до образования холестерина и кетоновых тел. (рис. 12.2).
174
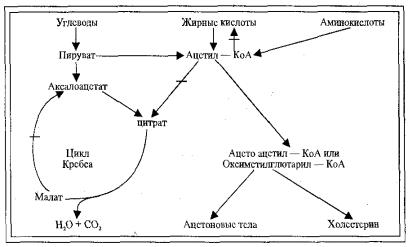
Рис. 12.1 Изменения образования кетоновых тел и холестерина из углеводов, жирных кислот и аминокислот (Л. Райчев с соавт.)
Последние вне печени через образование ацетилКоА используются в цикле Кребса как энергетический материал с образованием конечных продуктов — СО2 и Н2О.
При дефиците углеводов, в том числе и в печени (сахарный диабет, голодание, токсикоинфекционные поражения печени) усиливается образование контринсулярных гормонов и мобилизация жира из жировых депо. Жирные кислоты в большом количестве поступают в печень, где интенсивно используются (в условиях дефицита углеводов) как основной энергетический материал. Резко возрастает количество холестерина и кетоновых тел (ацетон, ацетоуксусная и β-оксимасляная кислоты). Использование ацетоновых тел в цикле Кребса в органах возрастает, но количество их в крови остается повышенным. Это явление получило название кетоза. Таким образом, в результате нарушения превращения жирных кислот развиваются явления гиперхолестеринемии и кетоза.
Этиология и патогенез ожирения печени. Мобилизация жира из печени происходит в виде β-липопротеинов. Контролируется этот процесс липокаином, вырабатываемым в мелких протоках поджелудочной железы. Кроме этого, важное значение в мобилизации β-липопротеинов из печени принадлежит фосфолипидам, для образования которых необходим метионин и холин.
Основу патогенеза жировой дистрофии составляет повышение синтеза триглицеридов вследствие переедания и нарушении мобилизации липопротеинов из печени в результате ее токсико-инфекционных поражений, а также белковая и инсулярная недостаточность.
Поэтому, при сахарном диабете с поражением не только β-клеток, но и клеток выводных протоков поджелудочной железы (тотальный диабет) липокаин не образуется, и β-липопротеины не поступают в кровь, а продолжают откладываться в межклеточных пространствах и в
175
клетках, обеспечивая формирование жировой инфильтрации и жировой дистрофии.
Воспалительные, токсико-инфекционные поражения печени (отравления фосфором, мышьяком, алкоголем), цирроз печени, авитаминозы, вызывая расстройства функций окислительно-восстанови- тельных и гидролитических ферментов печени, также сопровождаются ее ожирением. Это обусловлено усилением липолиза, нарушением окисления жирных кислот и торможением мобилизации жира.
Дефицит метионина и холина — важнейших субстратов, входящих в состав β-липопротеинов, ведет к недостатку последних и, как следствие, к торможению мобилизации жира из печени с развитием жировой инфильтрации и жировой дистрофии.
В норме липиды составляют 5-10 % веса печени взрослого человека. Об ожирении печени говорят тогда, когда 50 % печеночных клеток имеют отложения жира, или содержание триглицеридов в печени
превышает 10 % сухого вещества. Ожирение печени происходит преимущественно за счет накопления триглицеридов.
Нарушения образования и превращения холестерина. Холе-
стерин входит в состав всех липопротеиновых фракций крови. Больше всего его в β-липопротеинах. В крови человека содержится 150-250 мг % (3,9—6,5 ммоль/л) холестерина. Синтез холестерина происходит почти во всех тканях, но больше всего в кишечнике и печени. При избыточном поступлении пищевого холестерина синтез его в печени тормозится по принципу обратной связи. Повышение синтеза холестерина в печени наблюдается при отсутствии желчных кислот. При их дефиците синтез холестерина в слизистой тонкой кишке увеличивается в 5—10 раз.
Основное влияние на уровень холестерина оказывает содержание жира, особенно ненасыщенных жирных кислот в пище. Так, превалирование ненасыщенных жирных кислот снижает уровень холестерина и повышает выделение желчных кислот. Важным путем элиминации холестерина является синтез из продуктов его распада желчных кислот в печени и удаление их с калом.
Нарушения кислотно-щелочного равновесия
Уздорового человека рН крови колеблется в пределах 7,36—7,44.
абольшинства клеток — 7,0 —7,2. Как известно, рН определяется соотношением недиссоциированных кислот и буферных анионов. Показано, что сумма катионов и анионов равна и обеспечивает нейтральность раствора. Мембраны клеток легко проницаемы для катионов и небелковых анионов. С помощью калиево-натриевого насоса поддерживается высокая концентрация калия в клетке и натрия во внеклеточной среде. Не проходят через мембрану только лишь анионы белковой природы. Все катионы плазмы и эритроцитов не обладают буферными свойствами, так как не связывают ни гидроксильные, ни водородные ионы. Сумма их дает титруемую щелочность. Анионы бикарбоната, белка, фосфорной кислоты связываются с ионами водорода и поэтому обладают буферными свойствами. Все они входят в состав так называемых оснований. Анионы хлора, серной кислоты, органических кислот не обладают буферными свойствами и обеспечивают титруемую кислотность. Таким
176

образом, буферными свойствами, то есть способностью компенсировать избыток образующихся в организме кислот, обладают бикарбонаты, белки, в том числе гемоглобин, и анионы фосфорной кислоты.
В условиях патологии сдвиги рН крови за пределы 7,0—7,8 несовместимы с жизнью. Роль оснований внеклеточной жидкости осуществляют ионы бикарбоната (НСО3—), двузамещенного фосфата (НРО4— —), хлора (Сl—) и белки (белки плазмы, клеток, в том числе гемоглобин).
Эффективное поддержание кислотно-щелочного равновесия осуществляется тремя путями: путем разбавления кислот и щелочей в жидкостях организма буферными системами крови и клеток, различными физиологическими механизмами. Самым простым, но малоэффективным способом поддержания рН является разбавление кислот и щелочей.
Буферная система представлена слабыми кислотами и сильными основаниями. Выделяют следующие буферы:
1. Бикарбонатный буфер. В межклеточной жидкости и плазме растворены углекислый газ (СО2), угольная кислота (Н2СО3), ионы бикарбоната (НСО3—) и карбоната (СО3— —). Углекислый газ реагирует с водой с образованием угольной кислоты, которая легко диссоциирует на ион водорода и бикарбонат.
СО2 + Н2О → Н2СО3 |
→ Н+ + НСО3— |
|||||
Однако транспорт через мембраны клеток осуществляется пре- |
||||||
имущественно в виде СО2. |
|
|||||
Бикарбонатный |
буфер |
состоит из слабой угольной кислоты |
||||
(Н2СО3) и щелочных |
солей |
(преимущественно NaНСО3). Соот- |
||||
ношение |
|
|
|
|
|
|
|
H2CO3 |
|
1 |
при накоплении сильной кислоты происходит реак- |
||
|
HCO -3 |
20 |
||||
|
|
|
|
|||
ция с бикарбонатами с образованием слабой угольной кислоты, которая в виде СО2 удаляется через легкие. При накоплении щелочных продуктов больше образуется бикарбоната натрия, который выделяется с мочой.
Расчет рН при исследовании кислотно-щелочного равновесия производится на основании уравнения Гендерсона-Гассельбаха.
HCO --
3 , а так как количество растворенного
H2CO3
СО2 во много раз превышает содержание угольной кислоты, то эта формула выглядит следующим образом:
|
|
(HCO-- ) |
|
— |
|
|||
|
|
3 |
, где |
(НСО3 ) и |
(СО2) выражены в |
|||
pH 6,1 lg 0,03 pCO2 |
||||||||
|
|
|
||||||
ммоль/л, а рСО2 |
в мм рт. ст. (И.С. Балаховский, Т.Д. Большакова). |
|||||||
pH 6,1 lg |
25 |
6,1 lg 20 |
6,1 1,3 7,4 |
|||||
|
||||||||
|
1,2 |
|
|
|
|
|||
2. Фосфатный буфер представлен в крови NaH2PO4 |
и Na2HPO4. При |
|||||||
этом NaH2PO4 |
выполняет роль кислоты, а Na2HPO4 — щелочи. |
|||||||
177

В |
крови соотношение |
NaH2PO4 |
|
1 |
|
Na2HPO4 |
4 |
|
|||
|
|
|
|
||
Кислоты |
связываются молекулами |
Na2HPO4, а щелочи - |
|||
NaH2PO4.
3. Белковый буфер. Белки, являясь амфолитами, способны диссоциировать в кислотной среде как основания, а в щелочной — как кислоты, что способствует связыванию кислот или щелочей.
4. Гемоглобиновый буфер. Гемоглобин, имея в своем составе белок, проявляет амфотерные свойства и, следовательно, как и любой белок в кислой среде реагирует как основание, а в щелочной - как кислота. Считают, что оксигемоглобин (НвО2) в 70—80 раз более сильная кислота, чем восстановленный гемоглобин (Нв), который имеет свойства слабого основания. Буферные свойства гемоглобина проявляются и в ходе газообмена, конечный продукт окисления белков, жиров и углеводов - СО2 - переходит в кровь и в эритроциты, где под влиянием карбоангидразы образуется угольная кислота. Она диссоциирует на ион водорода (Н+), который связывается с восстановленным гемоглобином, а НСО3— соединяется с калием и, частично переходя в плазму, соединяется с натрием, в венозной крови хлор переходит в эритроцит, а ионы натрия соединяются с бикарбонатом (НСО3—), вышедшим из эритроцита и при диссоциации угольной кислоты в плазме крови Н+ и НСО3—. В малом круге кислород соединяется с гемоглобином и вытесняет ион водорода (Н+), который соединяется с КНСО3, с освобождением в эритроците калия и образованием кислоты, которая под влиянием угольной ангидразы распадается до воды и углекислого газа, а последний переходит из эритроцитов в плазму, а затем в альвеолярный воздух. Одновременно хлор выходит из эритроцитов и в плазме соединяется с бикарбонатом натрия (NaHCO3), количество которого в крови снижается (И. А. Држевецкая).
Наибольшей буферной емкостью обладают бикарбонатный и белковый буферы, особенно гемоглобиновый (табл. 12.11).
Таблица 12.11
Количество ионов водорода (м- экв.), которое поглощается буферными системами крови (1 л) при снижении рН с 7,4 до 7,0. (Д.Р. Робинсон)
Бикарбонат — 18 + фосфат — 0,3 + белки плазмы — 1,7 + гемоглобин — 8,0
Всего — 28
В эритроцитах преобладают буферные свойства гемоглобина, а в плазме, наоборот, бикарбонат занимает первое место, а белки — второе. В межклеточной жидкости содержится только бикарбонатный буфер. Суммарная емкость бикарбонатного буфера межклеточной жидкости и крови равноценны. При компенсации буферные системы эритроцитов, плазмы и межклеточной жидкости реагируют как единое целое
(И.С. Балаховский, Т.Д. Большакова). |
|
||
Важное значение в |
регуляции рН крови, |
межклеточной |
|
жидкости и |
клеток принадлежит физиологическим |
системам, ко- |
|
торые обычно |
включаются |
при недостаточности буферных систем. |
|
|
|
178 |
|
Через легкие выделяется СО2 и поэтому при накоплении кислых продуктов, особенно угольной кислоты, происходит рефлекторное возбуждение дыхательного центра, учащение дыхания и избыточное выделение СО2. В условиях гипоксии учащение дыхания — один из механизмов, направленных на лучшее снабжение кислородом и предотвращение метаболического ацидоза. При уменьшении углекислоты и сдвиге рН в щелочную сторону рефлекторно уменьшается частота дыхания и ограничивается выделение СО2, что может способствовать за счет накопления угольной кислоты (Н2СОз) нормализации рН крови. Дыхательная компенсация начинает развиваться через 16—18 часов, достигает максимума через 2—3 суток, а по данным Г. Рут, через 5—7 дней после сдвига кислотно-основного равновесия. Нормализуется возбудимость дыхательного центра и дыхания в целом после устранения сдвигов рН также спустя 2—3 суток. Изменение со стороны дыхательного центра и системы дыхания в целом могут вести и к гиперкомпенсации (И.С. Балаховский, Т.Д. Большакова).
Важным физиологическим механизмом компенсации является выделение кислых и основных продуктов с мочой. Угольная кислота в эпителии канальцев служит источником секретируемых в мочу ионов водорода, а образовавшийся из угольной кислоты бикарбонат (НСО--3) и реабсорбция натрия, взамен секретировавшихся ионов водорода, обеспечивают поступление бикарбоната натрия в кровь. В моче ион водорода соединяется с фильтруемым ионом бикарбоната (НСО3—), образуется угольная кислота, которая распадается на СО2 и Н2О. В проксимальных канальцах почек секретируется наибольшее количество ионов водорода,
здесь же реабсорбируется и 80—90 %, а в |
петле Генле — 10—15 % |
бикарбонатов. |
|
Ион водорода в канальцах соединяется также с ионом НРО4— — и |
|
выделяется в виде кислых фосфатов, |
благодаря чему в конечной |
моче соотношение |
NaH2PO4 |
становится равным 9:1, т.е. с мочой |
|
Na2HPO4 |
|||
|
|
выводятся кислые фосфаты, и поэтому реакция мочи кислая. При снижении рН мочи ниже 4,5 фосфатная буферная система неэффективна, и секреция ионов водорода резко снижается. Выведение их осуществляется только за счет образования аммония (аммониогенез). Считают, что в норме NH4+ образуется очень мало. Выделение ионов водорода в виде иона аммония (NH4+) и его солей является резервным механизмом, который усиленно функционирует при увеличении в плазме ионов водорода. Именно аммониогенез в этом случае способствует поддержанию рН, так как аммиак, образуемый при дезаминировании аминокислот, легко диффундирует в канальцы, соединяется с ионом водорода и в виде хлористого аммония удаляется с мочой. Как уже говорилось, секреция ионов водорода сочетается с реабсорбцией бикарбоната натрия в кровь. Благодаря секреции ионов водорода моча остается кислой, если фильтруется много бикарбоната и тормозится секреция ионов водорода, моча имеет щелочную реакцию.
179
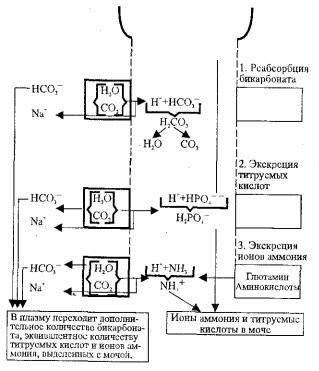
Компенсаторная функция почек развивается более медленно, чем дыхательная. Для ее полного функционирования необходимо 5—7 суток после нормализации рН крови, секреторная и реабсорбционная функция почек нормализуется только лишь спустя 2—3 дня.
рН мочи равен 5—7, но в условиях патологии может колебаться от
4 до 8.
Схематически роль почек в поддержании кислотно-щелочного равновесия представлена на рис. 12.2.
Рис. 12.2. Три фазы ионообмена в почечных канальцах (Р.Д. Робинсон)
Буферные компенсаторные механизмы реагируют быстро, тогда, как физиологические отставлены во времени. При острых расстройствах рН срабатывают, в первую очередь, буферные механизмы. Легочные и почечные более инертные. Поэтому, как их позднее включение, так и их более длительное функционирование могут приводить нередко к явлениям гиперкомпенсации.
Снижение РН крови называется а ц и д е м и е й , а повышение а л - к а л е м и е й . Изменение рН в кислую сторону в организме получило название ацидоза, а в щелочную — алкалоза.
По степени выраженности ацидоз и алкалоз могут быть компенсированными, субкомпенсированными и декомпенсированными. При
180
