
796
.pdfсти от концентрации. В случае подчинения раствора вещества закону Бэра эта зависимость для любой длины волны имеет линейный характер. Фактически закон Бэра выполняется не при любых концентрациях, а для очень разбавленных растворов, применяемых в УФ-спектроскопии; отклонения от закона, связанные с межмолекулярными взаимодействиями в растворах, невелики. Оптическую плотность обычно измеряют в интервале 0 2.0.
Для химиков-органиков интерпретация молекулярного спектра в значительной степени основывается на его эмпирическом сопоставлении с большим числом экспериментальных данных; в результате данный сигнал (полоса) поглощения может быть с разумной степенью вероятности отнесена к той или иной группе атомов в молекуле.
1.5.2. ИК-спектроскопия
Область электромагнитного спектра от 2 до 50 мк (5000 200 см−1) связана с колебаниями атомов в молекуле. Экспериментально эта область исследуется двумя, отличающимися по своей физической природе методами: инфракрасной (ИК) спектроскопии и спектроскопии комбинационного рассеяния (КР). ИК-поглощение обусловлено переходами между двумя колебательными уровнями молекулы, находящейся в основном электронном состоянии. Спектры КР связаны с поляризуемостью молекулы.
Обычно к инфракрасной области относят диапазон длин волн 2.5 15 мк (4000 667 см −1); диапазон 0.8 2.5 мк (12500 4000 см −1) называ-
ют ближней инфракрасной областью, а 15 200 мк (667 50 см −1) – дале-
кой инфракрасной областью. Как и в УФ-спектроскопии, поглощение при более высокой частоте соответствует большей энергии.
Молекула не представляет собой жесткой конструкции, построенной из атомов. Она скорее напоминает систему, состоящую из мячей различной массы, соответствующих атомам, и пружин различной жесткости, соответствующих химическим связям. Существуют два основных вида колебаний атомов в молекуле: валентные, при которых расстояние между атомами уменьшается или увеличивается, но атомы остаются на оси валентной связи, и деформационные, при которых атомы отходят от оси валентной связи. Оба вида колебаний происходят с определенными, квантованными частотами. Если на молекулу при этом падает свет той же частоты, то происходит резонансное поглощение энергии молекулой, и амплитуда колебаний увеличивается. Когда молекула из возбужденного состояния
51
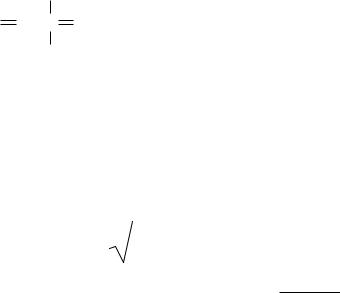
возвращается в исходное (релаксирует), поглощенная энергия выделяется в виде тепла.
Нелинейные молекулы, содержащие N атомов, имеют 3N−6 основных (фундаментальных) колебаний, линейные− 3N−5 колебаний. Кроме основных колебаний, вследствие их ангармоничности, в спектрах часто наблюдаются в виде слабых полос обертоны и составные частоты.
Экспериментальные исследования большого числа молекул, обладающих одними и теми же химическими группами, показали, что эти одинаковые группы поглощают в узком интервале частот независимо от изменений в остальной части молекулы. Такие частоты получили название характеристических или групповых. К ним относятся, например, колебания групп:
X
NH2, C C, C O, NO2 и др.
Y
Наличие групповых частот свидетельствует о том, что в таком колебании наибольшее участие принимает некоторая группа атомов, вклад же остальной части молекулы, хотя, строго говоря, существует, но он мал.
В двухатомной молекуле частота колебаний по закону Гука зависит от массы атомов и силового коэффициента, связанного с упругостью
связи, следующим образом: |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
||
= |
|
K |
, |
|||||
|
|
|
||||||
|
|
|
|
|||||
|
2 c |
|
|
|
||||
|
|
|
|
|
||||
|
|
|
|
|
|
|
||
m1m2
где К – силовой коэффициент; − приведенная масса, равная. m1 + m2
В многоатомных молекулах дело обстоит сложнее, однако, эта зависимость, хоть и очень грубо, но позволяет оценить области ИКпоглощения.
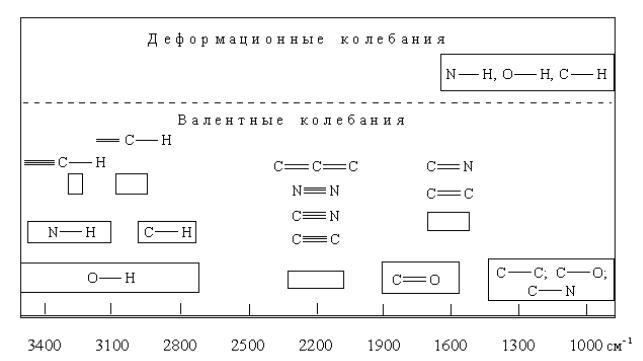
Колебание будет тем более характеристичным, чем больше параметры колеблющейся группы атомов (К и ) отличаются от параметров остальной части молекулы. В табл. 1.6[6] приведены легко интерпретируемые полосы поглощения наиболее часто встречающихся функциональных групп.
Поглощение в УФ- и видимой областях связано главным образом с возбуждением электронов, поэтому соответствующие спектры дают ограниченную информацию о строении молекулы. Поглощение в ИК-области
52
связано с молекулярными колебаниями того или иного типа; отвечающие им спектры обычно очень сложны и состоят из большого числа слабо разрешенных пиков поглощения, лишь немногие из которых могут быть надежно интерпретированы. По сравнению с методами оптической спектроскопии, спектры ядерного магнитного резонанса, в частности, протонного магнитного резонанса (ПМР), отражающие переходы ядерных спинов, обычно можно расшифровать полностью, получая при этом информацию о числе, природе и окружении всех протонов в молекуле. Поэтому развитие спектроскопии ядерного магнитного резонанса – наиболее важное достижение в области химической физики. Вместе с тем этот метод не заменяет более старых методов, они взаимно дополняют друг друга.
Таблица 1.6.
Интервалы поглощения некоторых функциональных групп в ИК-спектроскопии
1.5.3. ЯМР-спектроскопия
Как и в методах оптической спектроскопии, в основе спектроскопии ЯМР лежит соотношение Бора =h Изменение энергии в этом случае связано с магнитными свойствами ядер. Каждое ядро характеризуется собственным моментом количества движения, определяемым величиной:
I = I . |
h |
, |
2 |
||
53 |
|
|
где h – постоянная Планка, а I – спиновое квантовое число (или просто спин), которое может принимать лишь некоторые дискретные значения, а именно: быть целым, полуцелым или равным нулю числом. Ядра с I 0 имеют магнитный момент, вектор которого совпадает с собственным моментом количества движения. Такие ядра называются магнитными. Связь между магнитным и механическим моментами выражается отношением:
= Ι = ( |
I |
. |
h |
) |
, |
( ) |
|
2 |
|||||||
|
|
|
1 |
где − магнитогирическое отношение, являющееся постоянным для данного атомного ядра.
Магнитное ядро можно упрощенно представить в виде вращающейся сферы, несущей положительные электрические заряды. Момент количества движения (спиновой момент) обусловлен вращением массы сферы, а магнитный момент – вращением зарядов. Протоны и нейтроны, из которых состоят атомные ядра, имеют спин, равный ½, и в зависимости от того, спарены в ядре спины этих частиц или нет, ядро может характеризоваться нулевым или ненулевым результирующим ядерным спиновым квантовым числом.
Для ядер с четным числом нейтронов и четным атомным номером (четным массовым числом) спины ядра взаимно скомпенсированы, то есть результирующий спин равен нулю, а, следовательно, равен нулю и магнитный момент. Такие ядра немагнитны и непригодны для экспериментов
по ЯМР. К этому типу ядер относятся наиболее распространенные изотопы углерода (6С12) и кислорода (8О16).
При четном числе протонов и нечетном числе нейтронов (нечетном массовом числе) ядро имеет полуцелый спин. К этому типу относятся
наиболее пригодные для ЯМР-эксперимента ядра – 1H1, 9F19, 15P31, 6C13,
7N15.
И, наконец, при нечетном числе протонов и нечетном числе нейтронов (четное массовое число) спин ядра целый, например, 7N14, 1D2 .
Магнитные ядра в отсутствие внешнего возмущения имеют хаотическое направление спинов и среднюю энергию Е0. Если на эту систему ядер наложить внешнее магнитное поле, то ядра со спином I принимают лишь вполне определенный набор дискретных ориентаций, число которых равно 2I+1. При этом длина проекции вектора момента количества движения на направление внешнего магнитного поля m, называемая магнитным квантовым числом, принимает значения I, I − 1, I −2,…,−I +1, −I. Ядра со спином ½ (H1, F19, P31, C13, N15) в однородном внешнем магнитном поле могут находиться в двух энергетических состояниях (2 ½ + 1), соответствующих ориентации магнитного момента параллельно приложенному магнитному полю Н0 (m = + ½) и антипараллельно Н0 (m = − ½). Такое расщепле-
54
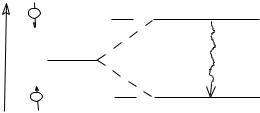
ние уровня Е0 на соответствующее количество подуровней (рис.1.8.) называется зеемановским расщеплением.
H0 |
m = − |
1 |
+ H |
|
|
||
|
|
2 |
|
|
|
|
|
|
E0 |
|
E |
|
|
|
|
|
m = + |
1 |
− H |
|
|
||
|
|
2 |
|
|
|
|
Рис.1.8. Расщепление энергетических уровней ядер со спином I= 1 / 2 в магнитном поле
Величина этого расщепления зависит от величины магнитного момента ядра и напряженности приложенного магнитного поля E = 2 H0. Между обоими подуровнями возможны переходы с частотой 0, величина которой при соблюдении соотношения Бора и формулы (1) выражается в виде:
= |
|
H0 |
( 2) |
|
|
|
|||
|
2 |
|||
|
|
|
||
Из теории электромагнитного излучения следует, что при равной заселенности ядер в основном и возбужденном состояниях вероятность перехода на высший уровень с поглощением энергии внешнего электромагнитного поля равна вероятности стимулированного полем перехода на низший, энергетически более выгодный уровень. При спонтанном переходе вниз должно происходить выделение энергии в виде кванта переменного электромагнитного поля частоты 0, удовлетворяющей соотношению Бора =h . Однако в результате взаимодействия исследуемых ядер с окружающей их «решеткой» − остальным веществом (электронами и другими ядрами, исключая исследуемые) эта выделяемая энергия поглощается «решеткой», то есть включается механизм спин-решеточной релаксации, и переход ядер в низшее энергетическое состояние происходит без излучения энергии, а за счет релаксации. В результате в низкоэнергетическом состоянии всегда имеется небольшой избыток ядер ( 0.001%), подчиняющихся больцмановскому распределению, что способствует постоянному поглощению образцом энергии внешнего радиочастотного поля. При этом, если на исследуемые ядра подействовать внешним радиочастотным полем этой же частоты, то, с точки зрения квантовой механики, должно происходить резонансное поглощение ядрами кванта h энергии наложенного радиочастотного поля, сопровождаемое переходом их из состояния с низкой энергией в состояние с высокой энергией. В этих переходах заключается сущность ядерного магнитного резонанса.
Соотношение (2) является основным уравнением ядерного магнитного резонанса. Согласно основному уравнению ЯМР (2) исследуемое ядро
55

должно иметь только одну характеристическую частоту для заданной напряженности магнитного поля. Однако в действительности резонансный сигнал магнитного ядра наблюдается при разных частотах, в зависимости от того, в каком химическом окружении он находится. Местонахождение резонансного сигнала в спектре обусловлено, прежде всего, диамагнитным экранированием ядра окружающими электронами, которые под влиянием приложенного магнитного поля Н0 индуцируют собственные магнитные поля, уменьшающие поле Н0. Таким образом, суммарное магнитное поле, взаимодействующее с ядром, имеет величину Н эфф = Н0 – Н0, где второе слагаемое представляет электронное экранирование. В результате этого условие резонанса ядра выражается не уравнением (2), а уравнением:
где −безразмерное число, называемое константой экранирования. Расстояние между резонансными сигналами различных протонов называется химическим сдвигом (ХС). Абсолютный ХС (смещение сигнала относительно сигнала неэкранированного протона) экспериментально определить невозможно, поэтому химический сдвиг измеряется относительно сигнала эталонного вещества. В качестве международного эталона в протонном магнитном резонансе (ПМР) используется тетраметилсилан – (CH3)4Si (ТМС), который имеет сигнал в более сильном поле, чем большинство исследуемых протонов.
Так как электронное экранирование прямо пропорционально напряженности приложенного магнитного поля, то расстояние между сигналами исследуемого образца и эталона также пропорциональна напряженности поля (или частоте). Выпускаемые серийные приборы работают на разных частотах, поэтому, учитывая применение в ЯМР-спектроскопии магнитных полей различной напряженности, целесообразно выражать величину ХС в единицах, не зависящих от напряженности поля. Для этого используют параметр : = Hобр − Hэт ,
Hэт
где Нобр и Нэт – напряженности полей, отвечающие резонансным частотам ядер исследуемого образца и эталона.
Так как шкалу спектра обычно градуируют в гц, то приведенное выше уравнение удобно представить в виде
= |
. |
10 |
6 |
, |
|
ген |
|
|
|
где − безразмерная величина, отвечающая миллионным долям поля или |
||||
частоты (м.д.) (в иностранной литературе ppm – parts per millions), −разность частот поглощения образца и эталона, гц; 106 – множитель, введенный для удобства; ген−рабочая частота генератора, характерная для каждого данного прибора, гц.В протонном магнитном резонансе введена стандартная -шкала, в которой положение пика ТМС принято за
56

нуль, а сдвиги в слабое поле считаются положительными. В течение нескольких лет преобладала и до сих пор широко используется так называемая -шкала, в которой положительными считаются сдвиги в сильное поле, но за нуль совершенно произвольно принята точка = 10, характерная для сигнала альдегидных протонов. Таким образом, = 10 – . За исключением очень кислых протонов с резко электроотрицательным окружением, величины всегда положительны. Чем больше численная величина , тем более экранирован соответствующий ей протон. В таблице 1.7[9] приведены интервалы химических сдвигов наиболее характерных молекулярных протонсодержащих фрагментов.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 1.7 |
|
|
|
|
|
|
|
|
|
|
|
Интервалы химических сдвигов различных типов протонов |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Протонсодержащие группы |
, м.д. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
0.8 – 4.0 |
|
|||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
CH2 |
|
|
|
|
|
|
1.1 – 4.5 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
CH |
|
|
|
|
|
|
|
1.4 – 6.3 |
|
||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.0 – 6.5 |
|
|
|
|
|
CH (олефины) |
|
|||||||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
CH (ацетилены) |
2.3 - 2.9 |
|
|||||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(ароматические протоны) |
6.5 – 8.3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(ароматические протоны |
|
|
|
|
|
|
|
|
|
|
|
|
|
X |
гетероароматических |
6.0 – 10.2 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
соединений) |
|
|
|
|
|
|
|
C |
|
H |
|
|
(альдегиды) |
9.0 – 10.5 |
|
||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
O |
|
|
|
|
|
||||||||
|
|
|
|
OH (спирты) |
2.0 – 4.5 |
|
||||||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
OH (фенолы) |
4.5 – 9.0 |
|
|||||||||||||
|
|
|
|
|||||||||||||||
|
|
|
OH (кислоты) |
9.0 – 14.6 |
|
|||||||||||||
|
|
|
|
|||||||||||||||
|
|
|
|
|
NH |
|
|
|
(амины) |
1.0 - 2.9 |
|
|||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
NH |
|
|
|
(амиды) |
5.0 – 8.0 |
|
|||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
SH |
(сульфиды) |
1.2 – 4.7 |
|
||||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
57 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 1.8 |
|
|
|
Константы спин-спинового взаимодействия протонов |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
J, гц |
|
Тип соединения |
|
|
|
||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Интервал |
|
Типичное значение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
2 |
|
3 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|||||||
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 – 20 |
|
|
|||||
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
− |
|||||||||
|
CH |
|
CH |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 – 9 |
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
CH2 |
|
|
|
|
R |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
6.5 − 7.5 |
|
|
|||||
|
|
C |
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
7.2 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|||||
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 – 3 |
|
0 – (-2) |
|||||||
|
|
|
C |
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
C |
|
|
|
|
|
|
|
|
C |
|
H |
|
10 – 18 |
|
17 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
C |
|
CH |
|
|
|
|
CH |
|
C |
6 – 12 |
|
10 |
|||||||||||||
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
HC |
|
|
|
|
|
|
|
CH |
|
9 – 13 |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
CH |
|
C |
|
|
CH |
|
|
10 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 – 10 |
|
9.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 – 3 |
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
58 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
2 |
3 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|||
|
|
C |
|
|
|
|
|
C |
|
|
|
5 – 8 |
6 |
||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
C |
|
|
H |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
||
|
|
C |
|
|
|
|
C |
|
|
|
4 – 10 |
7 |
|||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
C |
|
|
H |
|
|
||
|
|
H |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
орто |
6 – 10 |
9 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
H |
мета |
|||||||
|
|
|
|
|
|
|
|
|
0 – 3 |
3 |
|||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
пара |
0 – 1 |
0.3 – 0.6 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
4 |
|
|
|
|
|
|
|
|
|
|
(2 − 3 ) |
5 – 6 |
5 |
||
|
5 |
|
3 |
|
|
|
|
|
|
|
|
(3 − 4 ) |
7 – 9 |
8 |
|||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
6 |
|
|
2 |
|
|
(2 |
− 4, 3 − 5 ) |
1– 2 |
1.5 |
|||||||
|
|
N |
|
|
|||||||||||||
|
|
|
|
|
(2 |
− 5, 2 − 6 ) |
0 – 1 |
0.5 |
|||||||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ценную информацию о строении органического соединения можно получить не только на основании химических сдвигов, но и из величины спин-спинового расщепления, возникающего в результате взаимодействия неэквивалентных протонов через валентные электроны. Как уже было сказано, ядра со спином ½ в магнитном поле находятся в двух состояниях: с магнитным моментом, ориентированным по полю, и против него. Следовательно, каждое магнитное ядро, например, НА создает в месте расположения связанного с ним другого ядра НВ два дополнительных локальных магнитных поля: одного, уменьшенное по сравнению с H0, и другое, увеличенное на ту же величину. Таким образом, вместо одного сигнала, соответствующего химическому сдвигу протона НВ, появятся два сигнала. Расстояние между ними, выраженное в гц, пропорционально энергии спинспинового взаимодействия и называется константой спин-спинового взаи-
59
модействия (КССВ). Ее обозначают буквой J. Мультиплетность сигнала ядра, находящегося под воздействием других, неэквивалентных ему магнитных ядер, определяется выражением (n + 1), где n – число воздействующих ядер.
Таким образом, сущность ССВ заключается в том, что данное ядро через электроны связи получает информацию о мгновенной пространственной ориентации соседнего ядра в виде небольшой составляющей магнитного поля, которая накладывается на внешнее магнитное поле, В результате этого спектры ЯМР высокого разрешения имеют сверхтонкую структуру, вид которой зависит от числа и электронного окружения ядер, связанных с изучаемым ядром.
Величина КССВ не зависит от напряженности приложенного магнитного поля Н0, она определяется природой взаимодействующих ядер, числом и характером связей между ними и геометрией молекулы. Поэтому важно знать как интервалы констант J протонов в различном окружении, так и их наиболее типичные значения (табл. 1.8)[9].
Интенсивность сигнала ЯМР – это площадь линии поглощения, которая прямо пропорциональна числу резонирующих ядер. Измеряя относительные интенсивности двух или большего числа резонансных линий, можно оценить относительное число исследуемых ядер, находящихся в различных функциональных группах (то есть в различном химическом окружении). Измерение интенсивности линии поглощения производится с помощью специального электронного устройства − интегратора в любых линейных единицах (чаще всего в мм.).
Итак, используя три основных параметра ЯМР – химический сдвиг, константу спин-спинового взаимодействия и высоту интегральной кривой, можно сказать, сколько и каких (то есть находящихся в каком окружении) исследуемых ядер содержится в молекуле органического соединения; в большинстве случаев это практически эквивалентно определению структуры соединения.
60
