
796
.pdf
2. Нуклеофильные свойства амидного азота N - − реакции с электрофилами.
В отличие от аминов, амиды кислот являются лишь очень слабыми основаниями. Это обусловлено – М-эффектом карбонильной группы и понижением электронной плотности на атоме азота. Так, образование солей амидов наблюдается лишь с очень сильными кислотами, при этом протонированию подвергается атом кислорода, так как образующийся при этом катион стабилизируется за счет мезомерии:
|
|
O |
|
|
|
|
OH |
R |
|
C |
+ H+ |
|
R |
|
C |
|
|
||||||
|
|
||||||
|
|
NH |
|
|
|
N+H |
|
.. |
2 |
2 |
|||||
3. Электрофильные свойства водорода Н + при амидном азоте – реакции с нуклеофилами.
Хотя амидный азот −слабое основание, в то же время амиды являются слабыми кислотами Бренстеда. При взаимодействии с Na или амидом Na в диэтиловом эфире образуются соли, содержащие амбидентный ион.
|
|
O |
|
|
|
O− |
R |
|
C |
|
R |
|
C |
|
||||||
|
|
|
||||
|
|
N−H |
|
|
|
NH |
а) в случае серебряных солей амидов, наблюдается О-алкилирование:
|
|
O |
|
|
OR' |
|
R |
|
C |
+ R'X |
R |
|
C + AgX |
|
|
|||||
.. |
NHAg |
|
|
NH |
||
б) соли щелочных металлов дают N-алкилирование:
|
|
OK |
|
|
O |
|
R |
|
C + R'X |
R |
|
C |
+ KX |
|
|
|||||
|
|
NH |
|
|
|
NHR' |
.. |
|
|
|
|
||
3.Электрофильные свойства углерода С + − реакции с нуклеофилами:
а) водородными:
− гидрирование молекулярным водородом (реакция Розенмунда)
|
|
O |
|
Pd, BaSO4 |
|
|
O |
R |
|
C + H |
R |
|
C + HCl |
||
|
|
|
|||||
|
|
Cl |
.. 2 |
|
|
|
H |
|
|
|
|
|
|
||
б) кислородными:
161
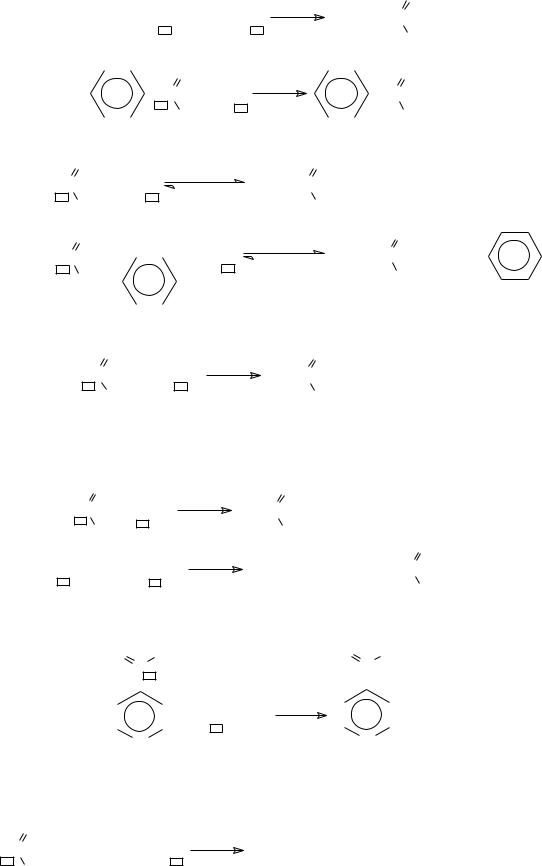
− гидролиз
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(CH CO) O |
+ H O |
|
|
2 CH |
|
|
|
|
C |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
2 |
|
|
|
2 .. |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
OH |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C + H O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
+ HCl |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
2 .. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H+ или HO− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
H C |
|
|
|
|
C |
|
|
|
+ H O |
|
|
|
H C |
|
|
|
C |
+ CH OH |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
3 |
|
|
|
|
|
OCH3 |
|
2 .. |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
OH |
|
|
|
|
|
|
3 |
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
H+ или HO− |
|
|
|
|
|
|
|
|
|
O |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
H C |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ H2O |
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
C + H2N |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
3 |
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
.. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
− алкоголиз (переэтерификация) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
R"O− |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
R |
|
C |
|
+ R"OH |
|
|
R |
|
|
C |
+ R'OH |
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
OR' |
|
|
|
|
|
|
.. |
|
|
|
|
|
|
|
|
|
|
|
|
OR" |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
в) азотными: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
− амидирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
R |
|
C + 2 NH |
|
|
|
R |
|
|
C |
+ NH Cl |
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
.. |
|
|
3 |
|
|
|
|
|
|
|
|
NH2 |
|
|
4 |
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
(CH CO) O + |
|
RNH |
|
|
|
|
|
CH COOH |
+ |
H C |
|
|
C |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
3 |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
.. |
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
NHR |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
− гидразинолиз |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
C |
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
C |
NHNH2 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ H N |
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
|
+ HCl |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
2 |
.. |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
г) металлическими: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
− восстановление |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 Na |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
R C |
4C2H5OH |
+ |
|
|
|
|
|
|
RCH2NH2 + H2O + 4C2H5ONa |
||||||||||||||||||||||||||||||||||||||||||
NH2 |
. |
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
162 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
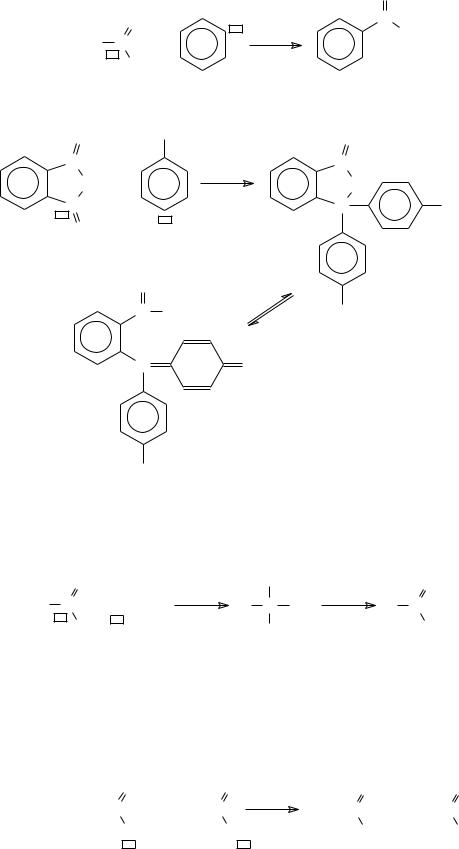
д) углеродными:
−арилирование (реакция Фриделя-Крафтса)
|
|
|
|
|
|
O |
|
|
|
O |
|
.. |
|
|
C |
CH3 |
|
|
|
|
AlCl |
|
|
|
||
H3C |
C + |
|
|
|
|
|
||
|
|
3 |
|
|
|
+ HCl |
||
|
|
|
|
|
|
|||
|
Cl |
|
|
|
|
|
|
|
− образование фенолфталеина |
|
|
|
|
||||
O |
OH |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
||
C |
|
|
|
|
C |
|
|
|
O |
+ 2 |
|
− H2O |
|
O |
|
|
+ H2O |
C |
|
|
|
C |
|
|
OH |
|
.. |
|
|
|
|
|
|||
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
фталевый |
|
|
|
|
|
|
фенолфталеин− |
|
ангидрид |
|
|
|
|
|
|
||
|
|
|
|
|
|
бесцветное основание |
||
|
O |
|
|
|
|
|
(бензоидная форма) |
|
|
C ONa |
NaOH |
OH |
|
|
|
||
|
|
HCl |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
C |
|
|
O |
|
|
|
|
|
|
фенолфталеин |
|
|
|
|
||
|
|
красного цвета |
|
|
|
|
||
|
|
(хиноидная форма) |
|
|
|
|
||
|
OH |
|
|
|
|
|
|
|
− реакция с реактивом Гриньяра |
|
|
|
|
||||
O |
|
|
|
R' |
H2O |
|
O |
|
R C + R'MgX |
|
R C Cl |
R |
C + MgClX |
||||
|
|
|||||||
Cl |
.. |
|
|
OMgX |
|
|
R' |
|
|
|
|
|
|
||||
5. Нуклеофильные свойства кислорода эфирной группировки О -− реакции с электрофилами:
− ацидолиз
|
|
O |
|
|
O |
|
|
O |
|
O |
R |
|
C |
+ R" |
|
C |
R" |
|
C + R |
|
C |
|
|
|
|
|||||||
|
|
OR' |
|
|
OH |
|
|
OR' |
|
OH |
.. |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
163 |
|
|
|
|
Практическое значение. Сложные эфиры карбоновых кислот ис-
пользуются как растворители в производстве лаков (этилацетат), репелленты (диметилфталат), пластификаторы (диоктилфталат); для приготовления искусственных фруктовых эссенций, применяемых в кондитерской и парфюмерной промышленности, а также в производстве фруктовых напитков (бензилацетат – персиковая эссенция, октилацетат – апельсиновая, этилбутаноат – яблочная и т.д.). Жиры (сложные эфиры глицерина и различных органических кислот в основном C10÷C18), белки являются важнейшими продуктами питания, используются в производстве мыла, олифы, глицерина и высших карбоновых кислот. Фосфолипиды входят в состав клеточных мембран животных организмов. Воски являются защитным средством у растений и строительным материалом у пчел, используются в косметике и медицине для приготовления мазей и лосьонов, а также для изготовления мастик, обувных кремов и высокосортных свечей. Галогенангидриды используются в химической промышленности в качестве синтонов для получения различных производных карбоновых кислот. Ангидриды карбоновых кислот используются в производстве сложных эфиров. Уксусный ангидрид является сырьем для получения ацетата целлюлозы, а фталевый ангидрид – в производстве глифталевых смол и красителей (флюоресцеина и фенолфталеина). Амиды используются в промышленности как растворители (диметилформамид), являются лекарственными препаратами (фенацетин – жаропонижающее средство), витаминами (никотинамид – витамин РР), заменителями сахара в диетическом питании и при заболевании сахарным диабетом (сахарин). Амидами являются белки и полиамидные синтетические волокна (нейлон – продукт поликонденсации адипиновой кислоты и гексаметилендиамина, капрон – -аминокапроновой кислоты).
164
3.12.Амины
Амины – класс органических соединений, содержащих функцио-
нальную аминогруппу:
NH2, NH , N
Классификация. Амины по количеству углеводородных радикалов при атоме азота подразделяются на три группы:
1. Первичные |
R |
|
|
|
NH2 : |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
NH2 , |
|
|
|
|
|
|
|
|
|
NH2 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
метиламин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
анилин |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
2. |
Вторичные |
R |
|
|
|
|
NH |
|
|
|
|
|
R' ( |
|
|
NH |
|
|
|
во вторичных аминах носит |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
название иминогруппы): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
CH3 |
|
NH |
|
C2H5 , |
|
|
|
|
|
|
|
|
|
|
NH |
|
CH3 |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
метилэтиламин |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
фенилметиламин , |
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N -метиланилин |
||||||||||
3. |
Третичные |
|
|
R |
|
|
N |
|
|
|
|
|
R' : |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
R" |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
H3C |
|
N |
|
|
CH3 , |
|
|
|
|
|
|
|
|
N |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
триметиламин |
|
диметилфениламин, N-диметиланилин |
|||||||||||||||||||||||||||||||||
Нахождение в природе. Амины широко распространены в живой природе: в рыбе, некоторых растениях, диамины встречаются в продуктах гниения, разложения.
Методы синтеза:
1. Реакция Гофмана-Меншуткина:
CH3I + 2NH3 |
H3C |
|
NH2 + NH4I |
|||||||||||||
|
||||||||||||||||
CH3I + 2 CH3NH2 |
|
|
|
H3C |
|
NH |
|
CH3 + [CH3NH3]I |
||||||||
|
|
|
|
|
||||||||||||
CH3I + 2 H3C |
|
NH |
|
CH3 |
|
|
|
H3C |
|
N |
|
CH3 + [CH3NH2CH3]I |
||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|||
|
|
|
|
|
|
165 |
|
|
|
|
|
|
|
|||
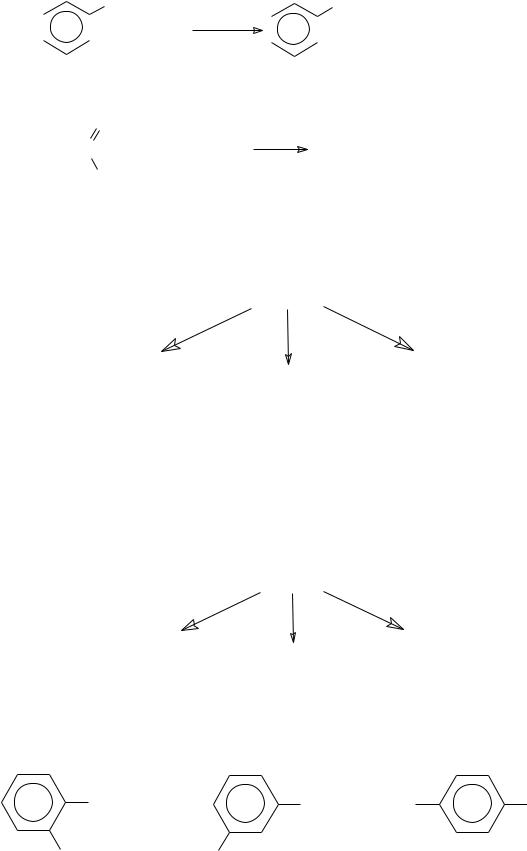
2. Реакция Зинина (восстановление нитросоединений):
|
|
|
|
NO2 |
|
|
|
|
|
NH |
|||||
|
|
|
|
|
|
Ni |
|
|
|
2 |
|
|
|||
|
|
|
|
+ 3H |
|
|
|
|
|
|
|
+ 2H O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
2 |
250 |
−350 |
0 C |
|
|
2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
3. Гидроаминирование альдегидов и кетонов: |
|||||||||||||||
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
C + NH3 + H2 |
|
Ni |
R |
|
|
CH |
|
R' + H2O |
||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
R' |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
Изомерия. Аминам свойственны следующие типы изомерии.
1. Структурная изомерия скелета углеводородной цепи (в данном примере сопровождающаяся изменением классификации амина от первичного до третичного):
C3H9N
CH3CH2CH2NH2 |
CH3CH2NHCH3 |
H3C |
|
N |
|
CH3, |
|
|
|
||||||
н.пропиламин |
|
|
|
|
|
|
|
|
|
CH3 |
|||||
- |
|
|
|
||||
1 аминопропан |
метилэтиламин |
триметиламин |
|||||
|
|||||||
|
N- метиламиноэтан |
N,N- диметиламинометан |
|||||
2. Структурная изомерия положения аминогруппы в углеводородной
цепи:
C5H13N
H2N |
|
CH2CH2CH2CH2CH3 |
CH3 |
|
CHCH2CH2CH3 |
CH3CH2 |
|
CHCH2CH3 |
|
||||||||
|
|
|
||||||
|
|
|
NH2 |
NH2 |
||||
|
|
1-аминопентан |
2 - аминопентан |
3- аминопентан |
||||
NH2 |
NH2 H3CO |
NH2 |
OCH3 |
CH3O |
|
орто- анизидин |
мета -анизидин |
пара -анизидин |
|
166 |
|
Физические свойства. Первые представители алифатических аминов –
CH3NH2, (CH3)2NH, (CH3)3N − являются газообразными веществами,
средние амины – жидкостями, высшие – твердыми веществами. Первые обладают сильным запахом, похожим на запах аммиака, растворяются в воде. С ростом длины углеводородной цепи в радикале растворимость аминов в воде падает, увеличивается их плотность, повышается температура кипения.
Ароматические амины – бесцветные жидкости или твердые вещества, незначительно растворимые в воде. Со временем вследствие окисле-
ния они приобретают желтоватое окрашивание. УФ-поглощение аминов, обусловленное n – *-переходами, соответ-
ствующими возбуждению электронов неподеленной пары азота, наблюдается в трудно используемой коротковолновой области ( 230 нм), поэтому УФ-спектроскопия редко применяется для их идентификации. Появление специфических полос поглощения в ИК-спектрах связано с колебаниями связей N–H и С–Н. Наиболее характерна полоса, отвечающая валентным колебаниям N–H-связи (3500 ÷ 3300 см-1). Для первичных аминов она состоит из двух компонент; спектры вторичных аминов имеют в этой области одну полосу, а третичных – ни одной. Деформационным колебаниям
связи N–H свойственна полоса 1650 ÷ 1500 см-1. Колебаниям С–Н-связи отвечает диапазон 1360 ÷ 1000 см-1. В спектрах ПМР химические сдвиги протонов при атоме азота в аминах имеют значения 1.0 ÷ 2.4 м.д. Но эти значения мало характеристичны и могут изменяться в довольно широких пределах в зависимости от растворителя, температуры и концентрации, а
также благодаря склонности аминных протонов к образованию меж- и внутримолекулярной водородных связей.
Химические свойства. Амины содержат 4 реакционных центра:
− |
|
+ |
|
− |
+ |
|||
|
C |
|
N |
|
H |
|||
|
|
|
||||||
|
|
|
|
|
|
|||
|
|
|
|
|
||||
н.ц. |
|
э.ц. н.ц. |
э.ц. |
|||||
|
||||||||
Вароматических аминах в углеводородном радикале можно отметить 5-й
и6-й реакционные центры, несвязанные с аминогруппой.
Электрофильные свойства водорода H + и C + проявляются слабо. Наиболее высокая нуклеофильная активность в аминах обусловлена неподеленной парой электронов азота N−(в главных химических свойствах). Амины – сильные основания Бренстеда. Алифатические амины относятся к
жестким нуклеофилам благодаря +I-эффекту алкильных групп, тогда как ароматические амины – промежуточные нуклеофилы (−I-эффект ароматического кольца). Кроме того, в ароматических аминах возможна конкуренция между азотным нуклеофильным центром аминогруппы и углеродным нуклеофильным центром ароматического кольца. Азотный нуклеофильный
центр жестче углеродного центра кольца (см. 2.5. «Принцип ЖМКО»). Амины обладают амфотерными свойствами.
167

1. Электрофильные свойства водорода H +(кислоты Бренстеда−реакции с нуклеофилами:
а) азотными:
− металлирование
+ NaNH2 |
+ NH3 |
.. |
|
NH2 |
NHNa |
б) углеродными:
− металлирование
RR'NH + C6H5Li  RR'NLi + C6H6
RR'NLi + C6H6
2. Нуклеофильные свойства азота N− (основание Бренстеда)− реакции с электрофилами:
а) водородными:
– гидратация; у аминов основные свойства настолько сильно выражены, что такой амфотерный оксид, как вода в реакциях с аминами стано-
вится электрофилом
RNH |
+ HOH |
|
[RNH ]OH |
|
[RNH ]+ |
+ OH− |
|
|
|||||
2 |
3 |
3 |
|
|||
Низкомолекулярные алифатические амины растворяются в воде, образуя органические щелочи, при этом гидроксиды алкиламмония являются более сильными щелочами, чем незамещенный гидроксид аммония (+I-эффект алкильной группы)
3[CH3NH3]OH + FeCl3  3 [CH3NH3]Cl + Fe(OH)3
3 [CH3NH3]Cl + Fe(OH)3
− солеобразование
CH3NH2 + HCl [CH3NH3]Cl
[CH3NH3]Cl
NH |
NH3 |
|
|
2 |
HSO4 |
|
+ H2SO4 разб. |
|
б) кислородными: −кислотой Каро (H2SO5)
RR'R"N + H2SO5  RR'R"N
RR'R"N O + H2SO4
O + H2SO4
RR'NH + H SO |
RR'N |
|
OH |
+ H SO |
|
|
|||||
|
2 5 |
|
|
|
2 4 |
C6H5NH2 + H2SO5 C6H5N O + H2SO4 + H2O
C6H5N O + H2SO4 + H2O
168

−трифторнадуксусной кислотой
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
RR'R"N + |
F C |
|
|
C |
|
|
|
|
|
|
|
|
|
RR'R"N |
O |
|
+ CF COOH |
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
O |
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
− перекисью водорода |
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
C H NH |
|
|
+ 3H O |
|
|
|
|
|
|
|
|
C H NO |
+ |
4H2O |
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
6 5 |
2 |
|
|
|
|
|
2 |
. 2 |
|
|
|
|
|
|
|
|
6 5 |
|
|
2 |
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в) азотными: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
− хлористым нитрозилом (нитрозирование) |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
RR'NH |
+ |
|
|
Cl |
|
N |
|
|
O |
|
|
|
|
|
|
|
RR'N N |
|
|
O |
|
HCl |
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
− диазотирование (раздел 3) |
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
< 5 |
0 C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
− |
|
NaCl + 2 H2O |
|||||||
|
ArNH + NaNO |
|
|
+ 2HCl |
|
|
|
|
|
|
|
[Ar |
|
|
N |
|
|
|
N] Cl |
|
+ |
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
2 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
−нитрозирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
C H |
|
|
NH |
|
|
|
CH |
|
|
+ HO |
|
|
|
N |
|
|
O |
|
|
|
C H |
|
|
N |
|
N |
|
|
O |
+ H O |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
6 5 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
г) галогенными: |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
− |
галогенирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ − |
|
|
|
Na2CO3 + H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ 2HX |
|||||||||||||||||
|
|
|
|
|
R |
|
|
|
NH |
+ 2X |
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
NX |
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
||||
− бромом в ледяной уксусной кислоте с ацетоном |
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
+ Br |
|
|
CH3COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
− |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ Br |
|
|
|
|||||||||||||||||||
|
|
|
|
. |
CH3COCH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
д) серными: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
− |
хлористым тионилом |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
R |
|
NH |
|
+ |
Cl S |
|
|
|
|
O |
|
|
|
|
|
|
|
RN |
|
|
S |
|
|
O + 2 HCl |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
− |
хлорангидридом арилсульфоновой кислоты |
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
R  NH.. 2 + ClSO2C6H4CH3−4
NH.. 2 + ClSO2C6H4CH3−4  RNHSO2C6H4CH3 −4 + HCl
RNHSO2C6H4CH3 −4 + HCl
169
е) углеродными: −алкилирование
RR'R"N + CH3I  [RR'R"NCH3] I
[RR'R"NCH3] I
−альдегидами и кетонами (см. 3.9. «Альдегиды и кетоны»)
−галогенангидридами
|
|
|
|
|
|
|
O |
|
|
|
|
O |
RR'NH + |
R" |
|
|
C |
RR'N |
|
|
C + HCl |
||||
|
|
|
|
|||||||||
.. |
|
|
|
|
|
|
Cl |
|
|
|
|
R" |
|
|
|
|
|
|
|
|
|
|
|
||
− сероуглеродом |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
RR'NH + S |
|
C |
|
|
S |
RR'N |
|
|
C |
|||
|
|
|
|
|
||||||||
|
|
|
|
|
||||||||
.. |
|
|
|
|
|
|
|
|
|
|
|
SH |
|
|
|
|
|
|
|
|
|
|
|
|
|
− фосгеном
C6H5NH.. 2 + Cl2C O  C6H5N C O + 2 HCl
C6H5N C O + 2 HCl
− ангидридами карбоновых кислот
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
С |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
O |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
NH + |
|
|
|
O |
|
|
|
|
|
|
|
NH |
|
C |
+ |
H C |
|
C |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
.. 2 |
|
H C |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
3 |
|
OH |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
− |
карбоновыми кислотами |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
NH |
|
+ |
H C |
|
C |
|
|
|
|
NH |
|
C |
+ H O |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
.. 2 |
|
3 |
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
2 |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
ж) фосфорными: |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
− |
пентахлоридом фосфора (реакция Кирсанова) |
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
ArNH + PCl |
|
ArN |
|
|
PCl + |
|
2 HCl |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
5 |
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|||||||
− хлорангидридом диалкиловых и диариловых эфиров фосфорной кислоты
|
|
|
|
O |
|
|
O |
||||
RR'NH + |
Cl |
|
P |
|
|
OR" |
RR'N |
|
P |
|
OR" + HCl |
|
|
|
|
|
|||||||
.. |
|
|
|
OR" |
|
|
OR" |
||||
|
|
|
|
|
|
||||||
|
|
|
|
170 |
|
|
|
|
|
||
