
796
.pdf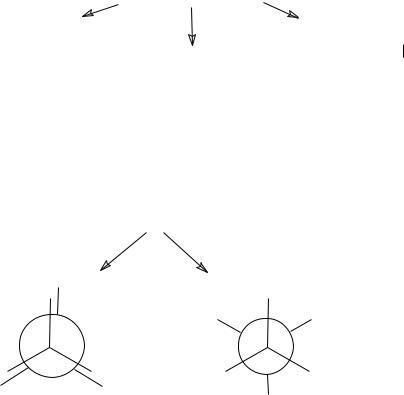
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С5Н12 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
||
CH3 |
|
CH2 |
|
CH2 |
|
CH2 |
|
|
CH3 |
CH3 |
|
|
|
CH |
|
CH2 |
|
CH3 |
CH3 |
|
C |
|
CH3 |
||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СH3 |
|
|
|
|
CH3 |
||||||
|
|
н.пентан, |
|
|
|
|
изопентан, |
|
|
неопентан, |
|||||||||||||||
|
|
пентан |
|
|
|
2 −метилбутан |
|
|
2,2 − диметилпропан |
||||||||||||||||
|
2. Конформационная изомерия: |
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
H |
CH3 |
|
|
CH3 |
|
H |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
H |
|
|
|
|
|
H |
|
H |
|
|
|
|
|
|
||||
|
|
|
|
H |
|
|
H |
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
заслоненная |
|
конформация |
|
|
|
скошенная (заторможенная) |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
конформация |
|
|
|
|
|
|
||
(проекции Ньюмена)
Физические свойства. Алканы существуют в трех агрегатных состояниях: газообразном (C1 – C4), жидком (C5 – C16) и твердом (C17 и более). С увеличением молекулярной массы алкана температура кипения его повышается (СН4 − -1620С, С2Н6 − -880С, С3Н8 − -420С, С4Н10 − -0.50С и т.д.). Алканы гидрофобны, но лиофильны. Плотность жидких алканов меньше 1. Некоторые алканы имеют специфический запах (например, керосиновая фракция). Алканы с кислородом воздуха образуют взрывчатую смесь, что используется в работе двигателей внутреннего сгорания.
В УФ-области выше 200 нм алканы не поглощают. Полоса ИКпоглощения валентных С – С-колебаний лежит в диапазоне 800 – 1200 см-1. Кроме того, для них характерны следующие типичные полосы поглощения:C−H = 2850 –3000 см-1; в СН3-группах C−H = 1380 см-1, а в СН2-группах – 1460 ÷ 1470 см-1. Резонансные сигналы ПМР протонов насыщенных углеводородов расположены в области высоких полей. Наиболее экранированы метильные группы (0.8 ÷ 4.0 м.д.), метиленовые группы характеризуются химическими сдвигами 1.1 ÷ 4.5 м.д. и наименее экранированы метиновые группы (1.4 ÷ 6.3 м.д.). Как можно заметить, области резонирования указанных групп перекрываются.
91
Химические свойства. Алканы характеризуются наличием двух реакционных центров – нуклеофильного на углероде и электрофильного на водо-
роде |
|
− |
+ |
|
|
|
|||
|
|
С |
|
H |
|
|
|
||
|
.. |
|
||
н.ц. э.ц.
Нуклеофильные свойства углерода выражены более сильно, чем электрофильные свойства водорода. При высокой температуре протекают химические процессы с разрывом углеводородной цепи. Они называются термическими реакциями. Химические связи в алканах обладают низкой полярностью. В результате им свойственны более радикальные процессы, чем ионные. Алканы – мягкие нуклеофилы и поэтому легче реагируют с мягкими электрофилами-радикалами. Для алканов характерны реакции замещения и отщепления (элиминирования). В реакциях замещения соблюдается правило Марковникова. Его сущность состоит в том, что в реакциях алканов с электрофильными реагентами их химическая активность в ряду углеродных атомов − первичный < вторичный < третичный − увеличивается. Это объясняется тем, что энергия диссоциации Н – С –связи в этом ряду
падает: |
CH4 |
CH3. + H. |
435 |
кДж . моль−1 |
||||
|
CH3 |
|
CH3 |
CH3 |
|
CH2. + H. |
410 |
кДж . моль−1 |
|
|
|
||||||
|
(CH3)2CH2 |
(CH3)2CH . + H. |
393 |
кДж . моль−1 |
||||
|
(CH3)3CH |
(CH3)3C . + H . |
377 |
кДж . моль−1 |
||||
1. Нуклеофильные свойства sp3-гибридного углерода С - − реакции с электрофильными реагентами (радикалами):
а) кислородными:
− окисление полное (горение)
|
|
|
|
|
. . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
CH |
+ |
O |
|
O |
|
|
|
CO2 |
+ |
2H2O |
|
||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||
.. 4 |
2 . . |
|
|
|
|
|
|
|
||||||||||||||||||
− окисление неполное |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
||||||||||||
. . |
AlPO |
, 4 50 |
0 C |
1 |
: |
2 |
МПа |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||
CH + O |
|
O |
4 |
|
|
|
, |
|
|
|
|
|
|
H |
|
|
C |
+ H O |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
.. 4 . . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
2 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mn+2 |
|
|
|
|
|
O |
|||||
2 CH CH CH CH + 5 O |
|
O |
|
4CH |
|
|
C |
+ 2H O |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||
3 .. 2 |
|
|
2 |
3 . |
|
|
. |
|
|
|
|
|
|
|
3 |
|
|
2 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
б) азотными: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
−нитрование по Коновалову |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
разб. |
|
|
|
1400 C |
|
|
|
|
|
|
|
|
|
|
|||||||
R |
|
H + HO |
|
|
NO2 |
|
|
|
|
R |
|
NO2 + H2O |
|
|||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||
.. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
92 |
|
|
|
|
|
|
|
|
|
|||
−нитрозирование
R |
|
|
|
|
|
|
|
h |
R |
R |
||||||||
|
CH |
+ Cl |
|
N |
|
O |
CH |
|
N |
|
O |
C |
|
N |
|
OH + HCl |
||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|||||||||||
R' |
.. |
2 |
|
|
|
|
|
R' |
R' |
|||||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
нитрозосоединение |
оксим |
||||||||
в) галогенными:
|
H3C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
CH |
|
CH2 |
|
|
CH3 |
+ |
Cl2 |
|
H3C |
|
C |
|
CH2CH3 + HCl |
||||||||||||||||
|
|
|
|
[ |
. |
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
.. |
|
|
|
|
|
|
|
|
|
|
|
. ] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
H3C |
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
г) серными: |
|
|
|
|
|
|
||||||||||
|
− сульфоокисление |
|
|
|
. . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
УФ |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
2R H + 2SO2 |
+ O O |
|
|
|
|
2R SO2 OH |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
.. |
|
|
|
|
.. |
|
|
. . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
−сульфохлорирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
R |
|
H + SO |
+ Cl |
|
h |
R |
|
|
|
|
SO |
2 |
|
|
Cl + HCl. |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
.. |
.. |
2 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
2. Электрофильные свойства водорода H + − реакции с нуклеофилами:
а) дегидрирование – реакция отщепления водорода от молекулы органического соединения:
CH3 |
|
|
CH2 |
|
|
CH2 |
|
|
CH3 |
Pt |
CH3 |
|
|
CH |
|
|
CH |
|
|
CH3 + H2 |
||||
|
|
|
|
|
|
Pt |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
CH3 |
|
|
CH |
|
|
CH |
|
|
CH3 |
CH2 |
|
|
CH |
|
|
CH |
|
|
CH2 + H2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
б) дегидроциклизация (ароматизация). Реакции дегидроциклизации подвергаются алканы, имеющие в главной углеводородной цепи не менее 6-ти углеродных атомов:
CH CH CH CH CH CH |
Pt, Al2O3 |
|
|
|
+ 4 H |
||||||
|
|
||||||||||
3 |
2 |
2 |
2 |
2 |
3 |
0 |
|
|
|
|
2 |
|
|
|
|
|
|
300 |
C |
|
|
|
|
в) пиролиз метана:
2CH4 13000 C
на воздухе
HC CH + 3H2
CH + 3H2
3. Термические реакции:
Органические соединения менее устойчивы, чем неорганические. При высокой температуре органические молекулы подвергаются процессам разрыва углеводородной цепи. Это можно показать на примере алканов:
93

а) полный распад органических молекул, например, метан при температуре выше 10000С без доступа воздуха распадается на исходные веще-
ства
CH4  C + 4H
C + 4H
б) крекинг – это реакция отщепления отдельных фрагментов углеводородной цепи от молекулы органических веществ
C18H38 40 0 ÷ 5 00 С C9H20 + C9H18
в) изомеризация (см. В.5 «Номенклатура органических реакций)». Практическое значение. Метан используют в качестве топлива, сырья для производства формальдегида, муравьиной кислоты, фреонов, растворителей (CHCl3, CH2Cl2, CCl4) и пластмасс. Этан – сырье для производства этилена и полиэтилена. Пропан и бутан – топливо, сырье для получения пропена и бутена и полимеров на их основе. Жидкие углеводороды С5Н12 С16Н34 используются в качестве моторного топлива – бензина, керосина, лигроина. Высшие углеводороды применяют в качестве дизельного топлива (газойль) и смазочного масла.
Качество моторного топлива для автомобилей оценивается октановым числом. Октановое число – это показатель устойчивости топлива при высоких степенях сжатия. Оно определяется по стандартной шкале, где количество одного из изомеров октана (2,2,4-триметилпентана) принято за 100%, а н-гептана − за нуль. Смешивая изооктан и н-гептан в различной пропорции, можно получить топливо с любым октановым числом. Так, например, состав автомобильного бензина Аи-92 аналогичен смеси 92% изооктана и 8% н-гептана.
Для ракетных двигателей, наоборот, ценны топлива с нормальной цепью углеродных атомов, обладающих низкой температурой воспламенения. Эту характеристику оценивают цетановым числом. Цетановое число гексадекана С16Н34 принято за 100, а 1-метилнафталина – за нуль.
94

3.2. Алкены (олефины, этиленовые углеводороды)
Алкены – класс алифатических углеводородов, содержащих функциональную группу с двойной связью между углеродными атомами:
C C
C
Алкены образуют гомологический ряд с общей формулой CnH2n:
H2C CH2
H2C CH CH3
H2C CH CH2 CH3
этен ; пропен ; бутен и т.д.
Классификация. Алкены можно условно разделить на две группы:
а) несимметричные алкены |
H2C |
|
CH |
|
CH2 |
|
|
CH3 |
бутен −1 ; |
|
|
|
|
|
|||||||
б) симметричные алкены |
H3C |
|
CH |
|
CH |
|
CH3 |
бутен −2 |
||
|
|
|
||||||||
Нахождение в природе. Этилен присутствует в соках плодово-ягодных растений, является ростовым гормоном, контролирует созревание фруктов и появление у них окраски. Этилен и пропилен образуются при бактериальном разложении органических остатков в анаэробных условиях. В составе нефти олефинов встречается очень мало, однако, в канадской нефти их содержится значительное количество.
Методы получения
1. Дегидрирование алканов:
H3C |
|
CH2 |
|
CH2 |
|
CH3 |
Cr2O3 |
H3C |
|
CH |
|
CH |
|
CH3 + H2 |
||
|
|
|
600 |
0 |
C |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2. Дегидратация спиртов:
H3C |
|
CH2 |
|
OH |
конц. H2SO4 |
H2C |
|
CH2 |
+ H2O |
|
|
|
0 |
C |
|
||||||
|
|
|
|
|
170 |
|
|
|
|
|
3. Дегидрогалогенирование галогенуглеводородов в спиртовой щелочи:
H3C |
|
CH2 |
|
CH2 |
|
Cl |
NaOH |
H3C |
|
CH |
|
|
|
CH2 + NaCl + H2O |
||||
|
|
|
спиртовой |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4. Дегалогенирование раствор |
дигалогенуглеводородов: |
|||||||||||||||||
|
|
|
H3C |
|
CH |
|
CH2 + Zn |
|
|
H3C |
|
CH |
|
CH2 + ZnCl2 |
||||
|
|
|
|
|||||||||||||||
Cl Cl
Изомерия. Алкенам свойственны следующие типы изомерии:
1. Структурная изомерия положения двойной углерод-углеродной связи:
95

|
|
|
|
|
|
|
|
|
|
C4H8 |
|
|
|
|
|
|
|
||
|
H2C |
|
CH |
|
CH2 |
|
|
CH3 |
H3C |
|
CH |
|
CH |
|
CH3 |
2. Гео- |
|||
|
|
|
|
|
|
|
|
||||||||||||
мет- |
|
|
бутен -1 |
|
|
|
|
|
бутен - 2 |
рическая изо- |
|||||||||
мерия: |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
H3C |
|
CH3 |
H3C |
|
|
H |
|
||||||||
|
|
|
|
|
C |
|
|
C |
|
С |
|
С |
|
||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
H |
|
H |
H |
|
|
CH3 |
|
|||||||
|
|
|
|
|
цис - бутен - 2 |
транс -бутен-2 |
|
||||||||||||
Физические свойства. Алкены существуют в трех агрегатных состояни-
ях: газообразные (С2 С4), жидкие (С5 С16) и твердые (С17 и выше). Так,
например, октадецен имеет температуру плавления 180С. Алкены гидрофобны и лиофильны. Плотность жидких алкенов меньше единицы, но больше, чем плотность соответствующих алканов. Также и температура кипения алкенов выше, чем у алканов с тем же количеством углеродных атомов.
В УФ-области непредельные углеводороды имеют интенсивную полосу поглощения 165 – 200 нм, обусловленную переходом *. В ИКспектрах алкенов имеется характеристическая полоса в области 1680 1640 см-1, соответствующая валентным колебаниям связи С = С, а деформационным колебаниям связей С – Н отвечают интенсивные полосы в области 920 980 см-1. В области поглощения ПМР химические сдвиги олефиновых протонов находятся в интервале 4.0 6.5 м.д. Экранирование этих протонов (по сравнению с протонами у насыщенных атомов углерода) существенно понижено ввиду диамагнитной анизотропии двойной связи.
Химические свойства. Алкены имеют 4 реакционных центра:
|
|
|
|
|
н.ц. |
.. − |
|
|
|
|
− |
|
|
+ |
|
− |
|
R |
|
CH |
|
CH |
|
CH |
||
|
|
|
||||||
.. |
2 |
|
|
.. |
2 |
|||
|
|
н.ц. |
|
|
э.ц. |
|
н.ц. |
|
Нуклеофильные свойства алкенов, определяемые sp2- и sp3-гибридными углеродными атомами и -электронным облаком двойной связи, проявляются сильнее, чем электрофильные, обусловленные sp2-гибридным углеродом. sp2-Гибридный углерод по сравнению с sp3-гибридным углеродом является более жестким нуклеофильным центром, поэтому в зависимости от жесткости электрофильных реагентов возможны различные направления химических реакций (С , С-конкуренция).
Для алкенов в большей степени свойственны реакции присоединения, что обусловлено низкой энергией -связи. В реакциях присоединения
96
протоноподвижных соединений к несимметричным алкенам соблюдается правило Марковникова (см. 1.3. «Электронные эффекты в органической химии»).
1. Нуклеофильные свойства sp2-гибридного углерода C− – реакции с электрофильными реагентами:
а водородными:
− гидрогалогенирование
R |
|
CH |
|
CH + HX |
R |
|
CH |
|
CH |
||
|
|
||||||||||
|
|
|
|||||||||
.. 2 |
|
|
3 |
||||||||
|
|||||||||||
|
|
|
|
|
|
|
X |
||||
− сульфатирование – реакция введения сложноэфирной группы серной кислоты
(CH ) C |
|
|
CH |
+ HOSO H |
|
(CH ) C |
|
CH |
|||
|
|
|
|||||||||
|
|
||||||||||
3 2 |
.. 2 |
|
3 |
3 2 |
|
3 |
|||||
|
|
|
|
|
|
|
|
OSO3H |
|||
(CH3)2C |
|
|
CH3 |
H2O |
(CH3)2C |
|
CH3 + H2SO4 |
||||
|
|
|
|
||||||||
|
OSO3H |
|
OH |
|
|
||||||
б) кислородными:
− полное окисление (горение)
H2C CH.. 2 + 3O2
CH.. 2 + 3O2  2CO2 + 2H2O
2CO2 + 2H2O
−неполное окисление
H C |
|
CH |
+ O |
Ag H2C CH2 |
|
2 |
|||
|
||||
2 |
.. 2 |
|
||
|
|
|
|
O |
−озонирование – реакция введения озона в молекулу органического вещества
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
H C |
|
CH |
|
CH |
+ O |
|
|
|
|
O |
O |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
3 |
.. 2 |
|
|
|
3 |
H3C |
|
HC CH2 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
первичный озонид |
|
|
|||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|
|
O |
|
|
|
|
|
H3C CH CH2 |
H2O |
H C |
|
C |
+ H |
|
C |
+ H O |
2 |
||||||||
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
2 |
||
|
|
|
|
O |
|
|
O |
|
|
|
|
|
H |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
вторичный озонид
97
в) галогенными − галогенирование
RHC |
|
CHR' + X |
|
X |
R |
|
CH |
|
CH |
|
R' |
||
|
|
|
|
|
|||||||||
.. |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
X |
|
X |
||||
г) металлическими:
−гидроксилирование
|
|
−2 |
|
|
|
|
|
|
|
|
|
|
|
+ 7 |
|
|
|
|
|
|
|
|
|
|
−1 |
|
|
|
|
|
|
+ 4 |
|
|
|
|||||||||||||||||
|
H C |
|
|
CH |
|
2KMnO |
|
|
|
H O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
2MnO2 |
+ |
2 KOH |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
4 |
|
|
|
3H2C CH2 |
||||||||||||||||||||||||||||||||||||||||||||
|
3 |
2 |
|
|
.. 2 |
|
|
+ |
|
|
|
+ |
2 |
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
−2 |
|
|
|
|
|
|
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
|
|
|
OH OH |
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
C |
|
|
|
|
2 e |
|
2 |
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
2 |
|
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
+ 7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ 4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
Mn + 3 |
e |
|
|
Mn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
− полимеризация |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
AlCl3 |
|
|
|
( |
|
|
|
|
|
|
|
|
|
|
|
|
|
) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n R |
|
|
CH |
|
|
CH |
|
|
|
|
CH |
|
CH |
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.. |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
д) углеродными: |
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
− карбонилирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ni(CO)4 R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|||
|
|
|
R |
|
|
|
CH |
|
|
|
CH + |
|
CO + H |
|
|
|
|
CH |
|
|
|
CH |
|
|
|
C |
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.. |
2 |
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
|
2 |
|
|
|
H |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
− карбоксилирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Co2(CO)8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
R |
|
|
|
CH |
|
|
|
CH |
+ CO + |
H O |
R |
|
|
CH |
|
|
|
CH |
|
|
|
C |
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.. 2 |
|
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
2 |
|
|
OH |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2. Электрофильные свойства sp2-гибридного углерода С + – реакции с нуклеофилами:
а) водородными:
−гидрирование
|
R |
|
CH |
|
CH |
|
R' + H |
|
Pt |
R |
|
CH CH |
|
R' |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
||||||||||
|
.. |
2 |
|
2 2 |
|
|
||||||||
−гидроборирование – реакция введения гидрида бора
|
6 (CH3)2C |
|
|
CH2 |
+ B2H6 |
2[(CH3)2CH |
|
|
CH2]3B |
|||||||
|
|
|
|
|
||||||||||||
|
|
|
||||||||||||||
|
|
|
|
|
|
|
.. |
|
|
|
|
|
|
|
|
|
|
б) кислородными: |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
−гидратация |
|
|
|
|
|
|
H+ |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
CH2 |
|
|
CH2 |
+ H |
|
OH |
CH3 |
|
CH2 |
|
|
OH |
|||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
.. |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
98 |
|
|
|
|
|
|
|
|
|
в) азотными: −аминирование
|
|
|
|
|
|
|
|
|
+ Cl |
|
|
NH |
|
+ R |
|
|
ONa |
|
|
|
|
|
|
|
|
H2C |
|
|
CH2 |
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
H C |
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ NaCl + ROH |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
2 |
|
2 |
|
|
|
|
|
|
.. |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
||
3. Нуклеофильные свойства sp3-гибридного углерода С− – |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
реакции с электрофилами: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
а) кислородными (SR-механизм): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. . |
|
|
|
t 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
H C |
|
|
|
CH |
|
|
CH + |
|
O |
|
|
O |
|
|
|
|
|
H C |
|
|
|
|
CH |
|
|
|
|
CH |
|
OOH |
||||||||||||||||||||||||||
|
|
2 |
|
|
|
|
|
|
.. |
3 |
|
|
|
|
|
. |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. . |
|
|||||
|
H2C |
|
|
|
CH CH2 OOH |
|
R |
|
H |
H2C |
|
|
CH |
|
|
|
|
CH2O |
+ |
OH |
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
H2C |
|
|
|
|
CH |
|
|
|
|
CH2OH |
+ |
R' |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
H2C |
|
|
|
CH |
|
|
CH2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O . |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2C |
|
CH |
|
|
C |
+ H |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
б) галогенными (SR-механизм): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H C |
|
CH |
|
CH + |
Cl |
400 |
.. |
600 C |
|
H C |
|
CH |
|
CH Cl + HCl |
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
2 |
|
|
|
|
|
|
|
.. 3 |
|
|
|
2 |
|
|
|
[Cl] |
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
||||||||||||||||||||||
4. Нуклеофильные свойства -электронного облака двойной связи – реакции с мягкими электрофилами (комплексообразование):
CH2 .. CH2 + Pt + Cl2 + KCl  K[Pt(C2H4)Cl3]
K[Pt(C2H4)Cl3]
Практическое значение алкенов. Этен используется в производстве по-
лимеров (полиэтилен), растворителей (этанол, дихлорэтан), антифризов (этиленгликоль). Пропен является сырьем для производства глицерина, изопропанола, полипропилена. Бутены и амилены используются в производстве каучуков. Простейшие алкены (С2H4, C3H6, C4H8) являются фитогормонами, способствуют росту растений, ускоряют созревание плодов.
99

3.3. Алкины (ацетиленовые углеводороды)
Алкины – класс алифатических углеводородов, функциональная группа которых представляет собою пару углеродных атомов, связанных
тройной связью |
|
|
|
|
|
C |
|
|
|
C |
|
. Гомологический ряд алкинов, имеющих об- |
|||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||
щую |
формулу |
C n H2 n −2 , может быть представлен как: |
|||||||||||||||||||||||||
HC |
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ацетилен, этин ; |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
HC |
|
|
|
|
C |
|
|
|
CH3 |
|
|
|
|
|
|
|
метилацетилен, |
пропин ; |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
HC |
|
|
|
C |
|
|
CH2 |
|
|
|
CH3 |
|
|
|
|
этилацетилен, |
бутин −1 ; |
||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||
H3С |
|
|
|
CH2 |
|
C |
|
|
C |
|
CH3 |
|
метилэтилацетилен, пентин -2 и т.д. |
||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
Классификация. Различают алкины симметричного и несимметричного строения:
H3С C C CH3 бутин -2
C CH3 бутин -2
и
HC C CH2 CH3 бутин-1
C CH2 CH3 бутин-1
Нахождение в природе. Производные ацетилена редко встречаются в природе. Как известно, они не играют важной роли в биохимии большинства организмов. Алкины обнаружены в межзвездном пространстве, например, пропин.
Методы синтеза
2. Алкилирование ацетиленида натрия с галогенуглеводородами:
HC C Na + RI
C Na + RI  HC
HC C R + NaI
C R + NaI
3. Дегидрогалогенирование полигалогенуглеводородов:
H3C |
|
CH |
|
CH |
|
CH3 + 2KOH (спиртовой) |
H3C |
|
C |
|
C |
|
CH3 + 2KCl + 2H2O |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
Cl Cl
4. Дегалогенирование полигалогенуглеводородов:
H3C CCl2 CCl2 CH3 + 2 Zn  H3C C
H3C C C CH3 + 2 ZnCl2
C CH3 + 2 ZnCl2
Изомерия. Как и любым ненасыщенным углеводородам, алкинам свойственны следующие типы изомерии:
100
