
796
.pdfНасыщенные гетероциклические соединения, содержащие один или несколько гетероатомов с неподеленными парами электронов, имеют в спектре УФ-поглощения полосы, соответствующие переходам n - *. Полосы поглощения кислород- и азотсодержащих соединений лежат в области 171.3 189.7 нм, серосодержащих – 219.0 240.0 нм. Ненасыщенные пятичленные гетероциклы имеют две полосы поглощения: интенсивную коротковолновую − в области 200 210 нм (−*-переход ароматической системы) и малоинтенсивную − в области 250 350 нм (n−*-переход n- электронов неподеленной пары – н.п.э. гетероатома) [4,10]. Аналогичная картина наблюдается и для шестичленных ароматических гетероциклов: интенсивная полоса - *-переходов ароматической системы расположена
вкоротковолновой области и малоинтенсивная полоса n - * -переходов −
вболее длинноволновой области.
ВИК-спектрах ненасыщенных гетероциклических соединений в интервале 1600 ÷ 1300 см-1, как правило, можно обнаружить (как и в арома-
тических углеводородах) 4 полосы поглощения, ответственных за скелетные колебания цикла: в пирроле – 1530, 1467, 1418, 1384 см-1, а также полоса при 3400 см-1, соответствующая валентным колебаниям NH-группы; в
пиридине – 1590, 1572, 1482 и 1430 см-1; в пиримидине – 1570, 1467, и 1402 см-1, а также полоса 1020 ÷ 990 см-1, соответствующая «дышащим» колебаниям кольца; в имидазоле – 1550, 1492, 1451 и 1324 см-1; в индоле –
1624 ÷ 1615, 1600 ÷ 1575, 1565 ÷ 1540 см-1, а также полоса при 3420 см-1,
относящаяся к валентным колебаниям NH-группы.
Спектры ПМР. Протоны ядер ароматических гетероциклов, как и
соответствующих углеводородов, поглощают в слабых полях (6.0 8.5 м.д.) благодаря диамагнитной анизотропии ароматического кольца. Но, в отличие от последних, в спектрах гетероциклов проявляется мультиплетность от спин-спинового взаимодействия всех имеющихся протонов кольца. Протоны, расположенные в α-положении к гетероатомам, дают сигнал поглощения в более слабом поле, чем протоны в других положениях. Протоны группы NH дают сигналы в области 8.0 12.0 м.д.
Химические свойства. Гетероциклические соединения имеют ряд отличительных характеристик.
Во-первых, многие из них обладают ароматическими свойствами, подчиняющимися правилу Хюккеля:
а) имеют плоскую циклическую систему; б) содержат 4n + 2 обобщенных -электронов;
в) имеют непрерывную цепь сопряжения.
191
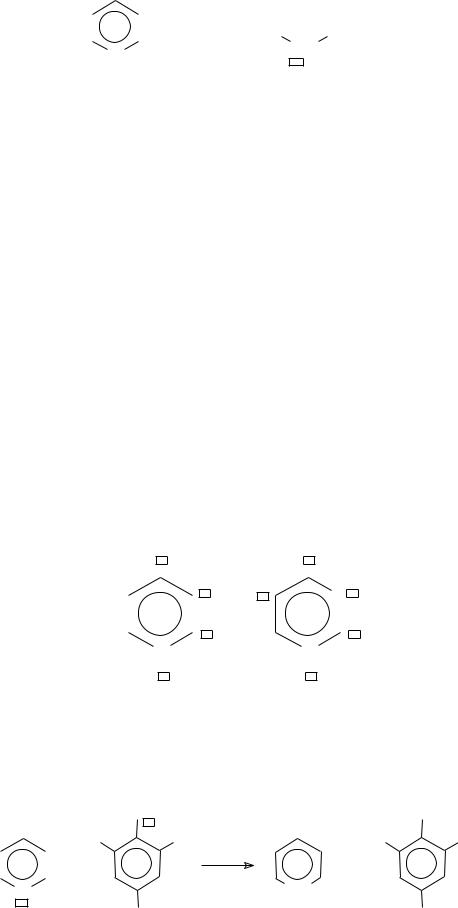
Примеры: |
|
n =1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4n + 2 = 6 |
|
|
|
|
|
N |
|
|
NH |
|||
|
|
|
|
|
|
||
|
.. |
||||||
|
|
||||||
пиридин, |
пиррол, |
в систему сопряжения |
в систему сопряжения |
включены 6 - электронов |
включены 4 - электрона |
трех - связей |
двух - связей и |
|
н.п.э. гетероатома азота |
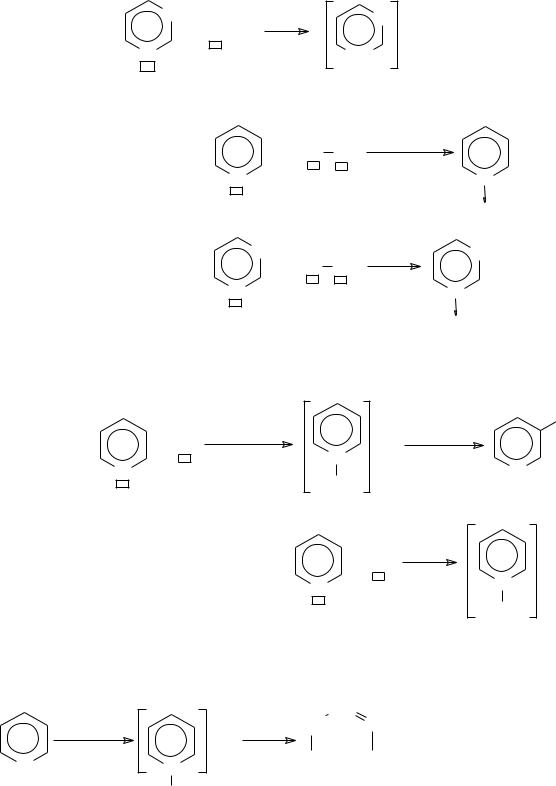
Во-вторых, азотистые гетероциклы, в которых н.п.э. атома азота не вступает в цепь сопряжения, обладают заметными основными свойствами, например, пиридин, пиримидин и др. Насыщенные азотистые гетероциклические соединения (пиперидин, пирролидин, пиразолидин и др.) обладают свойствами вторичных аминов.
В-третьих, пятичленные гетероциклы, пиррол, имидазол и др. являются кислотами Бренстеда.
В-четвертых, для гетероциклических соединений известны реакции раскрытия кольца.
В-пятых, в реакциях пиридина, пиримидина и их производных с электрофильными реагентами наблюдается N, C-конкуренция нуклеофильных центров. При алкилировании серебряных и калиевых солей 2- оксипиридина с иодистым этилом возможна O, N-конкуренция.
Шестичленные гетероциклы. Гетероциклические соединения пиридинового ряда характеризуются наличием двух нуклеофильных (N−, С3− и двух электрофильных центров (C2d+, C4d+). Пиримидиновые гетероциклы обладают тремя нуклеофильными центрами (N1−, N3−, С5− и дву-
мя электрофильными (С2 + С4 +
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
+ |
|
|
|
||||||
|
|
|
|
|
э.ц. |
|
|
− |
|
|
|
|
э.ц. |
− |
|
|
|||||||
|
|
|
4 |
|
|
|
− |
4 |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
3 |
|
.. |
.. |
|
|
5 |
|
|
N .. |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
н.ц. |
н.ц |
. |
|
3 |
|
|
н.ц. |
|
|
|||||
|
|
|
|
|
6 |
|
2 |
|
+ |
|
|
|
|
6 |
2 |
|
|
+ |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
1 |
|
|
|
э.ц. |
|
|
|
|
1 |
|
|
|
|
|
э.ц. |
|
|
|||
|
|
|
|
|
N |
|
|
|
|
|
|
N |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
|
|
− |
|
|
|
||||
|
|
|
.. |
|
|
|
|
|
|
|
|
.. |
|
|
|
|
|
|
|
||||
|
|
|
|
|
н.ц. |
|
|
|
|
|
н.ц. |
|
|
|
|||||||||
1. Нуклеофильные свойства азота N−(основания Бренстеда) – ре- |
|||||||||||||||||||||||
|
|
|
акции с электрофилами: |
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
а) водородными: |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
− солеобразование |
|
O− |
|
|||||||||||||
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O N |
|
NO |
2 |
|
|
|
|
|
|
|
+ |
O N |
NO |
2 |
||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
||
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
.. |
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
пиридин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
пикриновая |
|
|
|
192 |
|
|
|
|
|
|
|
|
|
|
|
пикрат |
|
|||
|
|
|
кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пиридиния |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
N |
|
|
|
N + |
|
|
|
|
N |
+ H2SO4 |
|
|
HSO4− |
|
|
|
|
|
|
NH |
|
|
||
|
|
.. |
|
|
|
|
|
|
|
пиримидин |
|
|
гидросульфат пиримидиния |
|
|||
(однокислотное основание) |
|
|
|
|
|
|||
б) кислородными: |
|
+ HO OH |
CH3COOH |
+ H2O |
||||
− |
окисление |
|
|
|
||||
N |
|
. . |
|
N |
|
|||
|
|
|
|
|
|
|
||
|
|
|
.. |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
N |
+ HO OH |
|
N |
+ H2O |
|
|
|
|
|
|
|
|||
|
|
|
N |
|
. . |
|
N |
|
|
|
|
|
|
|
|
||
|
|
|
.. |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
в) галогенными: |
|
|
|||
|
|
|
– галогенирование |
|
|
|||
|
|
|
низкая |
|
|
+ |
|
Cl |
|
|
|
|
|
|
|
||
|
|
|
температура |
|
− |
нагревание |
|
|
|
|
+ Cl2 |
|
|
|
|||
|
|
|
N |
Cl |
|
+ HCl |
||
|
N |
|
|
|
|
|
N |
|
|
|
|
|
Cl |
|
|
||
|
.. |
|
|
|
|
|
|
|
|
г) углеродными: |
|
|
|
|
+ |
||
|
|
|
|
|
X− |
|||
|
− алкилирование |
|
+ RX |
|
||||
|
|
|
|
|
N |
|
|
N |
|
|
|
|
|
.. |
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
− раскрытие пиридинового кольца |
|
|||||
|
|
|
+ |
|
CH |
|
|
|
|
|
|
|
H2C |
CH |
|
|
|
C6H3(NO2)2Cl |
|
− NaOH |
+ C6H3(NO2)2NH2 |
|||||
|
|
|
Cl |
|
CHO |
CHO |
||
N |
|
N |
|
|
|
|
||
|
|
|
глутаконовый |
|
|
|||
|
|
|
|
|
|
|
||
|
|
C6H3(NO2)2 |
|
альдегид |
|
|
||
|
|
|
|
|
|
|
||
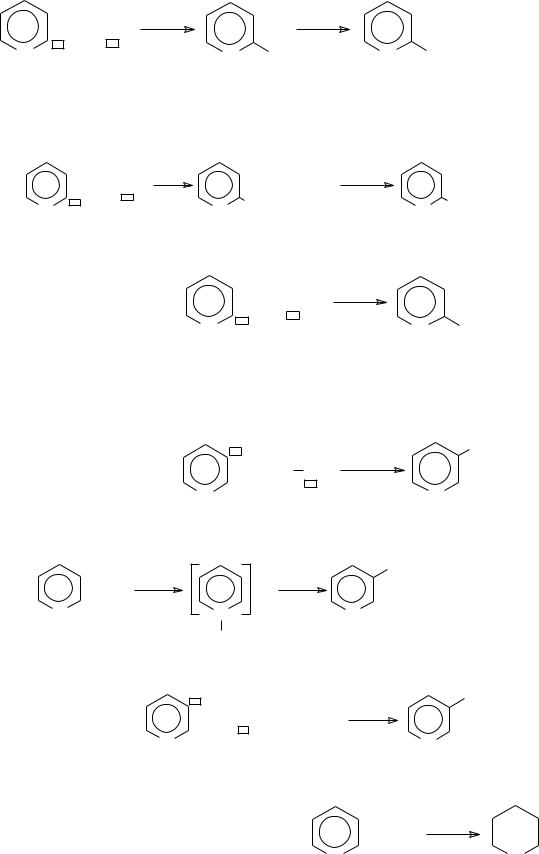
2. Электрофильные свойства α-углеродного атома кольца С +− реакции с нуклеофилами:
а) кислородными:
– гидроксилирование
193
|
+ KOH |
|
|
H2O |
|
+ KOH |
|
|
− H2 |
|
|
|
|||
N |
.. |
N |
OK |
N OH |
|
||
|
|
|
|||||
|
|
|
б) азотными: |
|
|
|
|
|
− аминирование (реакция Чичибабина) |
|
|
||||
|
+ NaNH |
− 2 H |
|
+ H O |
|
+ |
NaOH |
|
.. 2 |
|
2 |
|
|
||
|
N |
|
N |
NHNa |
N |
NH2 |
|
|
в) углеродными: |
|
|
2 -аминопиридин |
|
||
|
|
|
|
|
|
||
|
|
|
− алкилирование |
|
|
|
|
|
|
|
|
+ LiC4H9 |
|
|
+ LiH |
|
|
|
N |
.. |
|
|
|
|
|
|
|
N |
C4H9 |
||
3. Нуклеофильные свойства -углеродного атома кольца С− − реакции с электрофилами:
а) азотными: − нитрование
|
|
.. |
|
NO2 |
|
|
|
Fe, H2SO4 |
|
|
|
|
|
+ HO NO2 |
KNO3 |
+ |
H2O |
|
|
N |
|
|
|
|
|
N |
|
|
|
|
б) галогенными (хлорирование) |
|
|
||
|
|
+ |
Cl |
|
|
+ Cl2 |
низкая t |
Cl− нагрев. |
+ HCl |
|
|
N |
|
N |
N |
|
|
в) серными: |
Cl |
|
|
|
|
|
|
|
|
||
|
|
− сульфирование |
|
|
|
|
|
.. |
|
SO3H |
|
|
|
+ H2SO4(дымящая) |
|
+ H O |
|
|
|
|
|
|
2 |
|
N |
|
N |
|
|
4. Электрофильные свойства углеродных атомов кольца – реакции с нуклеофилами:
– водородными (гидрирование)
+ 3H2 Ni
N |
N |
||
Пятичленные гетероциклы. Наиболее |
|
|
|
H |
|||
|
|||
распространенными ненасыщенными пятичленными гетероцик- |
пиперидин |
||
194 |
|
|
|
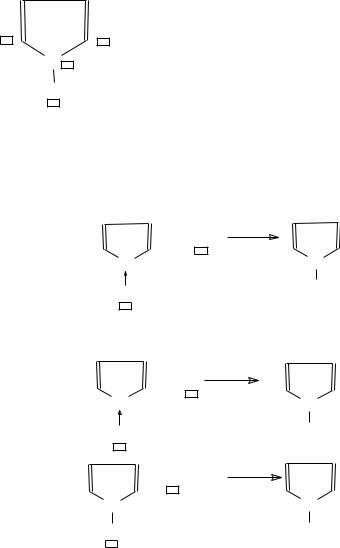
лическими соединениями с одним гетероатомом являются пиррол, фуран, тиофен и др. Ароматический характер этих соединений обусловлен тем, что неподеленная пара электронов гетероатома используется для заполнения ароматического секстета при сочетании с четырьмя электронами двойных связей, то есть имеет место сопряжение шести электронов подобно шести -электронам в молекуле бензола.
Пиррол
В молекуле пиррола можно выделить 2 электрофильных и 2 нуклеофильных центра
+ |
|
|
− |
|
э.ц. |
− |
.. |
||
н.ц. |
||||
N .. |
||||
|
||||
|
|
|||
|
+ |
н.ц. |
|
|
|
H |
|
||
э.ц.
1. Электрофильные свойства водорода NHгруппы – реакции с нуклеофилами:
а) кислородными:
– нейтрализация |
|
|
|
|
|
|
|
|
+ KOH |
|
+ H O |
|
|
|
.. |
|
2 |
|
|
N |
|
|
N |
|
|
H |
|
|
K |
|
|
|
|
|
|
|
б) металлическими: |
|
|
||
– металлирование |
2 |
|
+ 2K |
2 |
+ H2 |
|
|
||||
|
|
N |
. |
|
N |
|
|
|
|
||
|
|
H |
|
|
K |
|
|
|
RMgBr |
|
+ RH |
|
|
|
+ .. |
|
|
|
|
N |
|
|
N |
|
|
H |
|
|
MgBr |
2. Нуклеофильные свойства азота N− − реакции с электрофилами
(электронная пара азота вступает в сопряжение и проявляет при этом слабые основные свойства):
а) водородными (пиррол бурно реагирует с кислотами Бренстеда, и происходит раскрытие цикла. Так, например, при нагревании в спиртовом
растворе гидроксиламина с пирролом образуются диоксимы 1,4- дикетонов):
195

R |
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
+ 2NH2OH |
H+ |
|
|
|
|
|
|
|
R + NH3 |
|||||||
|
|
|
|
R |
|
C |
|
(CHR)2 |
|
C |
|
|||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
R |
N |
R |
|
|
NOH |
NOH |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
б) углеродными: |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
− ацилирование |
|
|
|
|
|
||||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ H3C |
|
C |
|
|
|
|
|
|
|
|
|
+ KCl |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
N .. |
|
|
Cl |
|
N |
|
COCH3 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
K |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|||||
3. Нуклеофильные свойства атомов углерода кольца – реакции с электрофилами:
а) азотными:
− диазотирование
|
+ [C6H5N2]+ Cl− |
|
|
|
|
+ HCl |
N .. |
N |
N |
|
NC6H5 |
||
|
||||||
|
||||||
|
|
|
|
|
|
|
H |
H |
|
|
|
||
б) галогенными: |
I |
|
I |
|
|
|
|
||
|
+ 4 I2 |
4 NaOH |
|
+ 4 NaI + 4 H2O |
|
|
KI |
|
|
N |
I |
N I |
||
|
|
|
|
|
H |
|
H |
||
в) металлическими: − меркурирование
|
|
HgCl2 |
||
|
.. |
+ HgCl2 |
|
|
NH |
NH HgCl |
ClHg NH HgCl |
||
|
||||
г) серными:
− сульфирование
|
|
+ SO |
. C H N |
|
|
|
|
|
|
|
|
|
3 |
5 |
5 |
|
|
|
|
|
|
N |
|
|
|
N SO H . C H N |
||||||
|
|
|
|
3 |
5 |
5 |
||||
H |
H |
д) углерод- |
|
||
|
ными: |
|
|
196 |
|
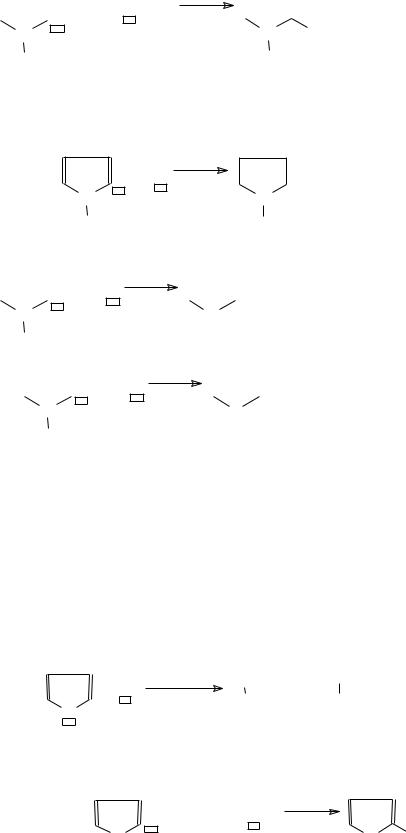
− ацилирование
|
|
|
+ (CH3CO)2O |
|
+ CH3COOH |
|
|
|
|
||
|
N |
|
.. |
N |
COCH3 |
|
|
|
|||
|
H |
|
|
H |
|
4. Электрофильные свойства атомов углерода кольца С + - реакции с нуклеофилами:
а) водородными (гидрирование):
|
+ 2H |
N |
. 2 |
N |
|
H |
H |
б) кислородными (реакция Юрьева):
|
|
|
|
|
|
|
|
|
|
|
|
|
+ H O |
|
|
|
|
|
+ NH |
||||
|
|
|
|
|
|
|
|
|
|
|
2 .. |
|
|
|
|
|
3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
N |
|
O |
||||||||||||||||||
в) |
|
|
H |
|
|
|
|
|
серными: |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ H S |
|
|
|
|
|
|
|
+ NH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
2 .. |
|
|
|
|
3 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
N |
|
|
|
S |
||||||||||||
H
Фуран
Фуран имеет два нуклеофильных и один электрофильный реакционный центр.
1. Нуклеофильные свойства кислорода О− - реакции с жесткими электрофилами (H2SO4 конц., AlCl3 и др.)
Фурановое кольцо расщепляется концентрированной серной кислотой и хлористым алюминием уже на холоду, а с другими минеральными кислотами −при нагревании. С метанолом, насыщенным HCl, он образует ацеталь янтарного альдегида:
|
+ H2O, CH3OH H2C |
|
CH2 |
|
|
|
|||
O |
+ H |
CH(OCH3)2 |
CH(OCH3)2 |
|
|
||||
|
|
|
|
|
.. |
|
|
|
|
2. Нуклеофильные свойства α-углеродного атома кольца – реакция с электрофилами:
а) азотными: |
|
+ CH3COONO2 |
пиридин |
+ CH3COOH |
|
|
|||
− нитрование |
|
|
||
O |
.. |
|
O NO2 |
|
|
|
|
197
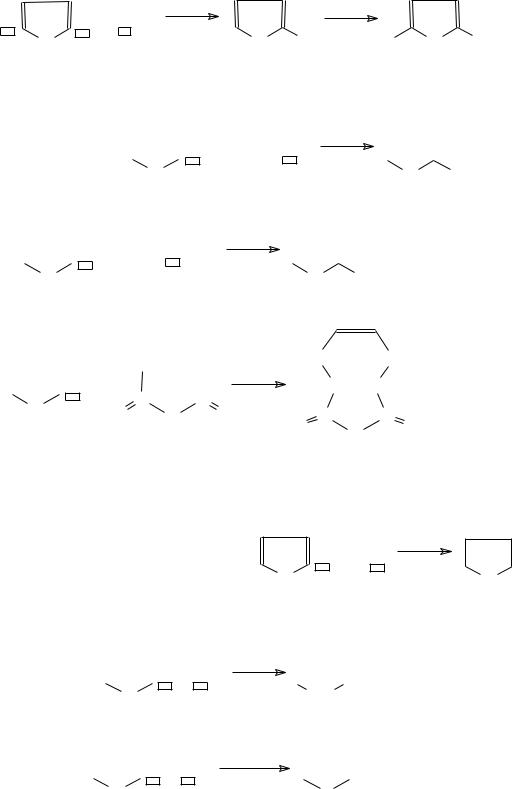
б) металлическими: − меркурирование
|
|
|
+ HgCl2 |
− HCl |
HgCl2 |
|
+ HCl |
.. |
|
.. |
|
|
|||
O |
|
HgCl ClHg |
O |
HgCl |
|||
|
|
|
O |
в) серными:
− сульфирование
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ C H N . SO |
3 |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
.. |
|
|
5 |
5 |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
O SO H |
. C H N |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
5 |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
г) углеродными: |
|
|
|
|
|||||||||
− ацилирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
.. |
+ |
(CH3CO)2O |
|
ZnCl2 |
|
|
|
|
|
|
|
+ CH3COOH |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
COCH3 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
– реакция Дильса-Альдера |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
+ |
HC |
|
|
CH |
|
|
H2C |
|
|
|
|
CH2 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.. |
|
|
|
|
|
|
|
|
|
|
|
|
HC CH |
|
|
|
|
|||||||
|
|
O |
|
O |
|
C |
|
C |
O |
|
O C |
|
|
|
C |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
O |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|||
3. Электрофильные свойства углерода кольца С + - реакции с нуклеофилами:
а) водородными: − гидрирование
|
+ 2 H |
Ni |
|
|
|
O |
..2 |
O |
|
б) азотными:
− реакция Юрьева (t = 400 4500C, катализатор Al2O3)
|
|
|
|
|
+ NH |
|
|
|
|
|
|
|
|
|
|
|
|
+ H O |
|
|
O |
|
.. |
3 |
|
|
|
|
NH |
|
|
|
2 |
||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
в) серными: |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
+ H S |
400 |
−: 500 |
0 C |
|
|
|
|
|
|
|
|
|
+ H O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
.. 2 |
|
|
|
|
|
|
|
|
|
|
2 |
||||
|
O |
|
|
|
|
|
S |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
198

Тиофен
Молекула тиофена содержит 3 реакционных центра: 2 нуклеофильных и 1 электрофильный.
1. Нуклеофильные свойства атома серы S− −реакции с электрофи-
лами. Тиофен в отличие от фурана и пиррола не дает с обычными кислотами Бренстеда тиониевых солей. Тиониевые соли могут быть получены из тиофена только при действии таких реактивов, как, например, (CH3)3O+ ·
BF4−
2. Нуклеофильные свойства α-углеродного атома кольца C− - реакции с электрофилами:
а) азотными:
– нитрование
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.. |
+ HNO3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ H2O |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
б) галогенными: |
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
NO2 |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
– галогенирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ Cl2 |
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.. |
|
+ Cl2 -H Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-H Cl |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
S |
Cl |
|
Cl |
S |
Cl |
|||||||||||||||||
в) металлическими: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
− меркурирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hg Cl2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
.. |
|
+ HgCl2 |
|
|
−HCl |
|
|
|
|
|
|
|
−HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
HgCl |
|
|
ClHg |
S |
HgCl |
||||||||||||||||||||
г) серными: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
− сульфирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
+ H SO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
H2O |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
.. |
|
2 4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
SO3H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
д) углеродными: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
− ацилирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
CH3COCl |
AlCl3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ HCl |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
.. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
C |
|
|
|
CH3 |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|||
3. Электрофильные свойства α-углеродного атома кольца C + - реакции с нуклеофилами:
а) кислородными (реакция Юрьева):
|
|
+ H O |
Al2O3, 400 −: |
4500 C |
|
|
|
+ H2S |
|
|
|
|
|||||
|
|
|
|
|
|
|
||
|
|
2 .. |
|
|
|
|
|
|
|
S |
199 |
|
|
|
O |
||
|
|
|
|
|
||||
б) азотными (реакция Юрьева):
|
|
|
+ NH |
Al2O3, 400 −: |
4500 C |
|
|
|
+ H S |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|||
|
|
|
.. |
3 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
N |
||
|
S |
|
|
|
|
|
||||
H
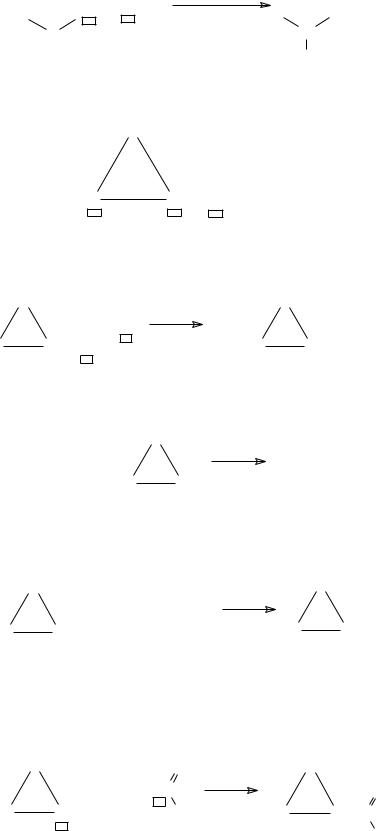
Четырех- и трехчленные циклы
Четырех- и трехчленные циклы характеризуются наличием 3 реак-
ционных центров: |
|
|
(CH2)n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
+ |
|
|
− |
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
H C |
|
|
N |
|
|
H , где n = 1, 2 |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
2 |
|
|
.. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
э.ц. |
|
|
н.ц. э.ц. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
1. Электрофильные свойства водорода при азоте – реакции с нук- |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
леофилами: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
(CH2) n |
|
|
|
|
|
|
|
|
(CH2) n |
|
|
|
|
|
|
|
|
|
|
|
||||||||
2 |
|
|
|
+ |
2 K |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
+ H2 |
|
|
|||||||
H2C |
N |
|
|
H |
. |
|
|
|
|
|
H2C |
|
N |
|
|
K |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
2. Нуклеофильные свойства азота N− - реакции с электрофилами: |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
а) водородными: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
− полимеризация |
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
n |
|
H+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
] n |
||||
|
|
|
|
|
|
|
|
|
[ |
|
|
CH2 |
|
|
|
CH2 |
|
|
|
NH |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
H2C |
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
б) азотными: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
− нитрозирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
(CH ) |
|
|
|
|
|
|
|
|
|
|
(CH2) |
n |
|
|
||||||||||||||
|
2 n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
+ Cl |
|
N |
|
O |
|
|
|
|
|
+ |
HCl |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
H C |
N |
|
|
H |
|
|
|
|
|
|
H2C |
N |
|
N |
|
O |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в) углеродными: − ацилирование
|
(CH2) n |
O |
|
(CH2) n |
|||
H2C |
+ CH3 |
|
C |
|
|
|
O + HCl |
|
|
||||||
NH |
Cl |
H2C |
N |
|
C |
||
|
|||||||
|
.. |
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
200 |
|
|
|
|
