
738
.pdf
Как и в изобарном процессе, крутизна изохоры в Ts-координатах определяется угловым коэффициентом
tg γ = T/cv .
Из последнего выражения следует, что крутизна изохоры растет с увеличением температуры и уменьшением теплоемкости. Сравнение угловых коэффициентов изохоры и изобары показывает, что при одной и той же температуре изохора проходит круче, так как cp>cv.
p2 p |
o 2 |
|
lр |
|
|
+q |
|
|
|
|
|
lтех |
|
q |
|
p1 |
o 1 |
u |
|
-q
P2* |
o 2* |
v1 = v2 |
v |
T |
|
|
|
T2 |
2 o |
2* o |
o |
|
|
|
2** |
|
1 |
1* |
1** |
T1 |
o |
o |
o |
**
|
|
|
|
|
a |
c |
b e d |
f s |
|
Рис. 2.10 |
Рис. 2.11 |
Изохоры, так же как и изобары, эквидистанты (рис.2.11). Как и в изобарном процессе, можно показать, что ac = bd.
Для вычисления изменения внутренней энергии, энтальпии и энтропии в процессе от начального до конечного состояний используются уравнения:
∆u = cv(Т2 – Т1), ∆i = cp(Т2 –Т1) и s cv ln T2 .
T1
Работа расширения в изохорном процессе равна нулю. Техническая работа определится по формуле:
lтех= - 12 vdp v( p2 p1 ) .
Так как lрасш = 0, то из первого закона термодинамики следует, что все подведенное тепло расходуется на изменение внутренней энергии:
q = u2 – u1= cv (T2 – T1).
Значения α и ξ для изохорного процесса будут равны:
α= qu 1 и ξ =1 – α = 0.
2.3.5.Изотермический процесс
51

|
Процесс, протекающий |
при постоянной |
температуре, называется |
|
и з о т е р м и ч е с к и м. |
|
|
Уравнение процесса записывается в виде |
Т = const или |
||
|
|
pv = const. |
(2.59) |
Следовательно, показатель процесса n = 1, а теплоемкость сT = ± . Отсюда же: отношение удельных объемов обратно пропорционально
отношению давлений, т.е.
v2 p1 . v1 p2
График процесса, построенный по уравнению (2.59), называют и з о-
те р м о й. В pv– координатах (рис.2.12) изотерма – равнобочная гипербола.
Вкоординатах Ts изотерма – прямая линия параллельная оси абсцисс,
рис.2.13..
p |
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
o |
1 |
lрас |
|
|
|
|
|
p1 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
q |
|
|
Сжатие |
Расширение |
|
|
|
|
u |
=T2 |
|
|
2 |
|
|
|
|
|
o |
o |
|
||
|
|
|
|
o |
|
|||
|
|
|
|
|
2* |
1 |
|
|
|
lтех |
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
p2 |
|
|
|
2 |
|
|
|
|
|
|
|
o |
|
-q |
+q |
|
|
|
|
|
|
|
|
|||
|
|
|
lрасш |
|
|
|
|
|
|
v1 |
|
v2 |
v |
s*2 |
s1 |
s2 |
s |
|
|
|
||||||
|
|
|
Рис. 2.12 |
|
|
Рис. 2.13 |
|
|
Изменения внутренней энергии и энтальпии в процессе равны нулю,
т.е. du = cvdT = 0 и di =cpdT = 0.
Изменения энтропии в изотермическом процессе можно выразить через удельный объем и через давление:.
ds = dqT R dvv R dpp .
Интегрируя данное выражение от первого состояния до второго, получим :
∆ѕ=ѕ2 |
–ѕ1=R ln |
v2 |
R ln |
p1 |
. |
. |
v |
|
|||||
|
|
|
p |
|
||
|
1 |
|
2 |
|
|
|
Для изотермического процесса работа расширения равна технической работе:
|
lрасш = 2 |
pdv 2 p1v1 |
|
1 |
1 |
и |
lтех = - 2 vdp 2 p1v1 |
|
|
1 |
1 |
|
dv |
p1 v1 |
|
v2 |
|
|
p |
||||
|
|
ln |
|
|
= RT1ln |
1 |
|
|
|||
|
v |
v1 |
|||||||||
|
p2 |
||||||||||
|
|
|
|
|
|||||||
dp p v ln |
|
p2 |
RT ln |
v2 |
. |
||||||
|
|
|
|||||||||
|
p |
1 |
1 |
|
|
1 |
|
v1 |
|||
|
|
|
|
|
p 1 |
|
|||||
52

Теплота, участвующая в процессе |
|
|
|
|
|
q = T (s2 – s1) =RT ln |
p1 |
= RT ln |
v2 |
. |
|
|
|||||
p |
|
|
|||
|
2 |
|
v |
||
|
|
1 |
|
||
В данном процессе все тепло, подведенное к газу, идет на совершение работы расширения:
Коэффициент α для изотермического процесса равен нулю, значение ξ - единице, т.е.
α = |
u |
0 и ξ = 1 – α = 1. |
|
q |
|||
|
|
2.3.6. Адиабатный процесс
А д и а б а т н ы м называют процесс изменения состояния системы, происходящий без теплообмена с окружающей средой.
В адиабатном процессе dq = 0, следовательно, теплоемкость сq = 0. Для вывода уравнения адиабаты используем выражения первого закона
термодинамики (1.17) и (1.18) при dq = 0:
cp dT –v dp = 0 и cv dT + p dv = 0
Разделим первое уравнение на второе:
cp dT vdp , cv dT pdv
сократив на dT, разделив переменные и обозначив cp/cv =к, будем иметь:
|
|
dv |
|
dp |
|
||||
|
к |
|
|
|
|
. |
|
||
|
|
v |
p |
|
|||||
Проинтегрировав полученное уравнение от начального до конечного |
|||||||||
состояния процесса, получим: |
|
|
|
|
|
|
|
|
|
|
v |
|
p |
|
|||||
к ln |
2 |
ln |
1 |
|
|
||||
v |
p |
|
|||||||
|
1 |
|
2 |
|
|
|
|||
или |
|
|
|
|
|
|
|
|
|
|
p1 v1к = p2 v2к. |
|
|||||||
На основании этого запишем уравнение адиабаты: |
|
||||||||
|
p vк = const. |
(2.60) |
|||||||
При адиабатном процессе произведение давления на удельный объем в степени к есть величина постоянная. Кривую, построенную по уравнению (2.60), называют а д и а б а т о й, а величину к, являющуюся отношением теплоемкостей cp и cv – п о к а з а т е л е м а д и а б а т ы.
Уравнение адиабатного процесса аналогично политропному, разница лишь в том, что здесь вместо показателя политропы п имеем показатель адиабаты к. Поэтому все последующие соотношения для адиабатного процесса получим из политропных, заменив п на к.
Так, связь между параметрами в адиабатном процессе имеет вид:
53
|
|
|
|
v1 |
к |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
||||||||||
|
p2 |
|
|
|
|
v |
|
|
|
|
p |
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
к |
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
или |
|
|
|
|
2 |
|
|
1 |
|
|
; |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
p1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
v2 |
|
|
|
|
v1 |
|
p2 |
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
к 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
к |
|
|
|||||
|
T |
|
p |
к |
|
|
|
p |
|
|
|
|
T |
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
к 1 |
|
|
||||||||||||||||||||||
|
2 |
|
|
2 |
|
или |
|
|
|
2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
; |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
T1 |
|
|
p1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
p1 |
|
|
|
T |
1 |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
к 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
v2 |
|
|
|
|
к 1 |
|||||||||||||||||||||
|
|
T2 |
|
v1 |
|
|
|
|
или |
|
|
T1 |
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
T1 |
|
|
|
|
|
|
|
|
v1 |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
v2 |
|
|
|
|
|
T2 |
|
|
|
|||||||||||||||||||||
Адиабата в pv-координатах представляет собой неравнобочную гиперболу, рис.2.14. Она круче изотермы, так как к >1. В Ts-координатах адиабата изображается вертикальной прямой, рис. 2.15, потому что при q = 0 изменения энтропии нет, т.е. ∆s = 0. В этом случае адиабатный процесс можно называть и з о э н р о п н ы м процессом
p |
|
|
|
T |
o |
1 |
|
|
T2* |
|
|
|
||
p1 |
|
|
|
|
|
|
lрасш |
|
|
|
|
|
|
T1 |
lтех |
|
|
|
|
p2 |
|
|
2 |
T2 |
|
o |
|
||
|
|
|
||
|
|
lрасш |
|
|
v1 |
|
v2 v |
|
|
Рис. 2.14
|
o 2* |
Сжатие |
lрасш |
|
o 1
Расширение |
q |
|
u |
||
|
o 2
S1=s2 |
s |
Рис. 2.15
Изменение энтальпии и |
внутренней энергии определяются по уравне- |
|||||||||||||||||||||
ниям: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆i =cp (T2 –T1) |
и |
∆u = cv (T2 – T1) . |
|
|
|
|
|
|
|
|||||||||
Заменив в уравнении (2.52) и (2.53) |
п на к, получим работу расшире- |
|||||||||||||||||||||
ния и техническую работу: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
к 1 |
|
|
|
|
|
|
|
к |
1 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
1 |
|
|
p2 |
к |
|
|
|
|
|
к |
|
|
p2 |
к |
|
|
|
||||
lрасш = |
|
|
RT 1 |
|
|
|
|
|
|
и |
lтех = |
|
|
|
|
|
|
|
|
.. |
||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
к 1 |
1 |
|
p1 |
|
|
|
к 1 |
RT1 1 |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
p1 |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Отсюда следует, что в адиабатном процессе техническая работа в к раз больше величины работы расширения.
Поскольку теплота в адиабатном процессе равна нулю, то работа расширения совершается только за счет изменения внутренней энергии рабочего тела.
54

2.3.7.Характерные группы политропных процессов
Взависимости от энергообмена системы с окружающей средой политропные процессы расширения можно разбить на три характерные группы:
I группа – с показателем процесса п от -∞ до 1;
II группа – с показателем процесса п от 1 до к; III группа – с показателем процесса п от к до +∞.
Распределение процессов по группам в pv и Ts – координатах показано на рис.2.16.(а) и рис.2.16 (б), соответственно. Процессы, лежащие выше изотермы, протекают с увеличением внутренней энергии, ниже – с ее уменьшением. К процессам, расположенным над адиабатой, теплота подводится, под адиабатой – отводится. Процессы расширения лежат справа от изохоры, сжатия – слева.
Для первой группы характерным является то, что все процессы расширения идут с подводом тепла и увеличением внутренней энергии. Связь между теплотой, работой и внутренней энергией можно представить схематически, рис.2.17. В первой группе процессов (а) вся теплота идет на совершение работы расширения и увеличение внутренней энергии.
P
kv n n=1
n=0
q
v
1
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
n= - |
|
|
|
k |
v |
n |
v |
1 |
n=k |
n=0 |
|
|
|
|
n=k |
|
|
|
|
|
|
х |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
х n= - |
|
|
|
|
||
х |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
х |
|
|
|
|
|
х |
|
I группа |
|
|
|
|
Сжатие |
I группа |
|
||||||
|
|
|
|
|
|
|
|
0 |
|
х |
|
|
|
|
|
х Т |
|
|
|
|
|
|
v |
|
|
|
|
|
|
||
|
|
|
|
|
V |
|
|
|
|
|
|
|
|||
|
v0 |
|
|
n=0 |
n=1 |
|
|
х |
|
n=1 |
|
|
|||
|
|
|
|
V |
|
|
|
|
|
||||||
Т |
|
|
|
|
|
|
|
|
|
х |
0 |
|
|
|
|
|
|
|
|
n=0 |
|
|
|
|
v |
|
|
|
|
||
v |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
х |
|
|
|
|
|
|
|
|
х |
V |
|
|
|
|
|
х |
|
|
n=1 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
V |
|
|
|
|
|||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
х |
|
II группа |
|
|
|
|
Расш-ие |
k |
v |
n |
v |
1 |
||
|
|
|
|
k v n v1 |
|
|
|
|
|
х |
|||||
|
|
х |
|
n=+ |
|
|
|
|
|
|
|
||||
|
|
|
х |
n=k |
|
|
|
|
х |
|
|
|
|
|
|
|
|
|
III группа |
II группа |
|
|
|
|
|||||||
|
|
|
|
х |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
III группа |
|
|
|
|
|
х |
|
|
|
|
|
||
n=+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
S |
|
а) |
|
|
|
|
|
|
|
|
б) |
|
|
|
|
|
|
|
|
|
|
Рис.2.16 |
|
|
|
|
|
|
|
|
|
|
|
VU |
|
|
VU |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VU |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
q |
|
|
|
|
|
q |
|
|
|
|
|
|
а) |
|
|
|
б) |
|
|
|
|
|
|
|
|
в) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
55 |
Рис. 2.17
Во второй группе (б) теплота тоже подводится, но внутренняя энергия уменьшается. В этом случае работа расширения совершается за счет подведенного тепла и уменьшения внутренней энергии.
Третью группу (в) отличает то, что все процессы расширения идут с отводом теплоты и уменьшением внутренней энергии. Работа процессов этой группы производится только за счет уменьшения внутренней энергии. Кроме того, внутренняя энергия дополнительно еще уменьшается вследствие отвода теплоты от системы.
2.3.8. Диаграммы состояния
Изображение процессов в координатах, по осям которых выбраны те или иные параметры. позволяет построить для рабочих тел характерные диаграммы состояния, широко использующиеся при исследовании термодинамических процессов и циклов. Рассмотрим некоторые из них.
Диаграмма состояния в pv – координатах представляет собой сетку из изобар и изохор, на которую наложены изотермы. По этой диаграмме можно быстро определить в любом состоянии термодинамические параметры рабочего тела, для которого она построена. Однако pv-диаграмма дает недостаточно полную информацию о рабочем теле и процессах изменения его состояния.
Диаграмма состояния в Ts – координатах позволяет непосредственно определить большее число параметров, так как на поле графика, состоящего из сетки изотерм и изоэнтроп, наносятся уже два вида изопараметрических процессов: изохоры и изобары. По этой диаграмме для любого состояния можно определить T, p, v, s, а также cp и cv.
Некоторым недостатком рассмотренных диаграмм является то, что при определении количества работы (в pv – диаграмме) и количества теплоты (в Ts – диаграмме) приходится измерять соответствующие площади.
В технических расчетах чаще используется диаграмма, построенная в is-координатах. Достоинством такой диаграммы является то, что на ней работа и теплота процессов изображаются отрезками линий. При построении диаграммы по оси ординат откладывается энтальпия, а по оси абсцисс – энтропия. На рис. 2.18 представлена is – диаграмма водяного пара. На поле графика из изоэнтальп и изоэнтроп наносятся изобары, изохоры и изотермы. Имея is – диаграмму, по двум известным параметрам можно просто найти
остальные параметры состояния рабочего тела. Так, например, |
по p и T |
непосредственно определяются i , s, v, cp, cv и вычисляются |
R, к, u. В |
адиабатном процессе расширения от состояния 1 до состояния 2 |
отрезок оси |
ординат i i1 - i2 представляет работу техническую, а в изотермном процессе s = s2 – s1 – эквивалентна теплоте, подведенной в процессе расширения.
56
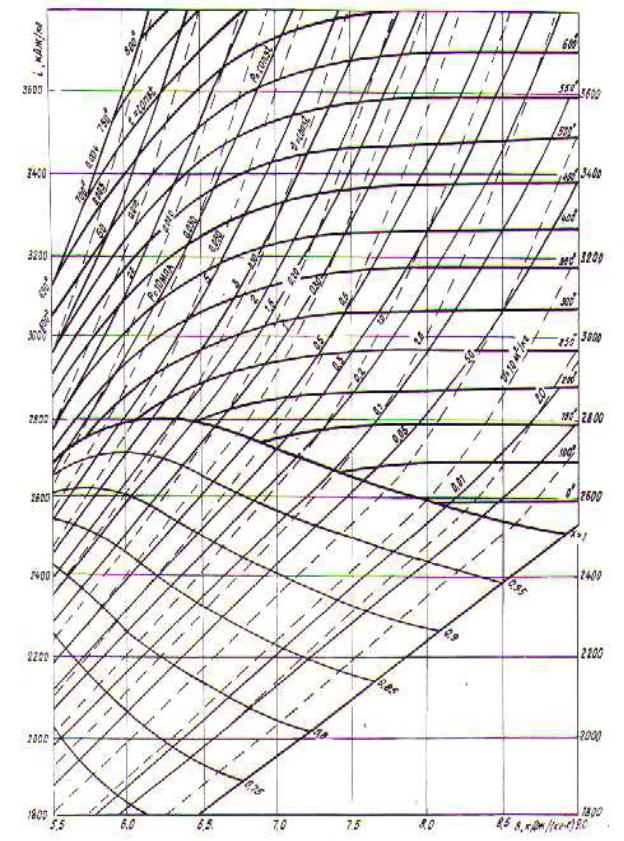
В холодильной технике, как правило, используются диаграммы состояния хладагентов в координатах ln p – i. Для фреона R–22 диаграмма состояния представлена в Приложении табл. 16.
Рис. 2.18
57

Глава 3 ПАР И ВЛАЖНЫЙ ВОЗДУХ
3.1. Парообразование жидкостей
3.1.1. Особенности фазовых переходов Во многих технических системах нашли широкое распространение ра-
бочие тела в виде пара различных веществ: воды, аммиака, углекислоты, фреона. Кроме того, часто используются как газообразные, так и сжиженные кислород, азот и др. газы. Как получение пара из жидкости, так и получение жидкого вещества из газа осуществляется в результате фазовых переходов. Известны четыре агрегатных состояний вещества: твердая, жидкая, газообразная фазы и плазма. Каждая фаза представляет собой однородную систему с одинаковыми физическими свойствами во всех ее частях. Характерной особенностью агрегатного состояния вещетва является наличие гранниц, отделяющих данную фазу от соприкасающихся с нею других фаз. При определенных условиях вещество может переходить из одной фазы в другую.
|
Процесс перехода вещества из твердой фазы в жидкую носит |
|
|
название п л а в л е н и я. |
Обратный переход именуют к р и с т а л- |
|
л и з а ц и е й. |
|
В некоторых условиях |
твердое вещество может переходить сразу |
|
в газообразную фазу, минуя жидкое состояние.
Процесс перехода твердой фазы в газообразную называют с у б л и - м а ц и е й, а обратный процесс – д е с у б л и м а ц и е й.
Процесс перехода вещества из жидкого состояния в газообразное именуют п а р о о б р а з о в а н и е м, из газообразного в жидкое – к о н д е н с а ц и е й.
Различают фазовые переходы 1-го и 2-го родов.
К фазовым переходам 1-го рода относят превращения, сопровождающиеся поглощением или выделением теплоты r и скачкообразным изменением удельного объема v , т.е. dq 0 ; r 0 и dv 0 . К фазовым переходам 2-го рода относят превращения при dq=0 и dv=0. В этом случае происходит скачкообразное изменение теплоемкости.
В теплоэнергетических установках чаще используются вещества, которым присущи фазовые переходы 1-го рода.
Граница между двумя фазами при любых фазовых переходах представляет собой поверхность равновесия фаз, на которой градиенты давлений и температур равны нулю. Пересечение поверхности равновесия плоскостью, соответствующей фиксированному значению одного из параметров состояния, дает кривую равновесия, изображенную в координатах других парамет-
58
ров. Так, например, кривые равновесия воды можно представить в координатах pT в виде уравнения:
|
|
dp |
|
r T |
|
, |
(3.1) |
|
|
dT |
T v v |
||||
|
|
|
|
|
|||
где v |
и v – удельные объемы вещества в начале и конце фазового перехо- |
||||||
да соответственно; |
|
|
|
|
|
||
r- теплота фазового перехода.
Начало координат задается таким, что на поле pT - диаграммы можно разместить состояния твердой, жидкой и газообразной фаз какого-либо вещества.
Равновесное состояние этого вещества, а также равновесные состояния фазовых переходов изображаются точками.
Точка, в которой находятся в равновесном состоянии три фазы однородного вещества, называется т р о й н о й т о ч к о й.
Тройная точка является началом кривых функций p=f(T) для фазовых переходов: твердое вещество – жидкость, жидкость – пар, твердое вещество - пар. Характер этих кривых определяется выражением (3.1).
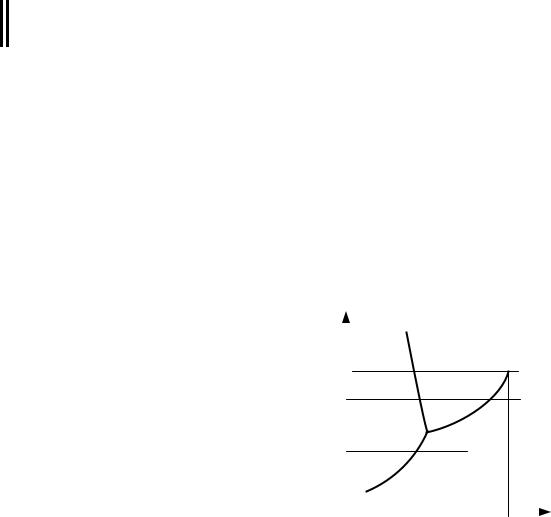
На рис.3.1 представлена качественная pT – диаграмма воды. Тройная точка воды A имеет давление p = 0,0061 бар (610 Па) и температуру t = 0,01о С. При переходе воды из жидкого состояния в газообразное удельный объем ее возрастает ( v > v ), а теплота фазового перехода имеет положительное значение ( r > 0); тогда из уравнения (3.1) следует, что с увеличением давления температура фазового перехода будет расти (кривая AC) Не-
равенство |
v > v, справедливо и при сублимации льда в пар, поэтому с |
||||||||||
уменьшением |
давления температура |
|
|
|
|
|
|
|
|
|
|
сублимации падает (кривая AD). При |
p |
|
|
|
|
|
|
|
|
||
переходе из твердого состояния в жид- |
|
B |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
||||
кое для большинства веществ v > v , |
|
|
|
|
Жидкая |
|
|
||||
|
|
|
|
|
|
|
|||||
pкр |
|
Твердая |
фаза о Kp |
||||||||
следовательно, |
dp/dT>0. Это значит, |
|
|||||||||
|
|
фаза |
|
|
C |
|
|
||||
что давление плавления с увеличени- |
|
|
|
|
о |
|
|
|
|||
p1 |
|
1 |
b |
|
о |
2 |
|
||||
ем температуры растет. Однако удель- |
|
|
A |
|
c |
|
|||||
|
|
|
|
|
|
|
|
||||
ный объем воды при плавлении льда |
|
|
3 |
d |
о |
4 |
|
|
|||
имеет меньшее значение ( v < v ), и по- |
p3 |
|
D |
|
о |
|
|
|
|
||
|
|
Газообразная |
|
|
|||||||
этому dp/dT<0, т.е. с увеличением дав- |
|
|
|
|
|||||||
|
|
|
|
|
|||||||
|
|
|
|
фаза |
|
|
|||||
ления температура плавления уменьша- |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
Tкр T |
|||||
ется (линия |
AB ). Если вещество в |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||
твердом состоянии (на рис.3.1 точка 1) |
|
|
|
|
Рис. 3.1 |
|
|
||||
нагревать при постоянном давлении p1, то будем иметь следующие процессы:
1-b – нагрев до температуры плавления и переход в жидкую фазу; b-c – нагрев жидкости до температуры кипения и переход в пар;
59
c-2 – перегрев пара до температуры T2 .
Если взять состояние 3 с давлением p3 , то при нагреве твердого вещества получим процессы:
3-d – нагрев твердого вещества до температуры сублимации; d-4 – сублимация и перегрев пара до температуры T4 .
Кривая парообразования AC заканчивается критической точкой Kp . При температуре, равной критической, взаимные превращения пара и
жидкости происходят без поглощения или отвода тепла и без скачкообразного изменения плотности.
3.1.2. Пар и его характеристики
Под паром понимают газообразное состояние вещества в условиях, когда газовая фаза может находиться в равновесии с жидкой (твердой) фазой того же вещества.
Для получения пара используется процесс парообразования, хотя пар может быть получен и в процессе сублимации.
Парообразование является следствием испарения и кипения. Испарение происходит только со свободной поверхности жидкости.
Оно протекает при любой температуре и осуществляется за счет покидания жидкости молекулами, обладающими кинетической энергией, достаточной для преодоления поверхностного натяжения и перехода в пространство над жидкостью. Интенсивность испарения зависит от температуры жидкости и от ее природы.
Процесс кипения заключается в том, что при определенной температуре внутри жидкости образуются пузырьки пара. При испарении жидкости внутрь пузырька его размеры растут. Пузырьки, всплывая, выносят пар в окружающую жидкость среду. При интенсивном кипении суммарная поверхность пузырьков может существенно превосходить свободную поверхность жидкости. В этом случае парообразование будет идти в основном за счет кипения.
При парообразовании жидкости в закрытом пространстве одновременно протекает процесс конденсации. При определенных условиях наступит равновесие между жидкостью и паром. Это значит, что при отсутствии внешнего воздействия количественные соотношения между жидкой и газообразной фазами сохраняются неограниченное время.
Газообразную фазу, находящуюся в равновесии с жидкой фазой, называют сухим н а с ы щ е н н ы м п а р о м.
Из условий равновесия давление сухого насыщенного пара (обозначим его pн ) равно давлению фазового перехода: pн = ps.
Характерной особенностью процесса кипения является то, что при заданном давлении жидкость закипает при достижении вполне определенной температуры, и эта температура остается неизменной до полного выкипания
60
