
- •Лекция №12. -Аминокислоты. Пептиды. Белки
- •I. -Аминокислоты
- •1. Номенклатура аминокислот и их классификация и по строению радикалов
- •Химические свойства
- •3. Окислительное дезаминирование in vitro или реакция Ван-Слайка
- •5. Качественная реакция на --аминокислоты – образование окрашенного сине-фиолетового соединения с нингидрином
- •6. Биохимические реакции -аминокислот
- •II. Белки и пептиды Строение белков и полипептидов.
- •Свойства белков
II. Белки и пептиды Строение белков и полипептидов.
Пептиды, содержащие до 10 остатков АК, называют олигопептиды. От 10-50 – полипептиды, более 50 – белки.
1. Характеристика первичной структуры белковой или полипептидной молекулы.
Первичная структура это последовательность АК, связанных пептидной связью.
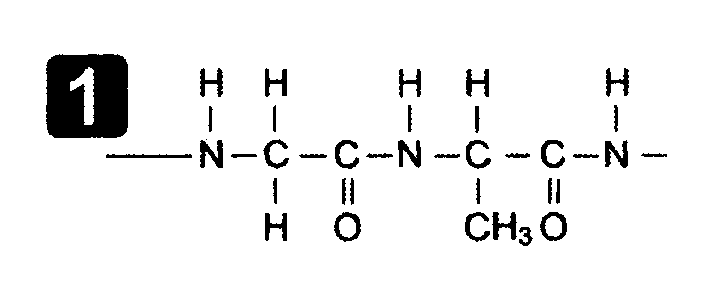
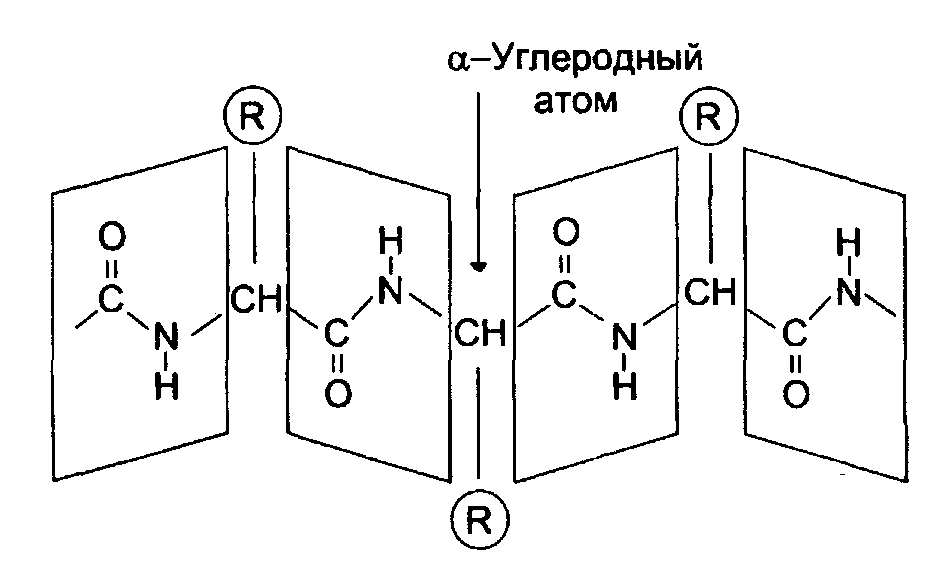
Вторичная структура белков
За счет внутримолекулярных взаимодействий белки образуют определенную пространственную структуру называемую «конформация белков». Вторичная структура определяется пространственным строением молекулы и представляет собой наиболее выгодную конформацию в виде правозакрученной - спирали или складчатую -структуру. Стабилизация вторичной структуры идет за счет водородных связей между пептидными группами.
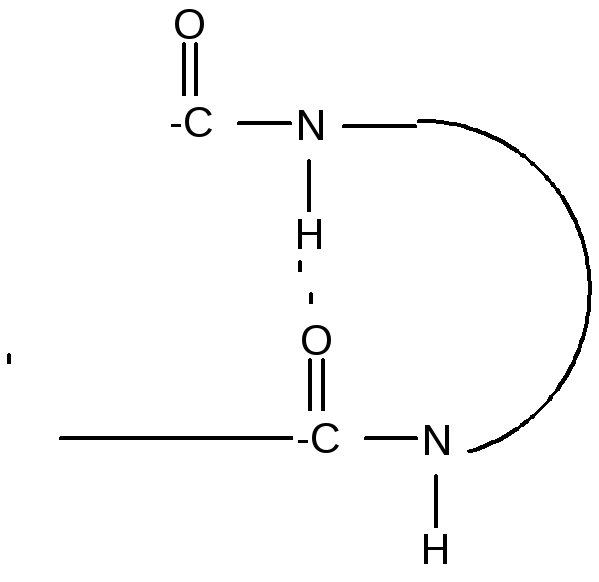
Третичная структура белков.
Третичная структура возникает за счет взаимодействия пептидных связей и боковых радикалов в водном растворе. Молекула белка укладывается в пространстве в виде «глобулы» или «клубка» за счет гидрофобного взаимодействия неполярных или гидрофобных радикалов внутри глобулы, ионных связей между заряженными радикалами, дисульфидных ковалентных мостиков, образованных при окислении цистеина В ЦИСТИН, водородных связей между полярными радикалами и водой.
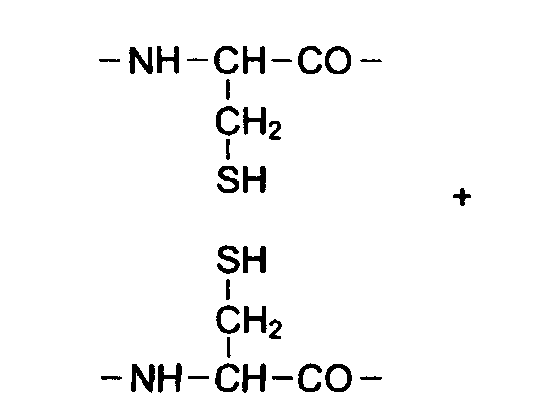
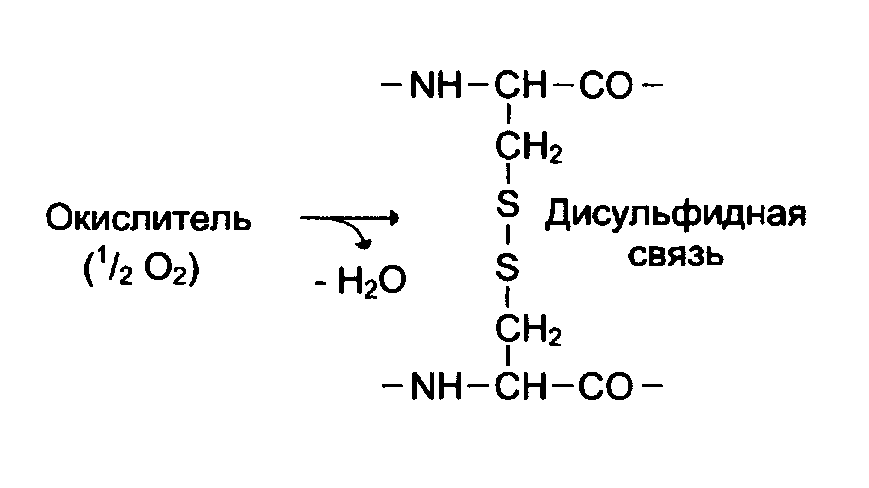
.
Свойства белков
Гидролиз в кислой и щелочной среде до АК.
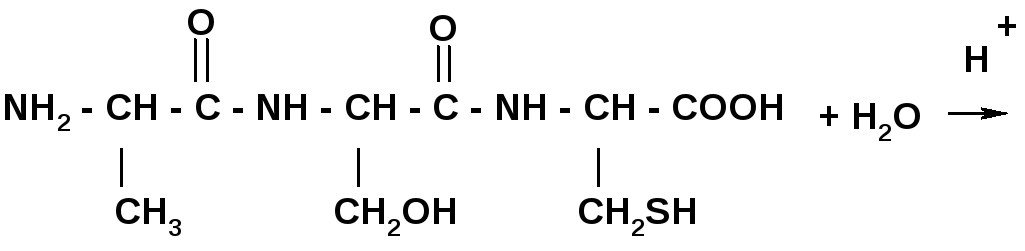
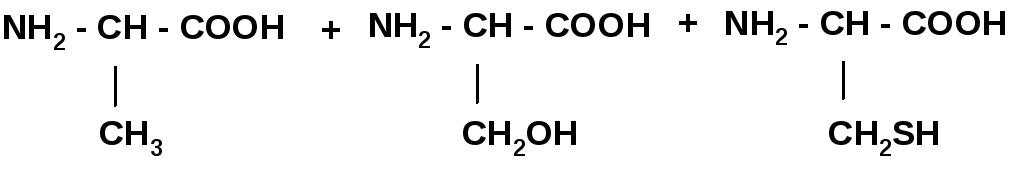
Качественные реакции
А. на пептидную связь
биуретовая реакция (фиолетовый хелатный комплекс с Си(ОН)2)

ОБРАЗОВАНИЕ БИУРЕТА
Б. на ароматические структуры
ксантопротеиновая реакция – взаимодействие с азотной кислотой с образованием нитробензольных производных желтого цвета.
