
- •Содержание курса лекций «Теоретические и экспериментальные методы исследования в химии. (Электрохимические
- •План лекции.
- •В соответствии с рекомендациями ИЮПАК все электрохимические методы анализа подразделяются на две большие
- •В электрохимических методах анализа -
- •ВОЛЬТАМПЕРОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
- •Уравнением полярографической волны:
- •КОЛИЧЕСТВЕННЫЙ ПОЛЯРОГРАФИЧЕСКИЙ АНАЛИЗ
- •МЕТОДЫ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ
- •2. В методе стандартных растворов в строго одинаковых условиях снимают полярограммы стандартного и
- •4. Дифференциальная полярография
- •АНАЛИЗ СМЕСИ ВЕЩЕСТВ
- •Условия проведения полярографического анализа:
- •Рис. Максимум I рода на фоне 0,05 М раствора KCI (1), исчезает после
- •АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- •1.Титрование с фиксацией диффузионного тока для определяемого вещества
- •2. Титрование с фиксацией диффузионного тока для титранта
- •3. Титрование с фиксацией диффузионного тока для определяемого вещества и титранта .
- •4. Титрование с фиксацией диффузионного тока, обусловленного продуктом реакции титрования.
- •В методах амперометрического титрования используют различные реакции:
- •Общая характеристика метода:
- •МЕТОД ИНВЕРСИОННОЙ ВОЛЬТАМПЕРОМЕТРИИ
- •Рис. Схема электрохимической ячейки для инверсионной вольтамперометрии.
- •ПРОЦЕССЫ:
- •Таблица. Значения потенциалов анодных пиков некоторых ионов металлов на фоне 0,1 М НСl
- •ОСНОВА КОЛИЧЕСТВЕННОГО АНАЛИЗА
- •ВОЛЬТАМПЕРОМЕТРИЯ С ЛИНЕЙНОЙ РАЗВЕРТКОЙ ПОТЕНЦИАЛА НА СТАЦИОНАРНЫХ ЭЛЕКТРОДАХ (ЦИКЛИЧЕСКАЯ ВОЛЬТАМПЕРОМЕТРИЯ)
- •Рис. Вольтамперограмма при линейной развертки потенциала на электроде с постоянной площадью поверхности.
- •МЕТОД ЦИКЛИЧЕСКОЙ ВОЛЬТАМПЕРОМЕТРИИ (ЦВАМ) Метод циклической вольтамперометрии отличается тем, что в нем осуществляется
- •Форма I-E –кривых зависит от:
- •МЕТОД ВРАЩАЮЩЕГОСЯ ДИСКОВОГО ЭЛЕКТРОДА
- •Вращающийся дисковый электрод равнодоступен в диффузионном отношении (т. е. скорость диффузии одинакова в
- •Достоинства метода ВДЭ
- •Академик А.Н.ФРУМКИН и проф. Л.Н. НЕКРАСОВ предложили новый вариант вращающегося электрода – Вращающийся
- •Отличие метода ВДЭсК. Продукты реакции, образующиеся на диске, вместе с потоком жидкости проходят
- •ПОТЕНЦИОМЕТРИЯ
- •Для идеального индикаторного электрода:
- •Электродвижущую силу - Е электрохимической цепи, приведенной выше, определяют по уравнению:
- •Электроды для потенциометрического анализа
- •ВИДЫ ПОТЕНЦИОМЕТРИЧЕСКОГО АНАЛИЗА
- •1. Метод градуировочного графика. .
- •3. Метод концентрационного элемента.
- •Добавляя концентрированный раствор в стандартный, либо разводя его, получаем зависимость:
- •4. Метод потенциометрического титрования
- •Достоинства метода:
- •ЭЛЕКТРОЛИЗ И КУЛОНОМЕТРИЧЕСКИЙ АНАЛИЗ
- •1.Прямая кулонометрия - анализируемое вещество непосредственно подвергается электрохимическим превращениям.
- •Общая характеристика метода:
- •КОНДУКТОМЕТРИЯ
- •Электропроводность растворов зависит:
- •æ - Удельная электрическая проводимость равна электрической проводимости раствора, находящегося между параллельными электродами
- •Рис. Зависимость электропроводности от концентрации.
- •λ - Эквивалентная электрическая проводимость – проводимость
- •• Для сильных электролитов, в области разбавленных растворов, наблюдается линейная зависимость эквивалентной электрической
- •ЗАКОН АДДИТИВНОСТИ - закон независимости движения ионов ( Ф. Кольрауш)
- •МЕТОД КОНДУКТОМЕТРИЧЕСКОГО ТИТРОВАНИЯ.
- •Практически могут быть использованы такие химические реакции, в ходе которых достаточно заметно изменяется
- •Метод высокочастотного титрования.
- •.Практическое применение кондуктометрии
- •Общая характеристика метода.

КОНДУКТОМЕТРИЯ
Кондуктометрический метод анализа – это метод, основанный на измерении электропроводности (электрической проводимости) растворов.
Электропроводность (электрическая проводимость) раствора – это величина, обратная его сопротивлению. Если сопротивление раствора R, то его электропроводность W будет равна:
W = 1/R
Единицей измерения электропроводности является Ом-1 или См (Сименс).
Электропроводность растворов зависит:
1.От числа ионов в единице объема раствора, т.е. от концентрации С
2.От подвижности l этих ионов, т.е. от легкости, с которой они движутся в электрическом поле
3.От расстояния между электродами L (обратно пропорциональная зависимость)
4.От площади электродов S
Математически эта зависимость выражается формулой:
W = kSCl/L
Для конкретной пары электродов при неизменном расстоянии между ними L и S постоянны. После объединения всех постоянных величин в одну константу k получим:
W = kCl
Электропроводность раствора прямо пропорциональна концентрации и подвижности ионов в растворе
æ - Удельная электрическая проводимость равна электрической проводимости раствора, находящегося между параллельными электродами площадью 1 м2 при расстоянии между ними 1 м, или, другими словами – это электрическая проводимость столба раствора длиной 1 м и площадью поперечного сечения 1 м2.
Единицей измерения удельной электропроводности растворов является
См/м.
Удельная электропроводность раствора зависит
-от концентрации раствора,
-природы электролита
-температуры
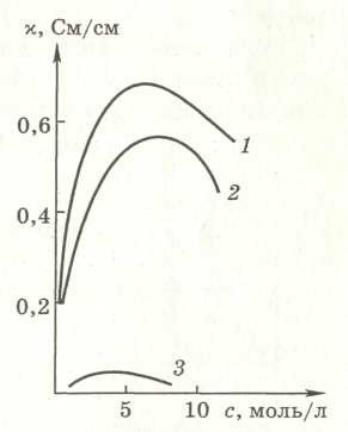
Рис. Зависимость электропроводности от концентрации.
1-HCl, 2-KOH,3-CH3COOH
В растворах электролитов æ с увеличением концентрации растет, при некоторой достаточно высокой концентрации достигает максимума и затем уменьшается.
Прямая кондуктометрия
Для аналитических измерений обычно используют область разбавленных и умеренно концентрированных растворов.
λ - Эквивалентная электрическая проводимость – проводимость
раствора, |
содержащего 1 |
кмоль |
эквивалента вещества, |
заключенного |
||
между |
двумя параллельными |
электродами, |
находящимися друг |
от |
||
друга на расстоянии 1 м. |
|
|
|
|
|
|
Единицей |
измерения эквивалентнойэлектрической |
проводимости |
λ |
|||
является См·м2/(кмоль- экв). |
|
|
|
|
|
|
Эквивалентная и удельная |
электрические проводимости связаны |
|
||||
между собой соотношением: |
|
|
|
|
|
|
λ= 1000æ /С
С- молярная концентрация эквивалента, моль/л
Эквивалентная |
электрическая |
проводимость зависит от |
-температуры,
-концентрации
-природы вещества.

• Для сильных электролитов, в области разбавленных растворов, наблюдается линейная зависимость эквивалентной электрической проводимости от концентрации:
° - предельная экв. эл.
проводимость при бесконечном разведении
Рис. Зависимость эквивалентной электрической проводимости от концентрации. 1- сильного, λ = λ∞ - а√С 2- слабого электролитов.
Из теории Дебая - Хюккеля, развитой Онзагером, уравнение преобразуется:
λ = λ∞ - (А λ∞ + В)√С
где А – коэффициент, характеризующий электрофоретический эффект; В – коэффициент, характеризующий релаксационный эффект.
ЗАКОН АДДИТИВНОСТИ - закон независимости движения ионов ( Ф. Кольрауш)
Предельная эквивалентная электрическая проводимость λ∞ является суммой предельных электрических проводимостей или предельных подвижностей ионов (катионов и анионов).
λ∞ = λ∞(+) + λ∞(-)

МЕТОД КОНДУКТОМЕТРИЧЕСКОГО ТИТРОВАНИЯ.
В методах кондуктометрического титрования измеряют
электрическую проводимость раствора после добавления небольших определенных порций титранта и находят точку эквивалентности графическим методом с помощью кривой в координатах æ – V (титранта).
Практически могут быть использованы такие химические реакции, в ходе которых достаточно заметно изменяется электрическая проводимость раствора или происходит резкое изменение (обычно возрастание) электрической проводимости после точки эквивалентности.
Реакции осаждения.
Реакции комплексообразования Реакции окисления-восстановления
Реакции кислотно-основного взаимодействия а) Титрование сильной кислоты сильным основанием (или сильного основания сильной кислотой)
б) Титрование слабой кислоты сильным основанием (слабого основания сильной кислотой)
в) Титрование слабой кислоты слабым основанием (слабого основания слабой кислотой)
г) Титрование смеси кислот и оснований

Метод высокочастотного титрования.
(Используются токи высокой частоты, электроды не соприкасаются с анализируемым раствором - бесконтактный метод).
Преимущества:
1.Возможность анализа агрессивных сред, пасты, эмульсии.
2.Нет химического взаимодействия электродов с раствором.
3.Простота.
4.Точность — погрешность 2-3 %.
Рис. Типы ячеек для высокочастотного титрования:
а – подключается к генератору в качестве ёмкости; б – в качестве индуктивности
