
- •Содержание курса лекций «Теоретические и экспериментальные методы исследования в химии. (Электрохимические
- •План лекции.
- •В соответствии с рекомендациями ИЮПАК все электрохимические методы анализа подразделяются на две большие
- •В электрохимических методах анализа -
- •ВОЛЬТАМПЕРОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
- •Уравнением полярографической волны:
- •КОЛИЧЕСТВЕННЫЙ ПОЛЯРОГРАФИЧЕСКИЙ АНАЛИЗ
- •МЕТОДЫ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ
- •2. В методе стандартных растворов в строго одинаковых условиях снимают полярограммы стандартного и
- •4. Дифференциальная полярография
- •АНАЛИЗ СМЕСИ ВЕЩЕСТВ
- •Условия проведения полярографического анализа:
- •Рис. Максимум I рода на фоне 0,05 М раствора KCI (1), исчезает после
- •АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- •1.Титрование с фиксацией диффузионного тока для определяемого вещества
- •2. Титрование с фиксацией диффузионного тока для титранта
- •3. Титрование с фиксацией диффузионного тока для определяемого вещества и титранта .
- •4. Титрование с фиксацией диффузионного тока, обусловленного продуктом реакции титрования.
- •В методах амперометрического титрования используют различные реакции:
- •Общая характеристика метода:
- •МЕТОД ИНВЕРСИОННОЙ ВОЛЬТАМПЕРОМЕТРИИ
- •Рис. Схема электрохимической ячейки для инверсионной вольтамперометрии.
- •ПРОЦЕССЫ:
- •Таблица. Значения потенциалов анодных пиков некоторых ионов металлов на фоне 0,1 М НСl
- •ОСНОВА КОЛИЧЕСТВЕННОГО АНАЛИЗА
- •ВОЛЬТАМПЕРОМЕТРИЯ С ЛИНЕЙНОЙ РАЗВЕРТКОЙ ПОТЕНЦИАЛА НА СТАЦИОНАРНЫХ ЭЛЕКТРОДАХ (ЦИКЛИЧЕСКАЯ ВОЛЬТАМПЕРОМЕТРИЯ)
- •Рис. Вольтамперограмма при линейной развертки потенциала на электроде с постоянной площадью поверхности.
- •МЕТОД ЦИКЛИЧЕСКОЙ ВОЛЬТАМПЕРОМЕТРИИ (ЦВАМ) Метод циклической вольтамперометрии отличается тем, что в нем осуществляется
- •Форма I-E –кривых зависит от:
- •МЕТОД ВРАЩАЮЩЕГОСЯ ДИСКОВОГО ЭЛЕКТРОДА
- •Вращающийся дисковый электрод равнодоступен в диффузионном отношении (т. е. скорость диффузии одинакова в
- •Достоинства метода ВДЭ
- •Академик А.Н.ФРУМКИН и проф. Л.Н. НЕКРАСОВ предложили новый вариант вращающегося электрода – Вращающийся
- •Отличие метода ВДЭсК. Продукты реакции, образующиеся на диске, вместе с потоком жидкости проходят
- •ПОТЕНЦИОМЕТРИЯ
- •Для идеального индикаторного электрода:
- •Электродвижущую силу - Е электрохимической цепи, приведенной выше, определяют по уравнению:
- •Электроды для потенциометрического анализа
- •ВИДЫ ПОТЕНЦИОМЕТРИЧЕСКОГО АНАЛИЗА
- •1. Метод градуировочного графика. .
- •3. Метод концентрационного элемента.
- •Добавляя концентрированный раствор в стандартный, либо разводя его, получаем зависимость:
- •4. Метод потенциометрического титрования
- •Достоинства метода:
- •ЭЛЕКТРОЛИЗ И КУЛОНОМЕТРИЧЕСКИЙ АНАЛИЗ
- •1.Прямая кулонометрия - анализируемое вещество непосредственно подвергается электрохимическим превращениям.
- •Общая характеристика метода:
- •КОНДУКТОМЕТРИЯ
- •Электропроводность растворов зависит:
- •æ - Удельная электрическая проводимость равна электрической проводимости раствора, находящегося между параллельными электродами
- •Рис. Зависимость электропроводности от концентрации.
- •λ - Эквивалентная электрическая проводимость – проводимость
- •• Для сильных электролитов, в области разбавленных растворов, наблюдается линейная зависимость эквивалентной электрической
- •ЗАКОН АДДИТИВНОСТИ - закон независимости движения ионов ( Ф. Кольрауш)
- •МЕТОД КОНДУКТОМЕТРИЧЕСКОГО ТИТРОВАНИЯ.
- •Практически могут быть использованы такие химические реакции, в ходе которых достаточно заметно изменяется
- •Метод высокочастотного титрования.
- •.Практическое применение кондуктометрии
- •Общая характеристика метода.
Содержание курса лекций «Теоретические и экспериментальные методы исследования в химии. (Электрохимические
методы исследования)»
Базанов М.И.
ФГБОУВПО «ИГХТУ» Кафедра аналитической химии
2012
План лекции.
1.Введение (краткий экскурс из истории развития электрохимических методов исследования. Роль ученых России).
2.Классификация электрохимических методов исследования.
3.Современные электрохимические методы исследования (тип метода, вид установки или принципиальная схема, какие данные можно получить, где использовать, преимущества и недостатки.
4.Общий анализ и выводы.
В соответствии с рекомендациями ИЮПАК все электрохимические методы анализа подразделяются на две большие группы:
-методы без протекания электрохимических реакций на электродах электрохимической ячейки (кондуктометрия с использованием токов низких 50-10000 Гц и высоких частот более 1 МГЦ);
-методы с протеканием электрохимических реакций на электродах электрохимической ячейки. К ним относятся потенциометрия, кулонометрия, вольтамперометрия (полярография) и другие методы анализа.
В электрохимических методах анализа -
аналитическим сигналом (измеряемой величиной) могут служить:
Id - предельный диффузионный ток.
Id =f(с) - метод амперометрии
Е- потенциал электрода или эдс системы.
Е=f(с) - метод потенциометрии
Q - количество прошедшего электричества
Q =f (с) - метод кулонометрии
- Эквивалентная электрическая проводимость,
æ- удельная электрическая проводимость.
, æ = f(с) - метод кондуктометрии
ВОЛЬТАМПЕРОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
Вольтамперометрический метод анализа основан на расшифровке поляризационных кривых (вольтамперограмм), получаемых в электролитической ячейке с поляризующимся индикаторным электродом и неполяризующимся электродом сравнения. В зависимости от вида развертки потенциала и механизма массопереноса различают вольтамперометрию с линейной разверткой потенциала, вольтамперометрию со ступенчатым изменением потенциала, гидродинамические методы и инверсионную вольтамперометрию.
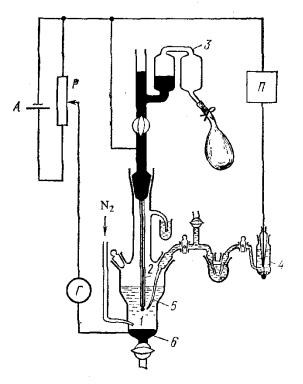
Рис. |
Принципиальная |
схема |
полярографической установки. |
|
|
А-аккумулятор, Р-делитель напряжения, П- потенциометр, Г-гальванометр, 1-растущая ртутная капля, 2-капилляр, 3-система для регулирования высоты ртутного столба, 4- электрод сравнения, 5- раствор электролита, 6-вспомогательный ртутный электрод.
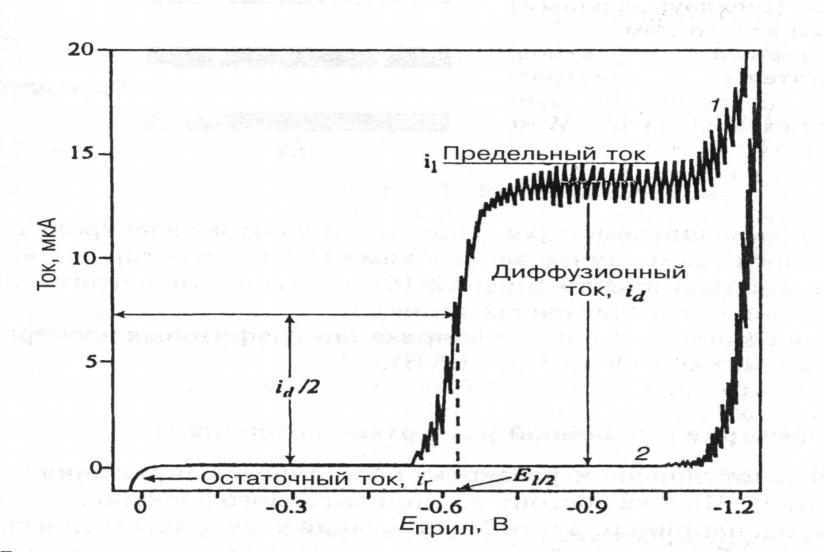
Рис. Полярограмма для растворов: 1-1 М HCI + 5 10-4 M Cd2+ ; 2- 1 М HCI (фоновый электролит). Без перемешивания раствора.
Уравнением полярографической волны:
Е = Е1/2 + (R T / n F) ln ( Id – I ) / I, (1)
где Е1/2 – потенциал полуволны; Id – диффузионный ток. При I = Id / 2 уравнение (1) переходит в
Е = Е1/2 . (2)
Это соотношение показывает независимость потенциала полуволны от тока и, следовательно, от концентрации восстанавливающегося иона. Потенциал полуволны является качественной характеристикой иона в растворе данного фонового электролита, и определение потенциала полуволны составляет основу качественного полярографического анализа.
Для обратимых электрохимических процессов можно показать, что Е1/2 = Е0
Однако, это следует делать с осторожностью. рН может влиять на величину Е1/2 . Так при электрохимическом восстановлении органических соединений
с участием ионов водорода:
Ox + ne- +2 H+ RedH2
выполняется уравнение Е1/2 = Е0 – рН. Для избежания влияния рН
используют буферные растворы с высокой буферной емкостью.
КОЛИЧЕСТВЕННЫЙ ПОЛЯРОГРАФИЧЕСКИЙ АНАЛИЗ
Основан на уравнении Ильковича:
Id=607zD1/3m2/3 1/6C (3)
Z - заряд иона,
m- скорость истечения ртути, мг/с- период капания, с
D - коэффициент диффузии, см2/c
С - объемная концентрация анализируемого вещества, М
При постоянных |
условиях полярографирования: |
z, m, , D – const |
Id = kC |
Id (h)– количественная характеристика.

МЕТОДЫ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ
1. Метод градуировочного графика.
h
hx
Cx |
C |
h-высота полярографической волны. h = Id (величине предельного диффузионного тока )
2. В методе стандартных растворов в строго одинаковых условиях снимают полярограммы стандартного и анализируемого растворов и по уравнению 4. рассчитывают неизвестную концентрацию Сx :
CX CСТ |
hX |
( 4) |
hСТ |
где Сст - концентрация стандартного раствора; hx , hcт - высоты волн
анализируемого и стандартного растворов(величины предельного диффузионного тока).
3. Метод добавок. Сначала регистрируется полярограмма исследуемого раствора, затем к раствору добавляется известное количество стандартного раствора Сст и
снова регистрируется полярограмма. Концентрация исследуемого раствора Сx |
|||
находится по уравнению 5. |
hX |
|
|
CX CСТ |
( 5 ) |
||
hX СТ hX |
|||
где hx - высота волны исследуемого раствора; hx + ст - высота волны исследуемого раствора с добавкой стандартного вещества.
