
- •энергетических состояний, характеризуемая одними и теми же величинами L и S и имеющих
- •Правила Хунда:
- •Правила отбора
- •Спектральные методы
- •Эмиссионно-спектральный анализ (ЭСА) Атомно-эмиссионная спектрометрия с индуктивно связанной плазмой (IСP-AES) Масс-спектрометрия с индуктивно
- •Эмиссионно-спектральный анализ (ЭСА)
- •Вид эмиссионных спектров
- ••Линии, обусловленные переходом электрона на основной уровень, принято называть резонансными. Особое
- •Основные узлы приборов в АЭС
- •Источники возбуждения спектров
- •Диспергирующий элемент(светофильтры, монохроматоры и полихроматоры.
- •Детекторы
- ••Качественный спектральный анализ основан на индивидуальности эмиссионных спектров каждого элемента и сводится, как
- •Количественный анализ
- ••В методе трех эталонов на одной фотопластинке фотографируют спектры трех эталонов с известным
• |
ΔЕ=hν |
•1. Главное квантовое число п (п = 1-7 для атомов в основном состоянии) соответствует уровням, обозначаемым К, L, M, ...
Q, и характеризует удаленность электрона от ядра.
•2. Квантовое число орбитального углового момента l (l<п, l = 0,1,2,...) соответствует подуровням s, p, d, f и связано с пространственным распределением электронной плотности.
•3. Орбитальное магнитное квантовое число ml (любое целое, удовлетворяющее условию - l < ml < +l).
•4. Спиновое квантовое число ms (ms = ±1/2).
энергетических состояний, характеризуемая одними и теми же величинами L и S и имеющих близкую
энергию
• L - суммарный орбитальный момент атома
• S- суммарный спин атома
• М=2S+1 -мультиплетность терма.
• 2S+1LJ - Полное обозначение терма
• L = 0, 1, 2, 3, 4, - обозначаются S,
P, D, F, G
Правила Хунда:
•1. Основное, т. е. низшее, энергетическое состояние имеет наибольшее значение суммарного спина М (мультиплетности).
•2. Среди термов с максимальной мультиплетностью низшим является тот, у которого наибольшее значение L.
•3. Низшим компонентом мультиплета будет J = L – S, если уровень за-полнен меньше чем наполовину, и J = L + S, если он заполнен больше чем наполовину.
Правила отбора
•Разрешены переходы при которых терм меняется на единицу,т.е P-S, D-PНо не P-P, D-D или S-D L= 1 правило
изменения четности
•Внутреннее квантовое число J может меняться только на 1 или
совсем не менятся. Запрещены переходы, при которых J= 2
•Разрешены переходы без изменения мультиплетности M=2S+1
Спектральные методы
Спектральные методы являются наиболее распространенным видом исследования элементного состава вещества. Они достаточно экспрессные, разнообразны, широко используются для анализа как жидких, так и твердых и газообразных проб.
Под спектральным анализом понимают совокупность приемов, с помощью которых в результате измерения спектров исследуемого образца качественно или количественно определяют содержание в нем интересующих элементов. Обычно наблюдают спектральные линии, лежащие в видимой и ультрафиолетовой областях спектра. При использовании других областей это всегда отмечают в названии соответствующего метода: рентгеноспектральный анализ,
Эмиссионно-спектральный анализ (ЭСА) Атомно-эмиссионная спектрометрия с индуктивно связанной плазмой (IСP-AES) Масс-спектрометрия с индуктивно связанной плазмой (ICP- MS) Рентгенофлуорисцентный спектральный анализ (РФСА) Атомно-абсорбционный анализ (ААА)
Эмиссионно-спектральный анализ (ЭСА)
ЭСА анализ является
наиболее широко применяемым
методом определения
содержания элементов по характеристическому
линейчатому спектру испускания (эмиссии) свободных, нейтральных или ионизованных атомов
химического элемента в
оптическом диапазоне электромагнитных волн в самых разнообразных
природных и искусственных
материалах.
С его помощью можно анализировать твердые, жидкие и газообразные
вещества более 70 элементов в
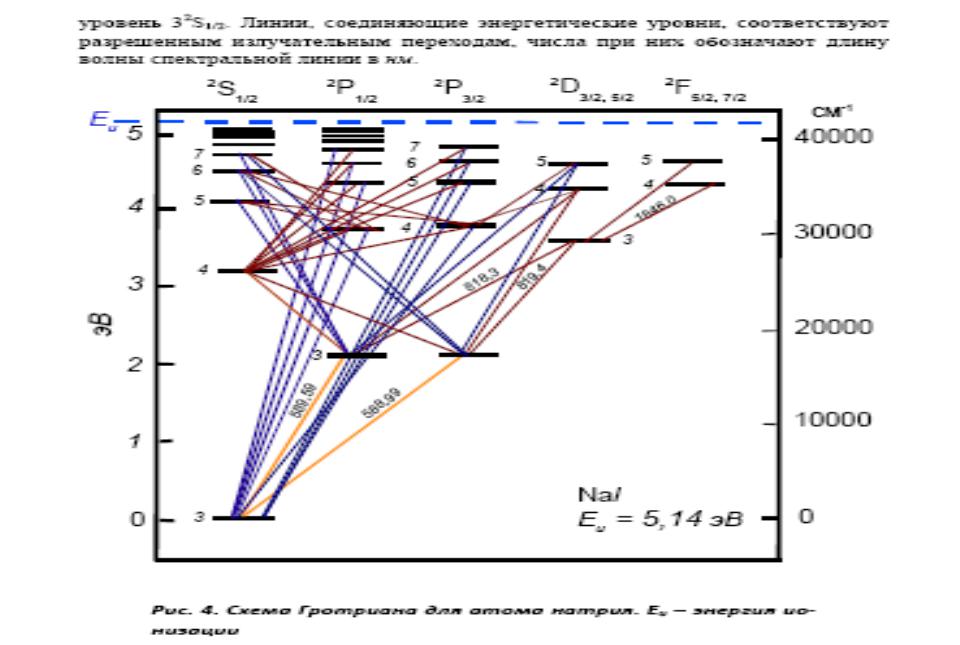

Вид эмиссионных спектров
•Линии, обусловленные переходом электрона на основной уровень, принято называть резонансными. Особое
аналитическое значение имеют все резонансные линии, соответствующие переходам с первого возбужденного
уровня на основной
•Наибольшую интенсивность имеют линии, имеющие низкий потенциал возбуждения и соответствующие разрешенным переходам. При уменьшении концентрации вещества в анализируемой пробе они исчезают из спектра после всех других линий данного элемента. Поэтому их называют последними. Для алюминия последними будут четыре линии: 3961,5 , 3944,1 (переход 4s 3р), 3092,7 и 3082,2 (переход
3d 3р). Большинство последних линий являются
резонансными.

4 s - 3 p |
3 d - 3 p |
5 s - 3 p |
4 d - 3 p |
5 d - 3 p |
n = 6
n = 5
n = 4
n = 3
E ( э В )  6
6
5
4
3
2
1
0
, 5 , 1 |
, 8 , 1 |
, 4 , 5 |
, 1 , 4 , 0 |
, 4 , 1 |
1 4 |
2 2 |
0 2 |
5 5 8 |
3 7 |
6 4 |
9 8 |
6 5 |
7 7 6 |
7 6 |
9 9 |
0 0 |
6 6 |
5 5 5 |
3 3 |
3 3 |
3 3 |
2 2 |
2 2 2 |
2 2 |
|
|
|
|
|
5 |
f |
|
6 |
p |
5 |
d |
4 |
f |
|
|
|
||||
6 |
s |
|
|
|
|
|
|
5 |
p |
4 |
d |
|
|
5 |
s |
|
|
|
|
|
|
4 |
p |
3 d |
|
|
|
|
|
|
|
|
||
4 s
3 p
