
- •Кгту-кхти. Кафедра физики. Поливанов м.А., Старостина и.А., Кондратьева о.И.
- •1. Молекулярно-кинетическая теория идеальных газов
- •1.1. Термодинамические параметры. @
- •1. 2. Уравнение состояния идеального газа. @
- •1. 3. Основное уравнение молекулярно – кинетической теории идеальных газов и его следствия. @
- •1. 4. Барометрическая формула. @
- •1. 5. Закон Больцмана о распределении частиц во внешнем потенциальном поле. @
- •1. 6. Распределение Максвелла молекул идеального газа по скоростям. @
- •2. Основы термодинамики
- •2.1. Внутренняя энергия. @
- •2.2. Первое начало термодинамики. @
- •2. 3. Теплоемкость. @
- •2. 4. Применение первого начала термодинамики к изопроцессам.@
- •2. 6. Энтропия. @
- •3. Явления переноса
- •3.1. Теплопроводность. @
- •3. 2. Внутреннее трение (вязкость). @
- •3. 3. Диффузия. @
- •4. Реальные газы
- •4.1. Понятие фазы и фазовых переходов. @
- •4. 2. Уравнение Ван-дер-Ваальса. @
- •4. 3. Изотермы реальных газов. @
- •5. Жидкости
- •5. 1. Свойства и строение жидкостей. @
- •5. 2. Поверхностное натяжение жидкостей. @
- •5. 3. Смачивание. Краевой угол. @
- •5. 4. Поверхностное испарение и кипение жидкостей. @
- •6. Особенности твердого состояния вещества
- •6.1. Структура твердых тел. @
- •6. 2. Физические типы кристаллических решеток. @
- •6. 3. Теплоемкость кристаллов. @
- •6.4. Плавление и кристаллизация.@
2. 3. Теплоемкость. @
Одним из основных свойств тел, которое широко используется в термодинамике, является теплоемкость. Теплоемкостью тела называется физическая величина, численно равная отношению теплоты δQ, сообщаемой телу, к изменению температуры тела в рассматриваемом термодинамическом процессе. Теплоемкость тела зависит от его химического состава, массы и термодинамического состояния, а также от вида процесса, в котором поступает теплота. Тепловые свойства однородных тел характеризуются понятиями удельной и молярной теплоемкостей.
Удельная теплоемкость вещества – величина, численно равная количеству теплоты, необходимому для нагревания единицы массы вещества на 1 Кельвин при данном процессе, единица измерения – Дж/(кг∙К)
М![]()
![]() олярная
теплоемкость – величина, равная
количеству теплоты, необходимому для
нагревания одного моля вещества на 1К
, т.е. С =сМ, где М – молярная масса
вещества.Теплоемкости одного и
того же вещества при разных термодинамических
процессах нагревания различаются.
олярная
теплоемкость – величина, равная
количеству теплоты, необходимому для
нагревания одного моля вещества на 1К
, т.е. С =сМ, где М – молярная масса
вещества.Теплоемкости одного и
того же вещества при разных термодинамических
процессах нагревания различаются.
Найдем молярную теплоемкость системы в изобарном процессе, для этого возьмем один моль газа и сообщим ему количество теплоты δQМ. Согласно определению молярной теплоемкости и первому началу термодинамики можем
записать (здесь δАМ- работа одного моля газа)
![]()
Если газ нагревается при постоянном объеме, то dV=0 и δАМ =0. Сообщаемая газу теплота идет только на увеличение его внутренней энергии и теплоемкость для изохорного процесса
![]() Откуда
следует, что
Откуда
следует, что
И![]() з
уравнения Менделеева – Клапейрона для
изобарного процесса можно получитьpdVМ=RdT.
Таким образом,pdVМ/dT=R. Из
этой формулы следует физический смысл
газовой постоянной: она численно равна
работе (δАМ=pdVМ),
совершаемой одним молем идеального
газа, при его изобарном нагревании на
1 К. После замены получаем:
з
уравнения Менделеева – Клапейрона для
изобарного процесса можно получитьpdVМ=RdT.
Таким образом,pdVМ/dT=R. Из
этой формулы следует физический смысл
газовой постоянной: она численно равна
работе (δАМ=pdVМ),
совершаемой одним молем идеального
газа, при его изобарном нагревании на
1 К. После замены получаем:
Э![]() то
выражение называется уравнением Майера,
оно показывает, что молярная теплоемкость
при постоянном давлении Срвсегда
больше, чем теплоемкость при постоянном
объемеCv
на величину, равную молярной газовой
постоянной. Это объясняется тем, чтопри постоянном объеме все
подводимое тепло идет только на
увеличение внутренней энергии, т.е.
повышение Т, а при постоянном давлении
кроме этого требуется еще дополнительное
количество теплоты на совершение работы
газом против внешних сил при его
расширении.
то
выражение называется уравнением Майера,
оно показывает, что молярная теплоемкость
при постоянном давлении Срвсегда
больше, чем теплоемкость при постоянном
объемеCv
на величину, равную молярной газовой
постоянной. Это объясняется тем, чтопри постоянном объеме все
подводимое тепло идет только на
увеличение внутренней энергии, т.е.
повышение Т, а при постоянном давлении
кроме этого требуется еще дополнительное
количество теплоты на совершение работы
газом против внешних сил при его
расширении.
2. 4. Применение первого начала термодинамики к изопроцессам.@
Различают следующие виды термодинамических процессов:
1. Изохорный - это процесс, протекающий при постоянном объеме. V=const.На диаграмме в координатах (р, Т) он изображается прямой, называемой изохорой (рис.2.3.). При изохорном процессе газ не совершает работы над внешними телами, так какdV=0. Вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии и отсюдаIначало термодинамики для изохорного процессаδQ = dU. Для одного моляδQм=dUм , где dUм=СVdT.Изохорным является процесс сгорания топлива в карбюраторном двигателе.
2. Изобарный – это процесс, протекающий при постоянном давлении.Прямая, изображающая этот процесс в координатах (V,T), называется изобарой (рис.2.4.). Первое начало термодинамики для
изобарного процесса δQ = dU + δA. Так давление не меняется, то работа газа при увеличении объема отV1доV2 равна
Т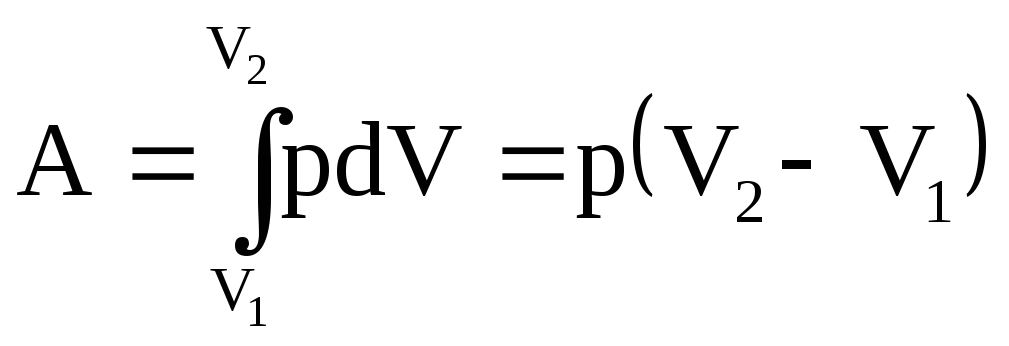 еплота,
сообщаемая газу массойmв изобарном процессе
еплота,
сообщаемая газу массойmв изобарном процессе
при
этом его внутренняя энергия возрастает
на величину ![]()
т![]() ак
как внутренняя энергия идеального газа
не зависит от давления и объема, а
определяется лишь температурой. При
изобарном нагревании к системе подводится
теплоδQ>0 иδA>0, так как газ расширяется. При изобарном
сжатии направление процесса меняется
на противоположное и теперь тепло
отводится от системы, т.е.δQ<0 иδA<0, так как работу
над газом совершают внешние силы.dUтакже будет меньше нуля. Примером
изобарного процесса может служить
процесс образования пара в паровых
котлах или сгорания топлива в
воздушно-реактивных двигателях.
ак
как внутренняя энергия идеального газа
не зависит от давления и объема, а
определяется лишь температурой. При
изобарном нагревании к системе подводится
теплоδQ>0 иδA>0, так как газ расширяется. При изобарном
сжатии направление процесса меняется
на противоположное и теперь тепло
отводится от системы, т.е.δQ<0 иδA<0, так как работу
над газом совершают внешние силы.dUтакже будет меньше нуля. Примером
изобарного процесса может служить
процесс образования пара в паровых
котлах или сгорания топлива в
воздушно-реактивных двигателях.
3. Изотермический
– это процесс, протекающий при постоянной
температуре.Кривая, построенная
в координатах (р,V),
называется изотермой. Она представляет
собой гиперболу ( рис.2.5.),
расположенную на диаграмме тем выше,
чем выше температура, при которой
происходит процесс. Так как при Т =constвнутренняя энергия идеального газа не
изменяется, тоdU= 0 и
первое начало термодинамики для
изотермического процесса примет вид:δQ
= δА.
Теплоемкость при изотермическом
процессе СТ =δQ/dT=δQ/0
= ∞ и не имеет смысла.Изотермический
процесс осуществляется при наличии
термостата (внешней среды или тела с
большим запасом внутренней энергии,
находящемся при той же температуре).
рис.2.5.),
расположенную на диаграмме тем выше,
чем выше температура, при которой
происходит процесс. Так как при Т =constвнутренняя энергия идеального газа не
изменяется, тоdU= 0 и
первое начало термодинамики для
изотермического процесса примет вид:δQ
= δА.
Теплоемкость при изотермическом
процессе СТ =δQ/dT=δQ/0
= ∞ и не имеет смысла.Изотермический
процесс осуществляется при наличии
термостата (внешней среды или тела с
большим запасом внутренней энергии,
находящемся при той же температуре).
Найдем работу изотермического расширения газа, учитывая, что все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил и не изменяет его температуру. Учитывая формулу для работы и уравнение Менделеева-Клайперона, получаем
П
 римерами
изотермических процессов являются
закалка и отжиг сталей в процессе их
изготовления. Существуют автомобили
и вагоны – рефрижераторы, служащие для
перевозки скоропортящихся продуктов.
Они имеют теплоизолированный кузов и
холодильники для поддержания внутри
постоянной температуры и поэтому
процесс перевозки продуктов в таких
условиях можно назвать изотермическим..
римерами
изотермических процессов являются
закалка и отжиг сталей в процессе их
изготовления. Существуют автомобили
и вагоны – рефрижераторы, служащие для
перевозки скоропортящихся продуктов.
Они имеют теплоизолированный кузов и
холодильники для поддержания внутри
постоянной температуры и поэтому
процесс перевозки продуктов в таких
условиях можно назвать изотермическим..
4. Адиабатический процесс. Адиабатическим называется процесс, при котором отсутствует теплообмен между системой и окружающей средой, т.е. δQ = 0, Q = const. Так какδQ= 0, первое начало термодинамики имеет вид:δА=-dUт.е. работа совершается за счет внутренней энергии газа. Если газ расширяется, тоδА>0,dU<0 и температура газа уменьшается. Если происходит сжатие газа, тоδА<0 иdU>0. Работу над газом совершают внешние силы, внутренняя энергия (а, значит, и температура) газа повышается.Реализовать адибатический процесс можно, если проводить его либо при хорошей теплоизоляции от окружающей среды, либо быстро за короткое время, при котором теплообмен будет мал.
Пуассона или показатель адиабаты. Уравнение адиабатического процесса (уравнение Пуассона) имеет вид: рVγ = const, где γ = Ср /Cv – коэффициент (показатель адиабаты).
Диаграмма адиабатического процесса (адиабата) в координатах (р,V) изображается гиперболой, более крутой, чем изотерма (рис.2.6.). Объясняется это тем, что при адиабатном сжатии увеличение давления происходит не только за счет уменьшения объема, как при изотермическом сжатии, но также связано с возрастанием температуры. Согласно уравнению р =nkT=NkT/Vдавление пропорциональноT/Vи в случае адиабатического сжатия его возрастание определяется одновременно и возрастанием температуры, и уменьшением объема. При адиабатном расширении газа его температура уменьшается и давление падает быстрее, чем при соответствующем изотермическом расширении, поскольку давление уменьшается пропорциональноT/Vи его падение определяется одновременно и понижением температуры, и увеличением объема. Теплоемкость при адиабатическом процессе СQ=Q/ΔT=0/ΔT=0, не имеет большого смысла. Адиабатические процессы широко распространены в технике, например, в двигателях внутреннего сгорания. Истечение газов через сопла реактивных двигателей также может считаться адиабатическим процессом, поскольку происходит очень быстро. Отчетливо выражен адиабатический характер процесса сжатия в дизеле, который не имеет зажигания: адиабатическое нагревание смеси при сжатии приводит к ее самовоспламенению. И, наконец, самый простой бытовой пример: сифон для газирования воды – в момент прокола газового баллончика, когда газ мгновенно его покидает, сам баллончик резко охлаждается (покрывается инеем).
Второе начало термодинамики. @
Т
Рис.2.7.
Круговой процесс (цикл).
Если система, пройдя через ряд состояний, возвращается в исходное, то такой процесс называется круговым процессом, или циклом. Циклы лежат в основе работы всех тепловых машин – двигателей внутреннего сгорания, паровых и газовых турбин, холодильников. На диаграмме процессов в координатах (р,V) цикл изображается замкнутой кривой, где процесс 1-2 – процесс расширения газа, а 2-1 – процесс сжатия (рис. 2.7.). В результате кругового процесса система может теплоту как получать, так и отдавать. Обозначим полученное количество теплотыQ1, а отданное -Q2. Работа, совершаемая газом за цикл, определяется площадью фигуры, ограниченной кривой 1-2-1. В результате цикла система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа равно нулю, а работа, совершаемая за цикл, равна полученной теплотеQ=Q1 ‑Q2 = А.
