
lecture2ах
.pdf
Кафедра медичної та загальної хімії
Аналітична хімія
Лекція 2
Розчини електролітів в аналітичній хімії. Іонні рівноваги в аналітичній хімії
Доц., к.х.н. Г.М.Зайцева

Розчини електролітів в аналітичній хімії
Теоретичний розгляд аналітичних реакцій ускладнюють два чинники.
1. Стан речовини у розчині
• Різна реакційна здатність різних форм і визначуваного
компоненту Х, і реагенту R .
• Вплив на рівновагу,
• Вплив на швидкість аналітичної реакції.
2. Ефект впливу іонної сили ( речовини Х і R знаходяться в розчині у вигляді іонів)
реакційна здатність знижується за рахунок електростатичної взаємодії з іншими іонами

Стан речовин в розчині:
сольватація
Сольватаціяпроцес утворення сольватів (у водному розчині – гідратів)
Фізична сольватація -електростатична взаємодією іонів з дипольними молекулами розчинника (максимальна у полярних розчинниках)
Хімічна сольватація – утворення донорно-акцепторних зв'язків.
•Молекули практично всіх розчинників мають донорну електронну пару.
•Хімічна сольватація більшою мірою характерна для катіонів металів →
октаедричні комплекси [М(H2O) 6]z+.
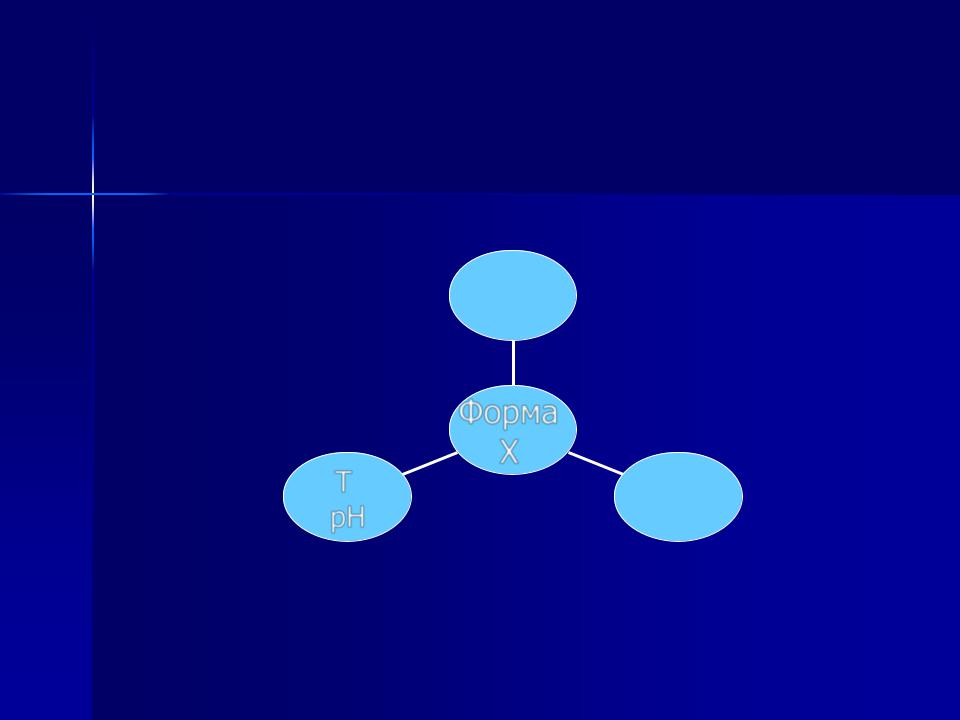
Стан речовин в розчині
Загальна концентрація
речовини Х
С(Х)
Т
рН
Форма
Х
С(М)
Сторонніх іонів та їх концентрації

Стан речовин в розчині:
дисоціація і іонізація
СH3COOH  CH3COO- + H+ Cu(OH)2
CH3COO- + H+ Cu(OH)2  [CuOH]+ + OH- (перша ступінь)
[CuOH]+ + OH- (перша ступінь)
[CuOH]+  Cu2+ + OH- (друга ступінь)
Cu2+ + OH- (друга ступінь)
H CO |
3 |
H+ + HCO - (перша ступінь) |
2 |
3 |
HCO3-  H+ + CO32- (друга ступінь)
H+ + CO32- (друга ступінь)
.
Т |
C(HgCl+); |
c(HgCl ) |
c(Hg2+) |
2 |
|

Стан речовин в розчині:
асоціація і полімеризація
pH
CrO |
2– |
Cr |
O 2– |
4 |
2 |
7 |
|
[OH-] |
|
|
[H+] |
c(Сr+6) |
|
|
c(Сr+6) |
Природа розчинника |
|||
Малополярні розчинники : |
|
|
|
Нейтральні іонні асоціати |
|
|
|
Cа2+ + SO 2– |
[ Cа2+.SO 2– ] (спиртовий розчин) |
||
4 |
|
4 |
|
Молекулярні асоціати Слабкі електроліти, неелектроліти, самі молекули розчинника.
Реакційна здатність та швидкість реакції змінюється.

Стан речовин в розчині
Кислотно-основні процеси.
Результат взаємодії з розчинником:
Na2S у H2O → Na+; HS–; H2S; S2–.
Яка з трьох форм сірководню домінує в розчині, визначається в основному величиною значення рН.
Комплексоутворення.
Сu2+ у NH3 → Сu2+; [Cu(NH3)]2+, [Cu(NH3)2]2+, [Cu(NH3)3]2+,
[Cu(NH3)4]2+.
Домінування тих або інших частинок у досліджуваному розчині залежить від того, яка в цьому розчині концентрація надлишку аміаку

Загальні і рівноважні концентрації
C0 (x) - початкова концентрація (моль/л) речовини Х в аналізованому розчині.
С(x) -. рівноважна концентрація речовини Х у результаті реакції Х з R. Рівноважну концентрацію деякої форми Х записують в квадратних дужках.
С(Fe) = [Fe2+] + [Fe3+]
рівняння матеріального балансу
[Fe2+] = α(Fe2+) С(Fe); [Fe3+] = α(Fe3+) С(Fe).
Де α(Fe2+) і α(Fe3+) – (молярні) мольні частки відповідних форм феруму.
У загальному випадку рівноважна концентрація i-ої форми Х дорівнює:
[Хi] = i C(X)
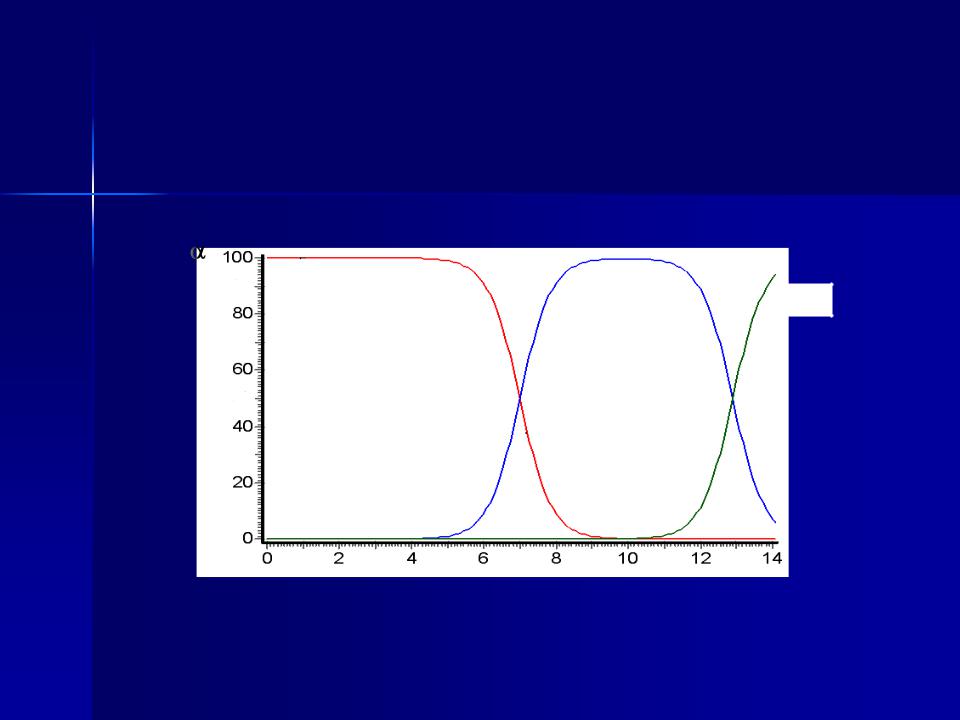
Розподільча (іонна) діаграма для водного розчину сірководню:
1 – Н2S, 2 – HS–, 3 – S2–
1 |
2 |
3 |
pH
0<α <1

Електростатичні взаємодії в розчинах
полярний розчинник + розчинена речовина (сильний електроліт) → іонна атмосфера.
змінюються умови руху і хімічної взаємодії іонів, і властивості розчиненої речовини в реальному розчині відрізняються від розчину ідеального (нескінченно розбавленого) .
Стан розчинених частинок при цьому характеризує величина активності, а ступінь відхилення активності від концентрації – коефіцієнт активності.
аi = fi Сi
де аi – активність;
fi – коефіцієнт активності; Сi – концентрація, моль/л.
Для молекул розчиненої речовини fi ≈ 1 і аi ≈ Сi
