
- •6.1. Окисление углерода
- •6.2. Окисление кремния
- •11.3. Окисление и восстановление кремния
- •6.3. Окисление марганца
- •6.4. Окисление фосфора
- •Раскисление и легирование стали
- •Легирование стали
- •15.1. История развития
- •15.2. Общая схема современного конвертерного процесса
- •Конвертерный процесс с комбинированной продувкой
- •Конвертер — агрегат для новых процессов
По какому признаку железоуглеродистые сплавы делят на чугун и сталь?
Сталь — это сплав железа с углеродом; содержание углерода в стали не превышает 2%.
К сталям относятся:
техническое железо,
конструкционная и
инструментальная сталь.
Чугун — сплавы железа с углеродом, в которых содержание углерода превышает 2%. Среднее содержание углерода в чугуне 2,5—3,5%.
Кроме железа и углерода, в сталях и чугунах присутствуют примеси:
кремний и марганец в десятых долях процента (0,15— 0,60%)
сера и фосфор в сотых долях процента (0,05—0,03%) каждого элемента.
Дать определение понятию «сталь».
Сталь – это сплав железа (могут входить и другие сплавы), чугуна и углерода. Углерод в этом сплаве является незаменимым компонентом, его содержание около 2%. В зависимости от состава стали, она может быть прочным материалом или твердым. Прочный материал используется для изготовления морских судов, мостов. Что же касается твердой стали, она используется для изготовления различных металлорежущих инструментов. Существует также нержавеющая сталь, которая является очень прочным и антикоррозионным материалом. Нержавеющая сталь состоит из хрома и никеля. Сталь — это материал, которому можно придавать любую форму с помощью прокатки, прессования или литья. С помощью термообработки, возможно, получить сталь, которая будет обладать различными как химическими, так и физическими свойствами. Некоторые мягкие стали обрабатываются ручным инструментом. Твердой сталью можно даже резать стекло. Сталь легко подвергается методу полировки.
Чугуноватая сталь – это сталь, в составе которой содержание углерода больше чем чугуна. Этот вид стали получается кричным способом.
Литая сталь – это сталь, которая получается методом отливки с помощью разливочного ковша. Литую сталь подразделяют на: тигельную, бессемеровскую и мартеновскую. Жидкую сталь можно сразу разлить в формы, после чего получится готовое изделие. Для того чтобы не образовались пузырьки, в сталь добавляют алюминий.
С помощью термообработки, можно изменить механические свойства стали. В отожженном состоянии сталь настолько пластична, что с помощью инструмента, ей можно придать необходимую форму. После этого сталь закаливают, чтобы она сохранила свой вид. К тому же, чем больший процент содержания углерода, тем большая твердость стали после процесса закалки. Закалка является одним из самых важных процессов при термообработке, так как возможно разложение твердого раствора углерода в железе.
Сталь – это металл, который пользуется широким применением. Ее используют как в строительстве, так и в машиностроении.
Для чего вводят в сталь легирующие элементы?
Легированной называют такую сталь, в составе которой помимо обычных примесей содержатся легирующие примеси либо содержание кремния и марганца в которой повышено против обычного количества.
Легирующими могут быть как элементы, не встречающиеся в обычной стали, так и элементы, которые в каких-то количествах содержатся во всякой стали (С, Mn, Si, S, Р).
Это стали в состав которых помимо углерода и примесей целенаправленно вводят один или несколько легирующих элементов для обеспечения требуемой прочности, пластичности, вязкости и др. технологических и эксплуатационных свойств. Легирование производится с целью изменения механических свойств (прочности, пластичности, вязкости), физических свойств (электропроводности, магнитных характеристик, радиационной стойкости) и химических свойств (коррозионной стойкости).
Элемент легирующий – это элемент, специально добавляемый в сталь для изменения ее строения и свойств. Концентрация легирующих элементов может быть различной, в т.ч. и очень малой. Когда концентрация элемента составляет менее 0,1% легирование стали принято называть микролегированием.
Основные легирующие элементы – это хром (Cr), никель(Ni), марганец (Mn), кремний (Si), молибден (Mo), ванадий (V), бор (B), вольфрам (W), титан (Ti), алюминий (Al), медь (Cu), ниобий (Nb), кобальт (Co).
На какие группы делят стали по физико-механическим свойствам?
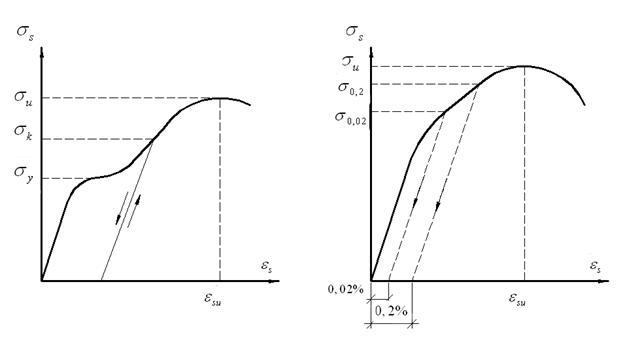
Характеристики
прочности и деформативности сталей
устанавливают по диаграмме Гs –
µs,
получаемой из испытаний образцов на
растяжение. Горячекатаная арматурная
сталь, имеющая на диаграмме площадку
текучести, обладает значительным
удлинением до разрыва (мягкая сталь)
(рис. 13, а).
Напряжение, при котором деформации
развиваются без заметного увеличения
нагрузки, называетсяфизическим
пределом текучести арматурной
стали ![]() .
.
 а)
б)
а)
б)
Рис.. Диаграммы Гs – µs при растяжении арматурной стали:
а – мягкая малоуглеродистая сталь с площадкой текучести;
б – высокопрочная, легированная сталь с условным пределом текучести.
Повышение прочности сталей достигают следующими методами:
путем введения углерода и легирующих добавок (марганец, хром, кремний, титан и др.);
термическим упрочнением - закаливание стали (нагрев до 800…900оС и быстрое охлаждение), затем частичный отпуск (нагрев до 300…400оС и постепенное охлаждение);
холодным
деформированием – при вытяжке в холодном
состоянии до напряжения ![]() сталь
упрочняется; при повторной вытяжке
пластические деформации уже выбраны,
напряжение
сталь
упрочняется; при повторной вытяжке
пластические деформации уже выбраны,
напряжение![]() становится
новым искусственно поднятым пределом
текучести
становится
новым искусственно поднятым пределом
текучести![]() ;
;
холодным волочением - волочение через несколько последовательно уменьшающихся в диаметре отверстий в холодном состоянии для получения высокопрочной проволоки.
Высоколегированные
и термически упрочненные арматурные
стали переходят в пластическую стадию
постепенно без ярко выраженной площадки
текучести (рис. , б).
Для таких сталей устанавливают условный
предел текучести ![]() ,
при котором относительные остаточные
деформации составляют 0,2%.
,
при котором относительные остаточные
деформации составляют 0,2%.
К физическим свойствам сталей относятся:
пластические свойства – характеризуются относительным удлинением при испытании на разрыв. Снижение пластических свойств приводит к хрупкому (внезапному) разрыву арматуры;
свариваемость – характеризуется надежностью соединения, отсутствием трещин и других пороков металла в швах. Хорошо свариваются малоуглеродистые и низколегированные стали. Нельзя сваривать термически упрочненные и упрочненные вытяжкой стали, т.к. теряется эффект упрочнения;
хладноломкость - склонность к хрупкому разрушению при отрицательных температурах (ниже -30оС);
реологические свойства – характеризуются ползучестью и релаксацией;
усталостное разрушение – наблюдается при действии многократно повторяющейся знакопеременной нагрузке и имеет характер хрупкого разрушения;
динамическая прочность – наблюдается при кратковременных нагрузках большой интенсивности.
Назовите основные этапы развития сталеплавильного производства.
Первый этап − прямое получение железа из руды.
Второй этап − получение кричного (сварочного) железа из чугуна.
Третий этап − возникновение способа получения жидкой (литой) стали.
Четвертый этап − возникновение относительно простых и дешевых способов массового производства литого металла.
Пятый этап − возникновение электрометаллургии стали.
Шестой этап − интенсификация сталеплавильного процесса кислородом.
Седьмой этап − создание переплавных процессов.
Восьмой этап − развитие внепечной, вторичной или ковшевой металлургии.
Девятый этап — появление и развитие методов внепечной обработки (вторичной, или ковшовой, металлургии).
Десятый этап — разработка методов организации непрерывного сталеварения, поиски оптимальных конструкций сталеплавильных агрегатов непрерывного действия (САНДов).
Одиннадцатый этап —решение проблем обеспечения сталеплавильных агрегатов шихтой.
Двенадцатый этап — решение экологических проблем.
6. По каким основным признакам классифицируется сталь и способы ее получения?
Классификация.
Устанавливаются различные виды стали:
1) по видам обработки:
горячекатаная и кованая;
калиброванная;
круглая, со специальной отделкой поверхности (серебрянка);
2) по требованиям к испытанию механических свойств (пять категорий);
3) по состоянию материала:
без термической обработки;
термически обработанная;
нагартованная;
4) в зависимости от назначения:
для горячей обработки давлением;
для холодной механической обработки (обточки, строжки, фрезерования и т.д.); в)для холодного волочения.
Основным сырьем для получения стали служат передельный чугун, лом черных металлов и отходы производства.
Существует несколько способов получения стали: конверторный, мартеновский и электроплавка.
Конверторный способ основан на продувке сжатым воздухом расплавленного чугуна. При продувке кислород воздуха вступает в реакцию с примесями чугуна и окисляет их, в результате чего получается сталь. Для конверторного способа используют жидкий чугун, полученный в доменных печах и выдержанный в специальных металлоприемниках (миксерах).
Достоинствами конверторного способа являются: высокая производительность агрегатов, компактность оборудования и т. д.
К недостаткам этого способа относятся невозможность переработки большого количества стального и железного лома, а также передел чугунов только определенного химического состава.
Марки конверторной стали обозначают начальными буквами Б и Т, что значит бессемеровская и томасовская сталь.
Мартеновский способ вызван к жизни необходимостью перерабатывать стальной лом и отходы производства. Требовалось создать печь, в которой температура была бы настолько высокой, чтобы можно было плавить сталь и железо. Получение высокой температуры в мартеновской печи дало возможность не только использовать промышленные отходы в качестве шихтовых материалов, но и получать стали с весьма разнообразными свойствами. Мартеновская сталь поступает в виде листовой и сортовой, рельсов, отливок, заготовок для ковки и штамповки.
Плавка стали в электропечах дает возможность получать высококачественные стали. Сущность процесса заключается в очищении стали от шлаков и примесей в виде серы и фосфора.
Сера и фосфор в стали являются вредными примесями. Сера снижает литейные свойства, препятствует выходу газов из жидкой стали, вызывает ломкость. Фосфор снижает пластичность и вызывает хладноломкость (хрупкость) стали. Кремний повышает упругость и вязкость стали, марганец повышает износоустойчивость.
7. Что такое огнеупорность? В чем она выражается?
Огнеупорность. Этот показатель определяют стандартным методом: образец (обычно в виде усеченной трехгранной пирамидки) помещают в печь. По мере нагрева образец постепенно начинает деформироваться (без нагрузки, под действием собственной тяжести) и при определенной температуре (названа температурой огнеупорности) склоненная вершина образца касается основания печи. В зависимости от температуры огнеупорности изделия называют огнеупорными (1580-1770 °С), высокоогнеупорными (1770-2000 °С), высшей огнеупорности (>2000 °С).
В тех случаях, когда при эксплуатации данного огнеупора имеют место резкие колебания температуры (например, в сталеразливочных ковшах, камерах, куда попадает металл при обработке вакуумом, и т. д.), большое внимание уделяют такому показателю, как термостойкость, т. е. способность материала выдерживать без разрушения резкие колебания температуры. При испытании на термостойкость образец нагревают до 850 °С и охлаждают в воде, затем опять нагревают и охлаждают и т. д. Показатель термостойкости выражается числом водных теплосмен и колеблется в очень широких пределах (например, термостойкость обычного магнезита всего 1—3, магнезитохромита — до 40, а высоко-глиноземистых огнеупоров — более 150 теплосмен).
Дайте определение понятию «огнеупоры».
Огнеупорные материалы, используемые в сталеплавильном производстве, должны обладать высокой огнеупорностью, термостойкостью, устойчивостью против воздействия шлака и плавильной пыли, высокой механической прочностью при высоких температурах и т. п. Обычно огнеупорные материалы или изделия из них (кирпичи, блоки и т. п.) классифицируют по ряду признаков.
Огнеупорные материалы (огнеупоры) — это материалы, изготовляемые на основе минерального сырья и отличающиеся способностью сохранять без существенных нарушений свои функциональные свойства в разнообразных условиях службы при высоких температурах.
Применяются для проведения металлургических процессов(плавка, отжиг, обжиг, испарение и дистилляция), конструирования печей, высокотемпературных агрегатов (реакторы, двигатели, конструкционные элементы и др). Огнеупоры бывшие в употреблении называются огнеупорным ломом и используются в переработке.
Огнеупорные материалы отличаются повышенной прочностью при высоких температурах, химической инертностью. По составу огнеупорные материалы это керамические смеси тугоплавких оксидов, силикатов, карбидов, нитридов, боридов. В качестве огнеупорного материала применяется углерод (кокс, графит). В основном это неметаллические материалы, обладающие огнеупорностью не ниже 1580°C, применяются практически везде где требуется ведение какого-либо процесса при высоких температурах.
От чего зависит термостойкость огнеупорного материала? В чем она выражается?
Термическая стойкость.
Термической стойкостью называется способность огнеупоров не разрушаться при резких изменениях температуры. Это особенно важно для огнеупоров, работающих в печах периодического действия. Термическая стойкостьогнеупоров тем выше, чем больше коэффициент теплопроводности материала, его пористость и размер зерен и чем меньше температурный коэффициент линейного расширения, плотность, размеры изделия и изменения объемапри аллотропических превращениях.
Для определения термической стойкости используют образец в форме кирпича. образец нагревают 40 мин при 850°С, затем охлаждают 8—15 мин. Цикл нагрева и охлаждения называется теплосменой. Охлаждение может быть только на воздухе (воздушные теплосмены) или сначала в воде 3 мин, затем на воздухе 5— 10 мин (водяные теплосмены). Нагрев и охлаждение проводятся до тех пор, пока потеря массы образца (из-за откалывания кусков) не достигнет 20%. Термическая стойкость оценивается количеством выдержанных теплосмен.
Изделия, изготовленные полусухим прессованием, более термостойки, чем изделия пластической формовки.
От значения термостойкости зависит величина напряжений, возникающих в кладке при ее нагревании и особенно при резком изменении температуры в печи; в связи с этим температурные швы кладки делают с учетом линейного расширения огнеупорных изделий. Например, линейное расширение шамота при 800 °С равно 4,5·10-6°C-1X800°С·100% = 0,36%, т. е. 1 м шамотной кладки дает при этой температуре удлинение 3,6 мм.
10.Дайте определение понятию «металлургический шлак». Каким образом подбирают огнеупоры в зависимости от состава шлака?
Металлургические шлаки делятся на шлаки черной и цветной металлургии. К шлакам черной металлургии относятся доменные, ферросплавные, сталеплавильные; к шлакам цветной металлургии - медеплавильные, никелевые, полиметаллические.
Металлургические шлаки получаются при металлургических процессах, протекающих при высоких температурах. Состав металлургических шлаков зависит от химического состава руды, флюса и топлива. В основном они содержат окислы кремния, кальция и железа.
Технологические свойства металлургических шлаков определяются их основностью. Подобно тому как кислотность водных растворов определяют по ан, основность шлаков рационально оценивать по активности свободных ионов кислорода, которую в принципе можно измерять при помощи кислородных электродов, погруженных в расплавы.
11.Какие важнейшие свойства огнеупоров Вы знаете, кроме огнеупорности, термостойкости и шлакоустойчивости?
|
Пористость огнеупоров. Поры могут быть открытыми и закрытыми. Различают общую, кажущуюся и закрытую пористость. Общая пористость определяется как отношение объема всех пор к объему изделия. Кажущаяся пористость – как отношение открытых пор к объему изделия. Закрытая пористость – как отношение объема закрытых пор к объему изделия.
Механическая
прочностьпри комнатной температуре
характеризуется хрупким разрушением
при сжатии. В качестве показателя
используется предел прочности при
сжатии
|
|
Температура деформации под нагрузкойопределяется под нагрузкой 0,2 МПа. При этом отмечают температуру начала деформации (размягчения), 4 % и 40 % сжатие образца высотой 50 мм и диаметром 36 мм. Деформация под нагрузкой при высоких температурах определяется количеством образующейся жидкой фазы и ее распределением в образце. Температура 4 % деформации является по существу предельной температурой службы огнеупора, а 40 % деформации – температурой разрушения образца. |
|
Термостойкость– это способность огнеупоров выдерживать без разрушения резкие колебания температуры. Термостойкость характеризуется числом теплосмен, т.е. циклов нагрева и охлаждения. Различают водяные и воздушные теплосмены. При водяных теплосменах образец (кирпич 230x113x65 мм) нагревают до 1300oС, выдерживают его 10 мин при этой температуре, а затем охлаждают в проточной воде (5-25oС) в течение 5 мин. Эти циклы (теплосмены) продолжают до тех пор, пока образец не потеряет 20 % первоначальной массы. Большое влияние на термостойкость оказывает химико-минералогический состав и зерновой состав огнеупора. Термостойкость Тс1300– вода некоторых огнеупоров равна: динасовых – 1-2; шамотных – 10-25; высокоглиноземистых – 15-20; периклазовых – 1-2; периклазохромитовых – 5-20. При воздушных теплосменах кирпич нагреваю до 800oС и охлаждают в потоке компрессорного воздуха до потери 20 % массы. В настоящее время этот метод не используется. |
|
Химическая стойкость. До 70 % огнеупоров разрушается в результате взаимодействия со шлаком, металлом и газами. Наиболее сильное разрушающее воздействие оказывают шлаки. Разрушающее действие шлака носит сложный характер и оценить шлакоустойчивость огнеупора одим показателем сложно. Здесь сказывается состав огнеупора, его пористость, температура взаимодействия, гидродинамические условия. Как правило, основные огнеупоры хорошо противостоять основным шлакам. Кислые—кислым. Нейтральные – примерно одинаково противостоят и кислым, и основным шлакам. Постоянство объема. Сохранение постоянного объема – важная характеристика огнеупоров, потому что в этом случае в кладке не возникает дополнительных напряжений. Это особенно важно для сводов и арок. В действительности все огнеупоры во время службы в тепловых устройствах испытывают рост или усадку вследствие усадки материала или термического расширения. Дополнительную усадку или рост определяют по разности объемов образца, измеренных до и после обжига при заданной температуре по формуле
где V0 и V1 – объемы образца до и после обжига. Линейную усадку или рост определяют по формуле
Дополнительная усадка или рост не должны превышать в условиях службы 0,5-1,0 %.
Температурный
коэффициент линейного расширения
Зная
величину
Теплопроводность огнеупорных материалов зависит от составляющих фаз и характера их структуры и определяется той фазой, которая является сплошной средой. В общем случае она определяется формулой (Вт/м*К)
Аккумулирующая способность огнеупоров характеризует способность материала принимать при нагреве и отдавать при охлаждении теплоту. Она выражается формулой (Втxс0,5/м2xК)
Эта величина имеет большое значение при выборе огнеупоров, работающих в периодических условиях: футеровка печей, насадка регенератора и т.п. |
12 По каким признакам классифицируют огнеупоры?
Огнеупорные материалы бывают штучными изделиями (блоками) и неформованными. К последним относят наварочные материалы, мертели, засыпки и другие специальные набивные и формуемые массы, в том числе применяемые для производства огнеупорных бетонов и торкретирования.
Огнеупоры разделяют по следующим признакам:
формы и размеры
способу формования
огнеупорность
пористость
химико-минеральный состав
область применения
Классификация по формам и размерам
прямые и клиновые нормальных размеров, малого и большого форматов;
фасонные простые, сложные, особо сложные, крупноблочные, массой выше 60 кг
специальные: промышленного и лабораторного назначения (тигли, трубки и т.д.)
Классификация по способу формования
пиленые из естественных горных пород или из предварительно изготовленных блоков;
литые, изготовленные способом литья из жидкого шликера, пеношликера и т.д.;
пластичного формования, изготовленные из масс в пластичном состоянии машинной формовкой, с последующей допрессовкой;
полусухого формования из порошков;
плавленные литые из расплава, получаемого путём электроплавки;
термопластичнопрессованные;
горячепресованные;
Классификация по огнеупорности
огнеупорные (огнеупорность от 1580 до 1770 °C)
высокоогнеупорные (от 1770 до 2000 °C)
высшей огнеупорности (от 2000 °C до 3000 °C)
сверхогнеупорные (более 3000 °C)
Классификация по пористости
особоплотные (открытая пористость до 3 %)
высокоплотные (открытая пористость от 3 до 10 %)
плотные (открытая пористость от 10 до 16 %)
уплотненные (открытая пористость от 16 до 20 %)
среднеплотные (открытая пористость от 20 до 30 %)
низкоплотные (пористость от 30 % до 45 %)
высокопористые (общая пористость от 45 до 75 %)
ультрапористые (общая пористость более 75 %)
Классификация по химико-минеральному составу
Следует различать кислые, нейтральные и основные огнеупоры. Более детальная классификация производится по их химическому составу:
Кремнеземистые
Алюмосиликатные
Глиноземистые
Глиноземоизвестковые
Магнезиальные
Магнезиально-известковые
Известковые
Магнезиально-шпинелидные
Магнезиально-силикатные
Хромистые
Цирконистые
Оксидные
Углеродистые
Оксидоуглеродистые
Карбидкремниевые
Бескислородные
13 Какие основные компоненты необходимы для изготовления безобжиговых огнеупоров?
Безобжиговые огнеупоры формуют из смесей обожженного при высокой температуре огнеупорного порошка (магнезита, хромита, доломита) с неорганической или органической связкой без последующего обжига и затем прессуют под высоким давлением. Безобжиговые огнеупоры дешевле аналогичных обожженных и при использовании высокомощного прессового оборудования не уступают им по стойкости.
14.Какие огнеупоры применяют для футеровки сталеразливочных ковшей?
Высокоглиноземистых огнеупорных изделий является повышенное содержание Al2O3, которое превышает 45%. Огнеупорность высокоглиноземистых изделий составляет порядка 1750 °С и выше. В сумме с высокой температурой начала размягчения и повышенной химической стойкостью против кислых и щелочных расплавов позволяет использовать их в основных тепловых агрегатах металлургической промышленности.
15.Что понимают под процессом торкретирования?
ТОРКРЕТИРОВАНИЕ - процесс нанесения густой массы из огнеупорного материала на поверхность печи, ковша и других конструкций с помощью пневматического аппарата (торкрет-пушки).
ТОРЦЕВОЙ ЭФФЕКТ, концевой эффект - образование области плотного металла со стороны торцов отливки независимо от наличия прибыли. Длину зоны плотного металла называют дистанцией действия торца или дистанцией торцевого эффекта (рис.). Торцевой эффект увеличивается с увеличением продолжительности затвердевания отливки.
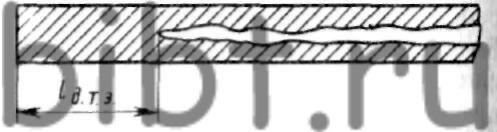
lд.т.эф - дистанция торцевого эффекта
ТОЧЕЧНАЯ ПРОБА - проба, взятая одновременно из определенной части не штучной продукции. Проба, состоящая из серии точечных проб, называется объединенной.
16 Дать определение термостойкости и шлакоустойчивости.
Это техническое свойство материала — его способность выдерживать термические напряжения не разрушаясь. Обычно её измеряют в количествах теплосмен, которое образец способен выдержать, потеряв не более 20 % своей массы.
Шлакоустойчивостью принято называть способность материала противостоять разрушающему химическому воздействию шлаков. Шлакоустойчивость характеризуют потерей массы материала при воздействии на него шлака в определенных условиях. Шлакоустойчивостью определяется долговечность обмуровки.
17 Чем отличается экзотермическая химическая реакция от эндотермической?
Эндотерми́ческие
реа́кции —
химические реакции, сопровождающиеся
поглощением теплоты. Для эндотермических
реакций изменение энтальпии и внутренней
энергии имеют
положительные значения (![]() ,
, ![]() ),
таким образом, продукты реакции содержат
больше энергии, чем исходные компоненты.
),
таким образом, продукты реакции содержат
больше энергии, чем исходные компоненты.
К эндотермическим реакциям относятся:
реакции восстановления металлов из оксидов,
электролиза (поглощается электрическая энергия),
электролитической диссоциации (например, растворение солей в воде),
ионизации,
фотосинтеза.
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Противоположнаэндотермической реакции.
Полное количество энергии в химической системе чрезвычайно трудно измерить или подсчитать. С другой стороны, изменениеэнтальпии ΔH в химической реакции гораздо легче измерить или сосчитать. Для этих целей используют калориметры. Измеренное значение ΔH соотносится с энергией связи молекул следующим образом:
ΔH = энергия, потраченная на разрыв связей (Энергия разрыва химической связи)— энергия, выделенная при образовании связей продуктов реакции.
Для экзотермических реакций эта формула даёт отрицательное значение для ΔH, так как большее значение вычитается из меньшего значения. При сгорании водорода, например:
2H2 + O2 → 2 H2O
изменение энтальпии равно ΔH = −483.6 кДж на один моль O2.
18.Чем отличается обратимая химическая реакция от необратимой? Приведите примеры той и другой реакций.
Обратимые и необратимые процессы, пути изменения состояния термодинамической системы. Процесс называют обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой. Обратимый процесс - идеализированный случай, достижимый лишь при бесконечно медленном изменении термодинамических параметров. Скорость установления равновесия должна быть больше, чем скорость рассматриваемого процесса. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы называют необратимым.
Необратимые
процессы могут протекать самопроизвольно
только в одном направлении;
таковы диффузия,теплопроводность,
вязкое течение и другое. Для химической
реакции применяют понятия термодинамической
и кинетической обратимости, которые
совпадают только в непосредственной
близости к состоянию равновесия. Р-ция
А + В ![]() С
+ D наз. кинетически обратимой или
двусторонней, если в данных условиях
продукты С и D могут реагировать друг с
другом с образованием исходных веществ
А и В. При этом скорости прямой и обратной
реакций, соотв.
С
+ D наз. кинетически обратимой или
двусторонней, если в данных условиях
продукты С и D могут реагировать друг с
другом с образованием исходных веществ
А и В. При этом скорости прямой и обратной
реакций, соотв. ![]()
![]() ,
где
,
где ![]() и
и ![]() -константы
скорости, [А], [В], [С], [D]-
текущиеконцентрации (активности),
с течением времени становятся равными
и наступает химическое
равновесие, в
котором
-константы
скорости, [А], [В], [С], [D]-
текущиеконцентрации (активности),
с течением времени становятся равными
и наступает химическое
равновесие, в
котором![]() -константа
равновесия, зависящая
от температуры. Кинетически необратимыми
(односторонними) являются обычно такие
реакции, в ходе которых хотя бы один из
продуктов удаляется из зоны реакции
(выпадает в осадок, улетучивается или
выделяется в виде малодиссоциированного
соединения), а также реакции, сопровождающиеся
выделением большого кол-ва тепла.
-константа
равновесия, зависящая
от температуры. Кинетически необратимыми
(односторонними) являются обычно такие
реакции, в ходе которых хотя бы один из
продуктов удаляется из зоны реакции
(выпадает в осадок, улетучивается или
выделяется в виде малодиссоциированного
соединения), а также реакции, сопровождающиеся
выделением большого кол-ва тепла.
На практике нередко встречаются системы, находящиеся в частичном равновесии, т.е. в равновесии по отношению к определенного рода процессам, тогда как в целом система неравновесна. Например, образец закаленной стали обладает пространственной неоднородностью и является системой, неравновесной по отношению к диффузионным процессам, однако в этом образце могут происходить равновесные циклы механической деформации, поскольку времена релаксации диффузии и деформации в твердых телах отличаются на десятки порядков. Следовательно, процессы с относительно большим временем релаксации являются кинетически заторможенными и могут не приниматься во внимание при термодинамич. анализе более быстрых процессов.
19.Сформулируйте закон распределения.
Жидкий металл и шлак в большинстве случаев являются двумя несмешивающимися жидкостями.
При внесении в систему металл — шлак примеси, она распределяется между этими фазами, процесс распределения характеризуется уравнением
[П] = (П).
В равновесных условиях отношение содержания примеси, распределенной между металлом и шлаком, будет величиной постоянной при данной температуре:
L = (П) / [П].
Это отношение L называется коэффициентом распределения.
Переход примеси из одной фазы в другую будет определяться соотношением химических потенциалов
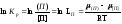 ,
,
где μ[ П ] и μ(П) - соответственно химические потенциалы металла и шлака.
Если химический потенциал примеси в шлаке окажется больше чем химический потенциал примеси в металле, т. е. при соотношении μ(П) > μ[П] примесь будет переходить из шлака в металл до тех пор, пока не установится равенство μ(П) = μ[П]. При соотношении μ(П) < μ[П] примесь будет переходить из, металла в шлак.
20.Перечислите основные функции шлака.
В процессе плавки шлак должен выполнять следующие основные функции:
удалять из металлической ванны вредные примеси (серу и фосфор);
создавать условия, обеспечивающие минимальные потери железа в виде оксидов FеО и Fе2O3 и механических примесей, представляющих собой частицы металла, в практике получивших название "корольки";
обеспечивать минимальное содержание неметаллических включений в стали.
21 Какие шлаки называются основными и кислыми?
Шлаки с основностью (CaO:SiO 2 ) выше 1,2 принято называть основными, ниже 1,1 – кислыми. Кислые и основные шлаки характеризуются различными физическими свойствами и, прежде всего, различной вязкостью при изменении температуры. Кислые шлаки при охлаждении застывают медленно и, проходя через тестообразное состояние, превращаются в стекловидную массу с блестящим изломом, если шлак был хорошо прогрет, или с раковистым загрязненным изломом при недостаточном прогреве шлака. Кислые шлаки в связи с медленным их застыванием принято называть длинными.
Основные шлаки, имеющие хорошую текучесть при высокой температуре, при охлаждении в очень узком интервале температур быстро превращаются в твердую массу, практически минуя тестообразное состояние. В изломе такие шлаки имеют тусклый светло-серый или белый с голубоватым оттенком цвет. Вследствие быстрого застывания основные шлаки принято называть короткими. Шлаки с основностью от 1,1 до 1,2 принято называть половинчатыми: в изломе одна часть поверхности такого шлака прозрачная стекловидная, а другая часть имеет белый матовый цвет.
22.От чего зависят физические свойства шлака?
Физические свойства шлаков определяются их составом и температурой. Входящие в состав шлака оксиды имеют следующую плотность, г/см3 (при комнатной температуре):
SiO2 =2,26; СаО=3,4; МgО =3,65; МnО =4,5; Fе2O3 =5,24; FеО =5,7. Соответственно плотность шлака практически определяется содержанием в нем «тяжелых» оксидов (FeO+Fe2O3+MnO).
Вязкость жидких сталеплавильных шлаков колеблется в пределах 0,02−0,8 Па∙с. Характер изменения вязкости с изменением температуры зависит от состава шлака и степени его однородности. Вязкость шлака и обратная ей величина — степень подвижности (жидкотекучесть) играют большую роль в процессах взаимодействия шлака и металла. Необходимо иметь в виду, что вязкость шлака существено выше, чем вязкость стали.
Теплоемкость шлаков в зависимости от состава и температуры изменяется в пределах 0,8−1,2 кДж/(кг∙К). Жидкие шлаки обладают электрической проводимостью. Процесс шлакообразования протекает во времени, определяемом скоростью процессов окисления примесей шихты (кремния, марганца, фосфора и т.д.) с образованием соответствующих оксидов, продолжительностью процессов прогрева и расплавления загруженных в конвертер материалов и т.д. Расход шлакообразующих материалов рассчитывают, исходя из состава шихтовых материалов, самих шлакообразующих и состава того шлака, который необходимо получить в процессе шлакообразования.
Скоростью шлакообразования называют скорость перехода всех составляющих в жидкий гомогенный раствор. Скорость шлакообразования зависит от температуры ванны, состава образующегося в начале плавки первичного шлака, интенсивности перемешивания ванны, размеров кусков шлакообразующих материалов, порядка их загрузки и т.п. Продолжительность собственно продувки в современном кислородном конвертере 14−20 мин, при этом на 1 т стали образуется 0,15 т шлака. Таким образом, в 100-т конвертере за короткое время образуется шлак массой несколько десятков тонн. В этом случае может оказаться, что операция плавки закончилась, а шлак необходимого состава сформироваться не успел. Это приведет к тому, что вредные примеси из металла будут удалены неполностью. Существуют различные способы ускорения шлакообразования. Так, стараются в самом начале плавки добиться получения шлака с высоким содержанием оксидов железа. Для этого фурму, через которую в конвертер поступает кислород, поднимают высоко над поверхностью ванны таким образом, чтобы кислородные струи "растекались" по поверхности металла. Вследствие этого железо интенсивно окисляется, быстро формируется железисто-известковый шлак и начинается удаление фосфора.
Перечислите основные реакции кислородно-конвертерного процесса.
25 Опишите механизм реакций окисления растворенного в металле углерода.
6.1. Окисление углерода
В чугуне содержится до 4,5% С, в стали содержание углерода должно быть 1,7−2%, поэтому процессы выплавки стали из чугуна всегда сопровождаются реакцией окисления углерода, которую часто называют основной реакцией этих процессов, или процессом обезуглероживания.
Процесс обезуглероживания состоит из трех основных этапов:
а) подвода к месту реакции реагентов – углерода и кислорода;
б) практически мгновенной реакции окисления углерода в основном до оксида углерода [С] +[О] = {СО} или [С] +2[О] = {СО2};
в) выделения продуктов реакции – пузырьков СО (или смеси {СО + СО2}) в газовую фазу.
СО в жидкой стали практически не растворяется, поэтому он непрерывно покидает реакционную зону, процесс идет в сторону уменьшения содержания углерода. Причем, чем выше температура процесса, тем быстрее идет окисление углерода.
Следует отметить, что окисление растворенного в металле углерода осуществляется по трем направлениям:
1) окисление углерода, растворенного в металле, кислородом, также растворенном в металле:
[C] + [O] = {CO};
2) при окислении оксидами железа шлака:
[C] + (FeO) = [Fе]+{СО} с поглощением тепла;
3) при окислении непосредственно кислородом:
[С] + 1/2O2 = {СО} с выделением тепла.
Следует помнить, что при окислении углерода газообразным кислородом выделяется большое количество тепла, при окислении же оксидами железа шлака тепло поглощается.
Пренебрежение этими закономерностями может привести к серьезным авариям.
Например, иногда в конвертер для ускорения обезуглероживания загружают в качестве окислителей слишком большое количество железной руды, окалины и т.п. Температура ванны при этом снижается, поскольку тепло расходуется; во-первых, на нагрев самих добавок, во-вторых, начавшаяся реакция [С] + (FеО) идет с поглощением тепла. В результате кипение ванны прекращается или резко замедляется. В этот период реакция [С] + [О] протекает "вяло", поэтому содержание кислорода в ванне резко возрастает. В дальнейшем по мере повышения температуры ванны (ванна "кипит") реакция [С] +[О] = {СО} интенсифицируется. С повышением температуры интенсифицируется также протекание реакции [С]+ (FеО) = {СО} + [Fе]. Если в ванне оказывается чрезмерно большое количество кислорода, эти реакции приобретают взрывной характер (в короткий период времени в виде пузырьков выделяется значительное количество СО), что приводит к выбросам из конвертера жидкого металла и шлака.
26.Перечислите реакции окисления растворенного в металле кремния.
6.2. Окисление кремния
С железом кремний сплавляется в любых соотношениях.
Окисление растворенного в металле кремния может происходить вследствие его взаимодействия:
1) с кислородом, растворенном в металле: [Si]+2[O] = (SiO2) с выдел.тепла;
2) с кислородом газовой фазы: [Si]+{О2}= (SiO2) с выдел.тепла;
3) с оксидами железа шлака: [Si] +2(FеО) = (SiO2) + 2[Fе] с выдел.тепла.
11.3. Окисление и восстановление кремния
Кремний растворяется в железе в любых соотношениях. При растворении выделяется заметное количество тепла. Изменение энергии Гиббса при растворении кремния (в области температур сталеплавильных процессов) составляет ΔGo = -131 800-17,32 Т. Для раствора кремния в железе характерно отрицательное отклонение от закона Рауля, что свидетельствует о наличии определенных связей между кремнием и железом. На диаграмме Fe-Si при 33 мас.% Si (50 ат.%) на линии ликвидуса наблюдается максимум. На кривых изменения вязкости и поверхностного натяжения о также наблюдается перелом при этих соотношениях содержания кремния и железа в сплаве. На основании этого можно заключить, что кремний присутствует в сплавах с железом в форме группировок, близких по составу к FeSi. Растворенный в железе кремний принято обозначать [Si].
11.3.1. Влияние температуры. Кремний—легко окисляющийся элемент. Окисление кремния, растворенного в металле, может происходить в результате его взаимодействия с кислородом:
а) растворенным в металле:
[Si] + 2[0] = (Si02),
ΔGo = -542 000 + 202,83 Т;
б) содержащимся в газовой фазе:
[Si] + 02(г) = (Si02),
ΔGo = -775 000 + 198,04Т;
в) содержащимся в оксидах железа шлака:
[Si] + 2(FeO) = (Si02) +2Fe ;
ΔGo =-29 900+98,04T
Во всех случаях при окислении кремния выделяется значительное количество тепла. При точных термодинамических расчетах необходимо учитывать также изменение энергии Гиббса растворения образующейся при окислении кремния SiO2 в шлаке конкретного состава. Из приведенных значений ΔGo следует, что окисление кремния может протекать интенсивно при наличии окислителя во всем интервале температур, характерном для сталеплавильных процессов.
11.3.2. Влияние состава шлака. В агрегатах с основными шлаками реакция окисления кремния протекает практически до конца, так как образующийся кремнезем взаимодействует с основными оксидами и активность SiO2 в основных шлаках ничтожно мала. Кислые шлаки, по крайней мере в конце плавки, насыщены кремнеземом. Активность кремнезема в кислых шлаках близка к единице (аSiО2~l). Если при работе под кислыми шлаками отсутствует интенсивный подвод окислителей (кислорода, воздуха, железной руды), то между насыщенным кремнеземом шлаком и компонентами расплава возможно взаимодействие:
(SiO2) + 2[Mn] = 2(MnO) + [Si],
ΔGo = 32 200 -132,807;
(SiO2) + 2[C] = 2COr+[Si],
ΔGo = 611300 -336,47Т.
Реакции эти идут с поглощением тепла. Значения ΔGo свидетельствуют о том, что протеканию реакций восстановления кремния способствуют высокие температуры. Кроме температуры на процесс восстановления кремния влияют составы металла и шлака. Влияние температуры для расплава, , тем
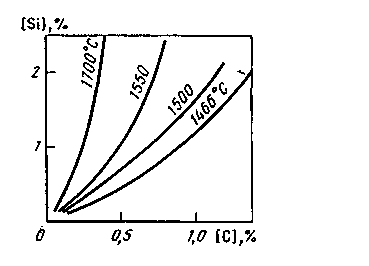
Рис. 11.5. Кривые равновесия реакции SiO2 + 2C ↔ Si + 2CO в расплавах Fe-C
шлака. Влияние температуры для расплава, содержащего кремний и углерод, показано на рис. 11.5. Константа равновесия реакции (SiO2) + 2Fеж = 2(FeO) + [Si] K =а2 (FeO)a[Si]/a(SiQ2); B насыщенных SiO2 шлаках a(SiQ2);=1 и К= а (FeO) * а[Si], откуда а[Si] = К/ а (FeO)
Чем ниже активность оксидов железа в шкале, тем дальше пойдет процесс восстановления кремния. Такие компоненты расплава, как углерод или марганец, понижают окисленность и металла, и шлака, повышая степень восстановления кремния. Основной оксид железа FeO в кислых шлаках связан с кремнеземом в силикаты железа, и его активность мала. Если в шлак ввести более сильный основный оксид, например СаО, то он разрушит силикаты железа, образуя силикаты кальция, и активность оксидов железа в шлаке возрастет, соответственно затормозится процесс восстановления кремния. Таким образом, можно считать, что процесс восстановления кремния из кислых шлаков идет по схеме
(SiO2) + 2Fex = 2(FeO) + [Si],
K =а2 (FeO)a[Si]/a(SiQ2)
а компоненты металла или шлака влияют на а (FeO) смещая равновесие в сторону восстановления или окисления кремния. Если в ванну интенсивно подают окислитель, то имеет место окисление железа, значение а (FeO) возрастает и в металле остаются лишь следы кремния.
27.Назовите реакции окисления растворенного в металле марганца.
