
- •Примеры типовых экзаменационных задач
- •Раздел 1. Термохимия
- •1.1. Примеры задач с решениями
- •1.2. Вопросы для самоподготовки
- •Раздел 2. Энтропия и энергия Гиббса
- •2.1. Примеры задач с решениями
- •2.2. Вопросы для самоподготовки
- •Раздел 3. Химическая кинетика
- •3.1. Примеры задач с решениями
- •3.2. Вопросы для самоподготовки
- •Раздел 4. Химическое равновесие
- •Вопросы для самоподготовки
- •Раздел 5. Способы выражения концентрации растворов
- •Раздел 6. Ионное произведение воды. Водородный показатель
Раздел 3. Химическая кинетика
3.1. Примеры задач с решениями
Задача 1. Для реакции
2NO(г) + Cl2(г) = 2NOCl(г)
экспериментальное кинетическое уравнение совпадает с математическим выражением закона действующих масс. Определите, во сколько раз увеличится скорость реакции при увеличении концентрации оксида азота (II) в три раза.
Решение
Кинетическим уравнением называют математическую зависимость скорости реакции от концентрации. Согласно закону действующих масс, скорость элементарной химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам. Кинетическое уравнение данной реакции
![]() .
.
Константа
скорости реакции k,
входящая в кинетическое уравнение, не
зависит от концентрации веществ.
Обозначим скорость реакции в системе
исходного состава
![]() .
Скорость реакции при повышении
концентрации оксида азота в три раза
.
Скорость реакции при повышении
концентрации оксида азота в три раза
![]()
Ответ: в 9 раз.
Задача 2. Рассчитайте, во сколько раз возрастает скорость реакции при повышении температуры от 20 до 50 0С ( = 3).
Решение
Согласно правилу Вант-Гоффа
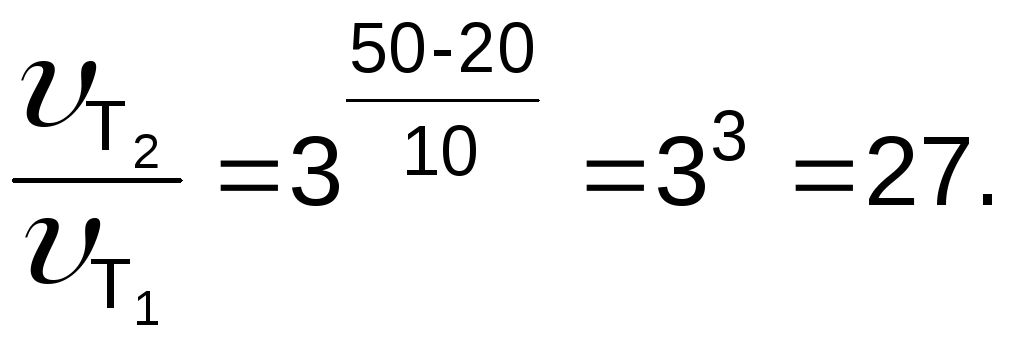
Ответ: в 27 раз.
Задача 3. Рассчитайте, во сколько раз увеличится продолжительность некоторой реакции при понижении температуры на 40 градусов ( = 2).
Решение
Продолжительность
и скорость реакции – обратно
пропорциональные величины. Обозначим
![]() и
и
![]() продолжительность
реакции при температуре Т2
и Т1
соответственно (Т2
<
Т1).
продолжительность
реакции при температуре Т2
и Т1
соответственно (Т2
<
Т1).

Ответ: в 16 раз.
3.2. Вопросы для самоподготовки
Запишите кинетическое уравнение элементарной реакции
2NO(г) + О2(г) = 2NO2(г)
и поясните смысл величин, входящих в кинетическое уравнение. Рассчитайте, как изменится скорость реакции при уменьшении концентрации NO в 2 раза.
Кинетическое уравнение реакции
4H2(г) + 2NO2(г) = 4H2O(г) + N2(г)
имеет
вид
![]() .
Рассчитайте, во сколько раз увеличится
скорость реакции при увеличении давления
в 2 раза.
.
Рассчитайте, во сколько раз увеличится
скорость реакции при увеличении давления
в 2 раза.
Раздел 4. Химическое равновесие
Задача 1. Запишите выражение константы равновесия системы
2ZnS(т)
+
3O2(г)
![]() 2ZnO(т)
+
2SO2(г)
2ZnO(т)
+
2SO2(г)
и поясните смысл входящих в него величин.
Решение
Данная система является гетерогенной, в выражение константы равновесия не включают концентрации твердых веществ
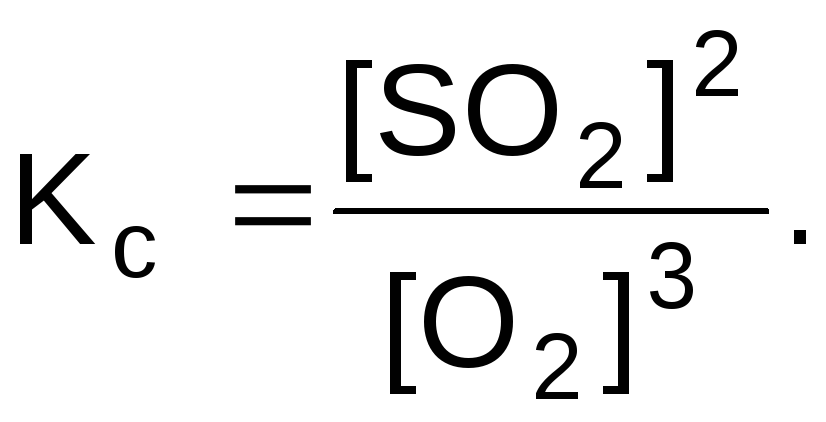
[SO2] и [O2] - равновесные молярные концентрации веществ, моль/л.
Задача 2. Определите направление смещения равновесия
CaCO3(т)
+
2H+(р)![]() Ca2+(р)
+
CO2(г)
+
H2O(ж)
Ca2+(р)
+
CO2(г)
+
H2O(ж)
при добавлении кислоты.
Решение
Добавление кислоты означает увеличение концентрации ионов водорода. Согласно принципу Ле Шателье равновесие смещается в сторону реакции, при которой концентрация ионов водорода понижается, т. е. в сторону прямой реакции.
Задача 3. Определите направление смещения равновесия в системе
2CO(г)
![]() СО2(г)
+ С(т)
, H0
= ‑ 171 кДж/моль
СО2(г)
+ С(т)
, H0
= ‑ 171 кДж/моль
а) при понижении температуры;
б) при понижении давления;
в) при уменьшении концентрации оксида углерода (II);
г) при увеличении концентрации оксида углерода (IV).
Решение
При понижении температуры равновесие смещается в сторону экзотермической реакции. В данном случае экзотермической является прямая реакция (H0), т.е. равновесие смещается в сторону продуктов реакции.
Изменение
общего давления в системе оказывает
влияние на смещение равновесия только
тех реакций, в результате которых
меняется количество газообразных
веществ. Понижение общего давления
приводит к смещению равновесия в сторону
реакции, идущей с образованием большего
количества газообразных веществ, т.е.
в сторону обратной реакции (слева в
уравнении реакции
![]() моль,
справа – 1 моль).
моль,
справа – 1 моль).
При уменьшении концентрации СО равновесие смещается в сторону реакции, идущей с образованием СО, т.е. в сторону обратной реакции.
При увеличении концентрации СО2 равновесие смещается в сторону реакции, при которой СО2 расходуется, т.е. в сторону обратной реакции.
Ответ: а) в сторону прямой реакции; б), в), г) в сторону обратной реакции.
Задача 4. Определите, как изменится константа равновесия
2SO2(г)
+
O2(г)
![]() 2SO3(г),
H0
2SO3(г),
H0
при повышении температуры.
Решение
Выражение константы равновесия
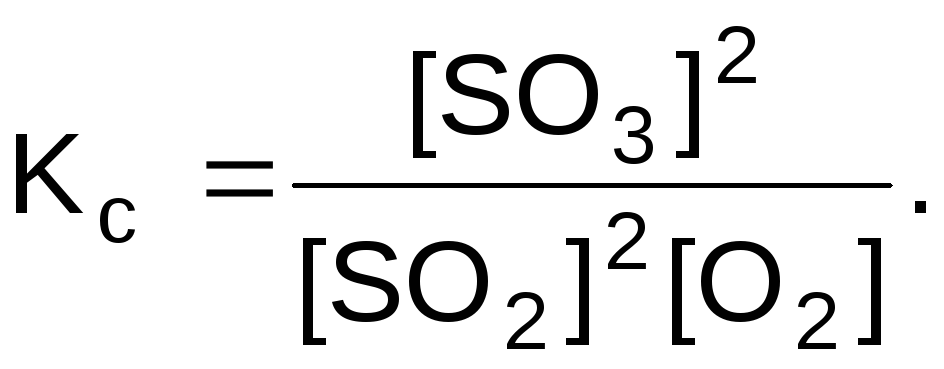
Прямая реакция экзотермическая, обратная – эндотермическая. При повышении температуры равновесие сместится в сторону обратной реакции, т.е. концентрации SO2 и O2 увеличатся, а концентрация SO3 уменьшится. Константа равновесия уменьшится.
Ответ: уменьшится.
Задача 5. Константа равновесия CaCO3(т)
 CaO(т)
+
CO2(г)
увеличивается с ростом температуры.
Укажите, как при этом будет меняться
равновесное парциальное давление CO2.
Ответ обоснуйте.
CaO(т)
+
CO2(г)
увеличивается с ростом температуры.
Укажите, как при этом будет меняться
равновесное парциальное давление CO2.
Ответ обоснуйте.
Решение
Выражение константы равновесия через равновесные парциальные давления веществ
![]()
С ростом температуры равновесное парциальное давление СО2 увеличивается.
Ответ: увеличивается.
