
- •Примеры типовых экзаменационных задач
- •Раздел 1. Термохимия
- •1.1. Примеры задач с решениями
- •1.2. Вопросы для самоподготовки
- •Раздел 2. Энтропия и энергия Гиббса
- •2.1. Примеры задач с решениями
- •2.2. Вопросы для самоподготовки
- •Раздел 3. Химическая кинетика
- •3.1. Примеры задач с решениями
- •3.2. Вопросы для самоподготовки
- •Раздел 4. Химическое равновесие
- •Вопросы для самоподготовки
- •Раздел 5. Способы выражения концентрации растворов
- •Раздел 6. Ионное произведение воды. Водородный показатель
1.2. Вопросы для самоподготовки
Укажите, что показывает величина DH0 для реакций (1) и (2): значение энтальпии реакции, значение энтальпии образования CaCO3(т) и FeO(к) соответственно или то и другое. Ответ обоснуйте.
1) CaO(т) + СO2(г) = CaCO3(т), DH0 = ‑180 кДж;
2) Fe(к) + 1/2O2(г) = FeO(к), DH0 = ‑272 кДж.
Укажите, какой из оксидов, Hg2О или K2О, разлагается на простые вещества при более высокой температуре, если энтальпии образования оксидов соответственно равны (кДж/моль): ‑91, ‑360.
Запишите термохимическое уравнение реакции, если известно, что при образовании 1 моль газообразной воды из простых веществ в стандартных условиях выделяется 242 кДж теплоты.
Рассчитайте значение
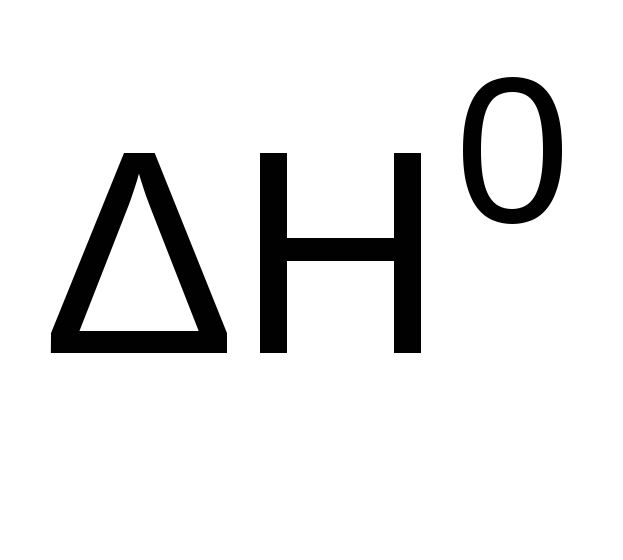 реакцииFe3O4(к)
+
C(к)
= 3FeO(к)
+ СO(г),
используя справочные данные, и укажите,
экзо- или эндотермической является
данная реакция.
реакцииFe3O4(к)
+
C(к)
= 3FeO(к)
+ СO(г),
используя справочные данные, и укажите,
экзо- или эндотермической является
данная реакция.Вещество
H0обр, кДж/моль
Fe3O4(к)
C(к)
FeO(к)
СO(г)
‑1117
0
‑263
‑111
Рассчитайте стандартную энтальпию образования метилового спирта CH3OH(ж), термохимическое уравнение реакции горения которого
CH3OH(ж) + 3/2O2(г) = CO2(г) + 2H2O(ж) , H0 = ‑726,5 кДж/моль.
Значения стандартных энтальпий образования веществ приведены в таблице.
-
Вещество
H0обр, кДж/моль
O2(г)
CO2(г)
H2O(ж)
0
‑393,5
‑285,8
Раздел 2. Энтропия и энергия Гиббса
2.1. Примеры задач с решениями
Задача 1. Не производя вычислений, укажите знак S следующих процессов:
а) 2NO(г) + O2(г) = 2NO2(г);
б) CO2(к) = CO2(г);
в) 2CH3OH(ж) + 3O2(г) = 2CO2(г) + 4H2O(ж).
Решение
В ходе реакций (а) и (в), сопровождающихся уменьшением количества газообразных веществ, энтропия уменьшается (S<0). Реакция (б) – процесс сублимации (твердое газ), энтропия увеличивается (S0).
Ответ: а) S0; б) S0; в) S0.
Задача 2. Оцените термодинамическую возможность прохождения реакции
CaO(т) + CO2(г) = CaCO3(т) в стандартных условиях.
Справочные данные приведены в таблице.
|
Вещество |
|
S0, Дж/(моль.К) |
|
|
CaO(т) CO2(г) CaCO3(т) |
‑ 635,2 ‑ 393,6 ‑ 1207,1 |
39,8 213,7 92,9 |
‑ 603,9 ‑ 395,5 ‑ 1129,0 |
Решение
Способ 1. Стандартная энергия Гиббса химической реакции
![]() .
.
Способ
2.
Значение стандартной энергии Гиббса
реакции рассчитываем по формуле
![]() ,
подставляя в нее значения
,
подставляя в нее значения![]() ,
,![]() и
и
![]() с учетом их размерностей.
с учетом их размерностей.
Стандартная энтальпия химической реакции
![]()
Стандартная энтропия химической реакции
![]()
![]() .
.
![]() ,
в стандартных условиях реакция
термодинамически возможна.
,
в стандартных условиях реакция
термодинамически возможна.
2.2. Вопросы для самоподготовки
Не проводя вычислений, обоснуйте, как изменяется энтропия системы в ходе реакций
4NH3 (г) + 3O2 (г) = 2N2 (г) + 6H2O (г);
2NO (г) + O2 (г) = 2NO2 (г);
C (т) + H2O (г) = CO (г) + H2 (г).
Рассчитайте по справочным данным значение DS0 реакции
С2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(г).
|
Вещество |
|
|
С2H4(г) O2(г) CO2(г) H2O(г) |
219,4 205,0 213,2 188,7 |
Рассчитайте значение G0 по справочным данным и оцените возможность самопроизвольного прохождения в стандартных условиях реакции
MgCO3(т) = MgO(т) + CO2(г).
|
Вещество |
G0обр, кДж/моль |
|
MgCO3(т) MgO(т) СО2(г) |
-1028 - 569 - 395 |
Рассчитайте значение
 реакции
реакции
CCl4(г) + 4HCl (г) = СH4(г) + 4Cl2(г) ,
если
известны значения
![]() = +434 кДж/моль и
= +434 кДж/моль и ![]() = - 117 Дж/(моль.К).
Оцените термодинамическую возможность
данной реакции в стандартных условиях.
= - 117 Дж/(моль.К).
Оцените термодинамическую возможность
данной реакции в стандартных условиях.
