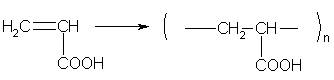- •Общая и биоорганическая химия учебное пособие
- •060101 Лечебное дело, 060103 Педиатрия,
- •060105 Медико-профилактическое дело, 060201 Стоматология.
- •Расчет концентрации растворов
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Показатели pH и pOh. Гидролиз солей. Метод нейтрализации.
- •Интервал перехода окраски некоторых индикаторов.
- •I. Кривая титрования сильной кислоты сильным основанием (и наоборот).
- •II. Кривая титрования слабой кислоты сильным основанием.
- •III. Кривая титрования слабого основания сильной кислотой.
- •IV. Кривая титрования слабого основания слабой кислотой.
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Окислительно-восстановительные реакции. Оксидиметрия
- •Классификация окислительно-восстановительных реакций
- •Направление протекания овр
- •Составление уравнений окислительно-восстановительных реакций
- •Методы оксидиметрии
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Химическая термодинамика
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Химическая кинетика. Химическое равновесие
- •Влияние природы реагирующих веществ
- •Влияние концентрации реагентов.
- •Влияние температуры.
- •Влияние катализатора
- •Химическое равновесие. Принцип Ле – Шателье
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Комплексные соединения. Комплексонометрия
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Теория растворов сильных электролитов
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Гетерогенные реакции в растворах электролитов
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Коллигативные свойства растворов
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Буферные системы. Кислотно-основное состояние
- •Расчет рН буферного раствора
- •Буферная емкость
- •Буферные системы крови
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Строение атома. Периодическая система. Химическая связь
- •Принципы заполнения орбиталей. Полная электронная формула элемента. Периодический закон д.И. Менделеева
- •Химическая связь
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •1) Числом нейтронов 2) массой атома 3) числом нуклонов 4) зарядом ядра
- •Биогенные элементы
- •Классификация биогенных элементов
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Электрохимия Электропроводность растворов электролитов
- •Факторы, влияющие на электропроводность растворов
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Равновесные электродные процессы. Электрохимические цепи
- •Классификация цепей
- •Электродные потенциалы
- •Классификация электродов
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Поверхностные явления. Адсорбция.
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Гидрофобные золи
- •Примеры решения задач:
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Свойства растворов высокомолекулярных соединений
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Спирты и фенолы
- •Методы получения спиртов
- •Методы получения фенола
- •Химические свойства спиртов
- •Химические свойства фенола
- •Пример решения задачи
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Методы получения аминов
- •Химические свойства аминов
- •Химические свойства анилина
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Альдегиды и кетоны
- •Методы получения альдегидов и кетонов
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Углеводы
- •Химические свойства моноз
- •Пример решения задачи
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Карбоновые кислоты и их функциональные производные
- •5. Окислительно-восстановительные реакции карбоновых кислот:
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Аминокислоты. Белки
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Гетероциклы
- •Классификация гетероциклических соединений
- •Пиридин
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Нуклеиновые кислоты
- •Структура днк.
- •Тестовые задания
- •Рекомендуемая литература Основная:
- •Дополнительная:
- •Расчет концентрации растворов Ответы на задачи для самостоятельного решения
- •Ответы на тестовые задания
- •Показатели pH и pOh. Гидролиз солей.
- •Ответы к тестовым заданиям
- •Окислительно-восстановительные реакции. Оксидиметрия
- •Ответы к тестовым заданиям
- •Химическая термодинамика
- •Ответы к тестовым заданиям
- •Химическая кинетика. Химическое равновесие
- •Ответы к тестовым заданиям
- •Ответы к тестовым заданиям
- •Теория растворов сильных электролитов
- •Ответы к тестовым заданиям
- •Гетерогенные реакции в растворах электролитов
- •Коллигативные свойства растворов
- •Ответы к тестовым заданиям
- •Ответы к тестовым заданиям
- •Поверхностные явления. Адсорбция.
- •Ответы к тестовым заданиям
- •Гидрофобные золи
- •Ответы к тестовым заданиям
Карбоновые кислоты и их функциональные производные
Органические соединения, содержащие карбоксильную группу –СООН, относятся к классу кислот.
Биологически важные карбоновые кислоты:
|
Кислоты (тривиальное название) |
Название аниона |
Формула кислоты |
|
Одноосновные |
|
|
|
муравьиная |
формиат |
HCOOH |
|
уксусная |
ацетат |
CH3COOH |
|
масляная |
бутират |
CH3(CH2)2COOH |
|
валериановая |
валерат |
CH3(CH2)3COOH |
|
Непредельные кислоты |
|
|
|
акриловая |
акрилаты |
СН2 = СН- СООН |
|
кротоновая |
кротонат |
СН3 – СН = СН - СООН |
|
Ароматические |
|
|
|
бензойная |
бензоат |
C6H5COOH |
|
Дикарбоновые кислоты |
|
|
|
щавелевая кислота |
оксалаты |
НООС - СООН |
|
малоновая |
малонаты |
НООС-СН2 - СООН |
|
янтарная |
сукцинаты |
НООС-СН2 – СН2 -СООН |
|
глутаровая |
глутараты |
НООС –(СН2)3 - СООН |
|
Непредельные дикарбоновые |
|
|
|
Фумаровая (транс-изомер) |
фумараты |
НООС-СН=СН-СООН |
Кислотные свойства карбоновых кислот:
RCOOH
![]() RCOO-
+ Н+
RCOO-
+ Н+
При диссоциации образуется карбоксилат анион, в котором отрицательный заряд равномерно распределяется между кислородными атомами, что увеличивает стабильность этой частицы. Сила карбоновых кислот зависит от длины радикала (чем больше радикал, тем слабее кислота) и заместителей (электроноакцепторные заместители усиливают кислотность). CI3COOH намного сильнее СН3СООН. Дикарбоновые кислоты сильнее одноосновных.
Функциональные производные карбоновых кислот:
Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.
1. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот. Они реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот:
2RCOOH + Мg → (RCOO)2Mg + Н2,
2RCOOH + СаО → (RCOO)2Ca + Н2О,
RCOOH + NaOH → RCOONa + Н2О,
RCOOH + NaHCO3→ RCOONa + Н2О + СО2↑.
Карбоновые кислоты — слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей:
CH3COONa + HCl → СН3СООН + NaCl.
Соли карбоновых кислот в водных растворах гидролизованы:
СН3СООК
+ Н2О
![]() СН3СООН
+ КОН.
СН3СООН
+ КОН.
Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных.
2. Образование функциональных производных карбоновых кислот. При замещении группы ОН в карбоновых кислотах различными группами (X) образуются функциональные производные кислот, имеющие общую формулу R—СО—X; здесь R означает алкильную либо арильную группу. Хотя нитрилы имеют другую общую формулу (R—CN), обычно их также рассматривают как производные карбоновых кислот, поскольку они могут быть получены из этих кислот.
Хлорангидриды получают действием хлорида фосфора (V) на кислоты:
R-CO-OH + РСl 5 → R-CO-Cl + РОСl3 + HCl.
Ангидриды образуются из карбоновых кислот при действии водоотнимающих средств:
2R-CO-OH + Р2О5 → (R-CO-)2O + 2НРО3.
Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации):
![]()
Сложные эфиры можно также получить при взаимодействии хлорангидридов кислот и алкоголятов щелочных металлов:
R-CO-Cl + Na-O-R' → R-CO-OR' + NaCl.
Амиды образуются реакцией хлорангидридов карбоновых кислот с аммиаком :
СН3-СО-Сl + NН3 → СН3-СО-NН2 + HCl.
Кроме того, амиды могут быть получены при нагревании аммонийных солей карбоновых кислот: to
CH3-COONH4 → CH3-CO-NH2 + Н2О
При нагревании амидов в присутствии водоотнимающих средств они дегидратируются с образованием нитрилов:
p2o5
CH3-CO-NH2 → CH3-C≡N + Н2О
3. Cвойства карбоновых кислот, обусловленные наличием углеводородного радикала. Так, при действии галогенов на кислоты в присутствии красного фосфора образуются галогензамещенные кислоты, причем на галоген замещается атом водорода при соседнем с карбоксильной группой атоме углерода (α-атоме ): ркр.
СН3-СН2-СООН + Вr2 → СН3-СНВr-СООН + НВr
Непредельные карбоновые кислоты способны к реакциям присоединения:
СН2=СН-СООН + Н2 → СН3-СН2-СООН,
СН2=СН-СООН + Сl2 → СН2Сl-СНСl-СООН,
СН2=СН-СООН + HCl → СН2Сl-СН2-СООН,
СН2=СН-СООН + Н2O → НО-СН2-СН2-СООН,
Две последние реакции протекают против правила Марковникова.
Непредельные карбоновые кислоты и их производные способны к реакциям полимеризации.