
- •6. Хімічна кінетика
- •7. Хімічна рівновага
- •У посудині об’ємом 0,2 л помістили 0,3 г н2о та 0,8 г йоду. Після встановлення рівноваги в посудині одержано 0,7 г hi. Визначити константу рівноваги реакції.
- •У реакторі об’ємом 0,5 л відбувається реакція
- •8. Склад і приготування розчинів
- •100 Г розчину - 4,5 г NaOh;
- •220,5 Г розчину - х г NaOh;
- •9. Розчини неелектролітів
- •10. Розчини електролітів. Визначення pН розчинів. Добуток розчинності
7. Хімічна рівновага
Коли швидкості прямої та зворотної реакцій (для оборотних реакцій) стають однаковими, наступає стан хімічної рівноваги.
Для оборотної хімічної реакції аA + bB ↔ cC + dD
КС =![]() ,
,
де КС− константа рівноваги реакції; величина, що виражає співвідношення між рівноважними концентраціями (моль/л) продуктів реакції [С], [D] (чисельник) та концентраціями вихідних речовин [А], [В] (знаменник). Чим більша константа рівноваги, тим більший вихід продуктів реакції.КСстала при даній температурі.
Для реакцій, що відбуваються у газовій фазі, замість молярних концентрацій компонентів іноді використовують парціальний тиск
КР
=
 .
.
Парціальний тиск кожного компонента суміші розраховується за формулою Рі = РХі, де Р − загальний тиск суміші газів, Хі − мольна частка і-го газу; Хі = nі/∑nі, деnі− кількість молів кожного газу; ∑nі− загальна кількість молів у системі. МіжКСіКРіснує співвідношення
КР=КС[RT]∆n,
де ∆n− зміна кількості молів у хімічному процесі; якщо ∆n= 0, тоКР =КС. Константа рівноваги хімічної реакції пов’язана зі стандартною зміною енергії Гіббса рівняннямDG0 = −2,3 RTlgKР.
При зміні умов перебігу реакції (температури, тиску, концентрації) швидкості прямого й зворотного процесів змінюються неоднаково і хімічна рівновага порушується. Реакція відбувається в одному з можливих напрямків до встановлення нового стану хімічної рівноваги. Процес переходу з одного стану хімічної рівноваги до іншого називається зміщенням хімічної рівноваги. Напрямок цього зміщення підлягає принципу Ле Шательє: якщо на систему, що знаходиться у стані хімічної рівноваги, відбувається який-небудь вплив, то рівновага зміщується в такому напрямку, щоб цей вплив послабити.Так, підвищення температури призводить до зміщення рівноваги в бік ендотермічної реакції (з поглинанням теплоти); підвищення тиску зміщує рівновагу в бік зменшення загальної кількості молів газоподібних речовин; видалення із системи одного з продуктів реакції підсилює пряму реакцію; зменшення концентрації однієї з реагуючих речовин зміщує рівновагу в напрямку зворотної реакції.
Приклад.У процесі синтезу амоніакуN2 + 3H2 ↔ 2NH3 рівновага встановилась при наступних концентраціях (моль/л) реагуючих речовин:СNН3= 3,6;CN2=2,5;CH2=1,8. Розрахувати константу рівноваги цієї реакції і вихідні концентрації азоту та водню.
Розв’язання
1. Константа рівноваги КС − ?
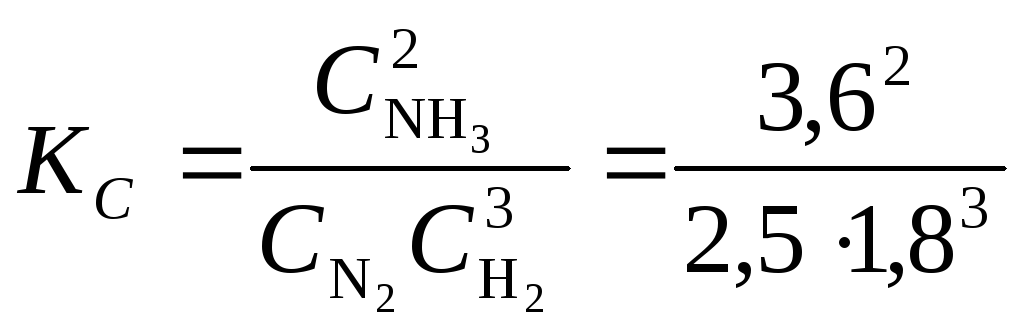 =
0,89.
=
0,89.
2. CN2 вих− ? CH2 вих− ?
Вихідні концентрації азоту та водню визначаємо, виходячи з рівняння реакції. На утворення двох молів NH3 необхіднийодин моль H2, а на утворення 3,6 моля NH3 необхідно 3,6/2 =1,8 моля H2.
Враховуючи рівноважну концентрацію азоту, знаходимо його вихідну концентрацію CN2 вих= 2,5 + 1,8 = 4,3 моль/л.
На утворення двох молів NH3 необхідно три молі H2, а на утворення 3,6 моля NH3 необхідно 3∙3,6/2 = 5,4 моля H2. CH2 вих= 1,8 + 5,4 = 7,2 моль/л.
Відповідь: KC = 0,89; CH2 вих= 7,2 моль/л; CN2 вих= 4,3 моль/л.
Задачі
Реакція CO+Cl2↔COCl2 відбувається в об’ємі 10 л. Склад рівноважної суміші: 14 г СО; 35,5 гCO; 49,5 г COCl2. Розрахувати константу рівноваги реакції.
Карбон (IV)оксид та хлор містяться в закритій посудині при сталій температурі. Їх вихідні концентрації дорівнюють 1 моль/л, тиск у посудині 101325 Па.Урезультаті реакціїCO + Cl2 ↔ COCl2 намомент рівноваги залишилось 50 % СО. Який тиск у посудині при рівновазі? Розрахувати константу рівноваги реакції.
Як необхідно змінити концентрацію, тиск та температуру гомогенної системиPCl5↔PCl3+Cl2;DН0реак = 129,7 кДж, щоб змістити рівновагу в бік розкладанняPCl5? РозрахуватиDG0реак та константу рівноваги реакції, якщоS0(РСl5) = 362,7 Дж/(моль·К);S0(РСl3) = 311,7 Дж/(моль·К);S0(РСl2) = 222,9 Дж/(моль·К).
Визначити константу рівноваги оборотної реакції A + 2B↔ C, якщо рівноважні концентрації складають:[А]= 0,3 моль/л;[В]= 1,1 моль/л;[С] = 2,1 моль/л. РозрахуватиDG0 реакції.
Визначити константу рівноваги реакції A+ 2B↔C, якщо рівноважні концентрації складають: [А] = 0,12 моль/л; [В] = 0,24 моль/л; [С] = 0,255 моль/л. РозрахуватиDG0 реакції.
При деякій температурі рівновага в системі 2NO2(г.)↔2NO(г.)+ O2(г.) установилася при таких концентраціях:[NO2]= 0,06 моль/л;[NO]= 0,24 моль/л;[O2]= 0,12 моль/л.Знайти вихідну концентраціюNO2 таКС. Які фактори сприяють зміщенню рівноваги в бік утворення NO2?
PCl5дисоціює при нагріванні за рівняннямPCl5↔PCl3+Cl2. Визначити константу рівноваги цієї реакції, якщо з трьох молівPCl5, що містяться в посудині об’ємом 10 л, розкладаються 2,5 моля.
Сульфур (VI) оксид утворюється за рівнянням
SO2(г.) + 0,5O2(г.) ↔ SO3(г.); DН0реак = −96,2 кДж/моль. Зміна яких парамет-рів буде сприяти зміщенню рівноваги в бік утворення SO3? Розрахувати DG0 реакції та константу її рівноваги, якщо S0(О2) = 248,1 Дж/(моль·К); S0(SO2) = 205,0 Дж/(моль·К); S0(SO3) = 256,7 Дж/(моль·К).
