
- •3.2. Хімічний звязок
- •3.3. Міжмолекулярні взаємодії
- •Питання і задачі
- •3.4.Комплексні сполуки
- •Питання і задачі
- •Розділ 4. Загальні закономірності хімічних процесів
- •4.1. Термохімія і елементи хімічної термодинаміки
- •Ентропія. Другий закон термодинаміки
- •4.2. Хімічна кінетика
- •Вплив каталізатора
- •Питання і задачі
- •4.3. Хімічна рівновага
- •Питання і задачі
3.2. Хімічний звязок
Поняття про хімічний зв’язок є одним з основних у сучасній хімії. Хімічний зв’язок – це взаємодія атомів, яка зумовлена перекриванням їх електронних хмар і яка супроводжується зменшенням загальної енергії системи (молекули, кристала).
Експериментальні дані свідчать, що існують три основних типи хімічних зв’язків – ковалентний, іонний та металічний, кожний з яких має певні характеристики.
Ковалентний звязок
Ковалентний зв’язок є універсальним та найпоширеним типом хімічного зв’язку, характерним для неорганічних та органічних сполук.
Сучасні погляди на утворення ковалентного звязку базуються на теорії Льюіса–Ленгмюра, згідно за якою ковалентний зв’язок виникає в результатї утворення однієї або деількох спільних електроних пар (усуспільнення електронів), що призводить до утворення атомами стійких електронних конфігурацій s2 або s2p6. Це усуспільнення може відбуватися за обмінним і донорно–акцепторним механізмом.
При реалізації обмінного механізму кожний з взаємодіючих атомів віддає на утворення звязку певну кількість електронів:
 Н
.
+ .
Н
Н :
Н, або Н – Н (оболонка 1s2)
Н
.
+ .
Н
Н :
Н, або Н – Н (оболонка 1s2)
CІ . + . СІ СІ :СІ, або СІ – СІ (оболонка 2s22p6)
О: + :О О : : О, або О = О (оболонка 2s22p6)
.N: + :N. N : : : N або N N (оболонка 2s22p6)
Аналогічно можуть бути зображені інші взаємодії між атомами.
Ковалентний зв’язок може також виникати, коли один з атомів має вільну електронну орбіталь, яка заповнюється неподільною електронною парою другого атома. Такий механізм утворення називається донорно–акцепторним (дативним, координаційним) і відповідно таку ж назву має і звязок. Частинка, яка віддає електрони у спільне користування називається донором, а атом чи молекула, яка приймає електронну пару називається акцептором. Ций механізм утворення ковалентного зв’язку відбувається, наприклад, у іоні амонію:
 Н
Н +
Н
Н +
Н – N: + Н+ Н – N – Н
Н Н
В молекулі амоніаку Нітроген має неподільну пару електронів, у іоні Гідрогену є вакантна орбіталь. Отже, при наближенні цих частинок електронна пара притягує до себе протон і становиться спільною для обох атомів. В утворенному іоні аммонію всі чотири зв’язки рівноцінні і не розрізняються один від одного незважаючи на те, що механізми їх утворення різні. Заряд протона, який приєднався до молекули амоніаку делокалізований між всіма атомами.
Існують два види перекривання електронних хмар. При взаємодії s-s –, s-p –, p-p–, та ін. орбіталей найбільше перекривання може відбуватися по лінії, яка звязує центри атомів. Такий звязок називається -звязком. При взаємодії p-p–, p-d–, та ін. орбіталей область перекривання може розташовуватися в стороні від лінії, яка сполучає центри атомів. Такий звязок називається -звязком.
-звязок -звязок
Рис. 1. Приклади - та -звязків
Кількісні характеристики хімічного зв’язку
Хімічний зв’язок характеризується, насамперед, енергією і довжиною. Якщо молекула складається з більше ніж двох атомів з ковалентним звязком між ними, до цих параметрів додається ще валентний кут.
Енергією зв’язку називається енергія, яка поглинається при розриві або виділяється при утворенні зв’язку між атомами. Ця енергія є мірою його міцності. Вона визначається з термодинамічних характеристик (теплоти утворення з атомів).
Для молекул з різними звязками найчастіше використовується так звана "середня енергія звязку" – енергія, яка необхідна для розриву звязків при умові, що всі вони в молекулі розриваються одночасно. Вона визначається з термохімічних вимірювань та з спектральних даних і наводиться у довідкових таблицях.
Довжиною зв’язку називається відстань між двома центрами ядер атомів в молекулі, коли сили відштовхування зрівноважені силами притягування і енергія зв’язку мінімальна. Наприклад, довжина зв’язку в молекулі метана дорівнює 0,154 нм, в молекулі води 0,096 нм.
В

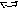 алентним
кутом
називається кут між двома вісями
симетрії електроних орбіталей одного
атома при утворенні ними з орбіталями
іншого атома ковалентного зв’язку.
Наприклад у молекулах води валентний
кут
дорівнює 104,5о:
О
алентним
кутом
називається кут між двома вісями
симетрії електроних орбіталей одного
атома при утворенні ними з орбіталями
іншого атома ковалентного зв’язку.
Наприклад у молекулах води валентний
кут
дорівнює 104,5о:
О
Н Н
Властивості ковалентного звязку
Ковалентний звязок має ряд важливих властивостей, до яких відносяться насиченність і напрямленість.
Напрямленністю називається закономірний напрямок взаємодії електронних орбіталей у просторі у бік найбільшого перекривання електронної густини при утворенні зв’язку. Напрямленність і валентний кут взаємно пов’язані величини і залежать від природи реагуючих атомів, типу електронних орбіталей, які утворюють зв’язок, розмірів атомів і величин зарядів на них.
Ця властивість визначає геометричну конфігурацію молекул.
Насиченість проявляється у здатності атомів утворювати певну кількість ковалентних звязків. Це повязано з тим, що одна орбіталь може приймати участь в утворенні тільки одного ковалентного звязку. Така властивість визначає склад молекулярних хімічних сполук. Наприклад, при взаємодії атомів водню утворюється молекула Н2, а не Н3, тому що спін електрона третього атома обовязково буде паралельним спіну одного з спарених електронів. Здатність до утворення певної кількості звязків обмежується отриманням максимального числа неспарених електронів.
Для пояснення природи і причин ковалентного зв’язку використовують наближені методи. Найбільше значення мають два з них – метод валентних зв’язків (МВЗ) і метод молекулярних орбіталей (ММО).
Метод валентних зв’язків
Метод був розроблений на основі квантово–механічних розрахунків молекули водню В. Гейтлером і Ф. Лондоном у 1928 році. Потім значний вклад в йього розвиток внести Л. Полінг і Д. Слейтер. Основні положення методу такі:
1. Молекула побудована з атомів, які в деякій ступені зберігають свою індивідуальність. В утворенні звязку беруть участь тільки електрони зовнішньої оболонки (валентні електрони).
2. З точкі зору квантової механіки при утворенні хімічного звязку між атомами їх електронні орбіталі перекриваються. Як показали розрахунки, це можливо, якщо взаємодіють атоми, електрони яких мають антипаралельні спіни – при цьому збільшується максимум електронної густини (15...20 %), який зконцентрований між двома атомами, що призводить до зменшення загальної енергії системи. Якщо наближуються атоми, електрони яких мають паралельні спіни, максимум густини утворюється за ядрами атомів і зв’язку не виникає. Таким чином, в основі МВЗ лежить утворення двохелектронного двохцентрового звязку.
Між атомами, що утворюють звязок, діють два типи сил: сили відштовхування між електронами і ядрами і сили притягання між протонами і електронами. Спочатку, на великих відстанях, при безкінечно великій відстані r, енергія взаємодії Е = 0, тобто частинки не взаємодіють. При зменшенні r енергія монотонно знижується до тих пір, доки не буде досягнутий мінімум Е0 на відстані r0, коли сили притягання і відштовхування зрівноважуються і енергія системи буде мінімальною. При подальшому зближенні сили відштовхування різко зростають і з ними зростає потенційна енергія.
3. Ковалентний зв’язок напрямлений у бік найбільшого перекривання електронних хмар атомів, які взаємодіють.
В методі ВЗ вaлентність елемента визначається числом неспарених електронів і атомів в нормальному або збудженому стані, які розташовані на валентній оболонці. Це так звана спінова валентність, або валентність по Гейтлеру та Лондону.
Число ковалентних зв’язків, які утворює атом, називається ковалентністю. В загальному випадку ковалентність визначається кількістю електронних орбіталей, які приймають участь в утворенні ковалентного звязку.
Теорія гибридізації
Дуже часто атом утворює зв’язки за рахунок електронів різних енергетичних станів, що повинно призводити до утворення нерівноцінних звязків. Але дослід показує, що такі зв’язки рівноцінні. Наприклад, атом Ве у збудженому стані утворює два рівноцінних зв’язки своїми s- та р-електронами:
 [Be]
= 1s22s2
[Be*] = 1s22s12p1
[Be]
= 1s22s2
[Be*] = 1s22s12p1
Рівноцінність хімічних зв’язків можна пояснити, використовуючи уявлення про гібридізацію, теоретичні основі якої запропонував Полінг. Гібридізацією називається квантово-механічне змішування певної кількості вихідних атомних орбіталей одного атома з різними енергіями, формами і розташуванням у просторі, що призводить до утворення тієї ж кількості орбіталей однакової форми і енергії, симетрично розташованих у просторі. Отже, при гібридізації зовнішних орбіталей відбувається іх змішування і вирівнювання за формою і енергією. Гібридізація енергетично вигідна, тому що енергія, яка витрачається при перерозподілі електронної густини атома компенсується утворенням більш міцних звязків.
Розглянемо деякі типи гібридізації.
sp- гібридізація
Комбінація двох орбіталей s і р призводить до утворення двох гібридних хмар, розташованих під кутом 180. Це зумовлює лінійну конфігурацію мо-лекул. Наприклад, при утворенні молекули ВеСІ2 відбувається sp-гібридізація атома Ве і молекула має лінійну конфігурацію:
s-орбіталь p -орбіталь гібридізована sp-орбіталь
Рис. 2. sp-гібридізація
Аналогічно можно вважати, що у Бора при збудженні відбувається гібридізація одного s- і двох р-електронів – sр2-гібридізація. Ці орбіталі розташовані у одній площині під кутом 120. Очевидно, що й зв’язки у молекулах теж будуть так орієнтовані, тобто молекула має форму трикутника. Така гібридізація спостерігається, наприклад, при утворенні молекули ВН3.
Рис. 3. sp2-гібридізація та sp3-гібридізація
Коли відбувається гібридізація одної орбіталі і трьох р-орбіталей, виникає sр3-гібридізовані хмари, які мають тетраедричну конфігурацію (кут складає 10929). Такий стан реалізується в молекулі метана.
При утворенні гібридних орбіталей починаючи з третього періода можуть приймати участь d-електрони. При цьому утворюються різні, більш складні стереохімічні конфігурації. Серед них найбільш поширені sp3d2 (октаедрична конфігурація) та sp3d (пірамідальна конфігурація).
Отже, теорія гідбидізації дозволила пояснити рівноцінність звязків в молекулах, їх розташування у просторі і геометричну конфігурацію молекул.
Локалізований і нелокалізований звязок
До цього часу ми розглядали молекули, у яких атом зв'язаний з іншими атомами одною чи декількома електронними парами (в останньому випадку зв'язок називається кратним). Таким чином, електронні пари, що забезпечують зв'язок, локалізовані в просторі між двома ядрами атомів. Такий хімічний зв'язок вважають локалізованим. Дослідження властивостей - і -зв'язків показало, що завжди локалізованими є тільки -зв'язки.
У -зв'язках може мати місце делокалізація і хімічний зв'язок, при якій спільна електронна пара одночасно належить більш ніж двом атомним ядрам називають делокалізованим. Делокалізація електронних пар спостерігається в молекулах багатьох органічних і неорганічних сполук (молекулах бензолу, НNO3, іонах NO3-, З32-, SO42-, Р043- і ін.). Як приклад розглянемо будову іона СО32-. Центральний атом утворює у даному випадку три однакових -зв'язки з трьома кисневими атомами за рахунок своїх валентних неспарених електронів на гібридних sp2-орбіталях. За рахунок четвертого неспареного електрона на р-орбіталі атом Карбону утворює з одним з атомів кисню -зв'язок.
 Така
структура СО32-
з локалізованим -зв'язком
суперечить експеримен-тальним даним,
що показують, що всі зв'язки С–О рівноцінні
(характеризуються рівною довжиною й
енергією). Для пояснення цього протиріччя
в методі валентних зв'язків було введене
представлення про так звані резонансні
структури, у яких цей зв'язок делокализован
по всіх трьох атомах кисню. Делокалізацию
зображують пунктирними лініями:
Така
структура СО32-
з локалізованим -зв'язком
суперечить експеримен-тальним даним,
що показують, що всі зв'язки С–О рівноцінні
(характеризуються рівною довжиною й
енергією). Для пояснення цього протиріччя
в методі валентних зв'язків було введене
представлення про так звані резонансні
структури, у яких цей зв'язок делокализован
по всіх трьох атомах кисню. Делокалізацию
зображують пунктирними лініями:
О О 2–
С
О
За допомогою теорії резонансу метод валентних зв'язків добре описує структуру багатьох складних молекул. Однак громіздкість математичного апарата не дозволяє його широко використовувати.
Полярність молекул і звязків
Якщо зв’язок складається з атомів однакових елементів, то спільна електронна хмара розподіляється у просторі симетрично відносно ядер обох атомів. Такий ковалентний зв’язок називається неполярним або гомеополярним, наприклад, Н – Н, Сl – Cl. Але у випадку утворення зв’язку атомами різних елементів виникає асиметрія в розподілі заряду і утворюється гетерополярний зв’язок, наприклад, Н – Сl .
Полярністю зв’язку називається наявність електричних зарядів на атомах внаслідок асиметричного розподілу електронної густини між ними. Поляризацією називається зміщення електронної густини і ядер атомів в залежності від їх природи і під дією поля сусідніх атомів і молекул (цей фактор має велике значення у органічній хімії). Поляризація виникає також і під впливом зовнішного електромагнітного поля. Отже полярність виникає внаслідок поляризації.
Полярність зв’язку залежить від довжини його і різниці в електро-негативностях атомів, які утворюють зв’язок. Чим більша ця різниця, тим більше полярність. Найбільшу електронегативність мають галогени і Оксиген, тому вони легко перетягують до себе електронну густину зв’язку.
В результаті поляризації на атомах утворюється частковий позитивний або негативний заряд, який називається ефективним зарядом (+, –). Наприклад:
+ -
Н – СІ
Ефективні заряди змінюються у межах від 0 до 1. Якщо = 0 молекула неполярна, якщо 1 полярний ковалентний звязок наближується до іонного.
Диполь – це система, яка складається з двох рівних за величиною зарядів протилежного знаку, розташованих на певній відстані один від одного. Диполями є полярні молекули або їх фрагменти. Полярність оцінюється за допомогою дипольного моменту () – добутку величини заряду і відстані між ними та вимірюється у дебаях (D); 1D = 10-18 ел.ст.о..см = 3,33.10-30 Кл.м. Для більшості ковалентних зв’язків величина ефективних зарядів не перевищує 0,3 заряда електрона, а дипольний момент зв’язку – 4 D.
В загальному випадку необхідно розрізняти поняття полярності молекули у цілому і полярності окремих зв’язків. Дипольний момент молекули є векторна величина, яка довінює векторній сумі всіх дипольних моментів окремих зв‘язків і неподілених електроних пар в молекулі. Для двохатомних сполук дипольні моменти звязків і молекул збігаються. Наприклад, молекула НСІ і зв’язок Н – СІ полярні, зв = мол = 1,08 D; у лінійній молекулі СО2 зв’язок полярний, зв (С–О) = 2,7 D, але в цілому молекула неполярна, тому що векторна сума дипольних моментів зв’язків дорівнює 0, мол= 0. Навпаки, у молекулі Н2О зв (Н–О) = 1,5 D, полярні зв’язки розташовані під кутом 104,5, тому їх моменти взаємно не компенсуються і молекула стає полярною (мол =1,84 D).
Метод молекулярних орбіталей.
Основи методу розроблені Р.Маллікеном та Ф. Хундом і базуються на розгляданні структури молекули на таких же принципах, які прийняті для описання багатоелектронних атомів. Так, вважається, що при утворенні молекул виникають молекулярні орбіталі, кількість яких дорівнює кількості атомних орбіталей. Молекулярні орбіталі описуються хвильовими функціями, які на відміну від атомних є багатоцентровими. Кожна молекулярна хвильова функція, як і атомна, характеризується квантовими числами, які визначають її енергію, форму і розташування у просторі. Молекулярна орбіталь утворюється в результаті простого складання або віднімання атомних орбіталей.
Метод МО досить складний і в цьому курсі в подробицях не розглядається. Його досягнення полягають в тому, що на відміну від метода ВЗ він є більш загальним і дозволяє пояснити утворення систем Н2+ (один електрон), Н2 (два електрони), Не2+(три електрони) і неможливість існування молекули Не2 (чотири електрони), молекул інертних газів і пояснює явище парамагнетизму молекул, що є наслідком наявністі неспареного електрона на молекулярній орбіталі. Наприклад, молекули Оксигену у конденсованому стані парамагнітні.
Іонний зв’язок
Іонний зв’язок – це зв’язок, утворенний між іонами, внаслідок перебудови електронної конфігурації їх атомів. Він виникає у випадку, коли електронегативності елементів різко відрізняються між собою, тобто коли взаємодіють атоми з різко відмінними хімічними властивостями. Іонний зв’язок треба розглядати як граничний випадок полярного ковалентного зв’язку, коли пара електронів, яка утворює зв’язки, настільки зміщена до одного з атомів, що практично належить тільки цьому атому і його електронна конфігурація відповідає електронній конфігурації найближчого інертного газу.
Слід памятати, що істиного іонного звязку не існує, тобто на атомах утворюються ефективні заряди, величина яких наближається до 1 і звичайно вважають, що в таких сполуках існує ковалентний звязок зі значним ступенем іонності.
Наприклад, при взаємодії атомів Натрію (1s21s22p63s1) та Хлору (1s21s22p63s22p5), Натрій втрачає свій електрон і перетворюється на катіон (1s21s22p63s0), а Хлор приєднує цей електрон і перетворюється на аніон (1s21s22p63s22p6), тобто відбувається процес:
Na + Cl Na+ + Cl-
Ці іони мають конфігурації інертних газів – іон Натрію приймає конфігурацію Неону, а іон Хлору – конфігурацію Аргону, тобто набувають спійкої електронної конфігурації.
Згідно з теорією утворення іонного зв’язку, атоми утримуються разом звичайними кулоновськими силами. При наближенні іонів один до одного діють сили притягання, але при досягненні деякої відстані починають діяти сили відштовхування, які зумовлени тим, що при зближенні іонів їхні електронні хмари відштовхуються. Отже різнойменні іони притягаються і зближуються на таку відстань, на якій сили притягання компенсуються силами відштовхування.
Характерними ознаками іонного звязку є його ненасиченність і ненапрямленність. Іони можна розглядати як заряджені кульки, силові поля яких рівномірно розподіляються у всіх напрямках у просторі. Тому, наприклад, у сполуці NaCl іони Натрію можуть взаємодіяти з іонами Хлору у будь-якому напрямку, притягуюючи певне їх число. Так само діють і іони Хлору. Внаслідок ненапрямленності і ненасиченності звязку енергетично вигідно, коли кожний іон оточується максимальною кількостю іонів протилежного знаку, тобто сполучення між іонами не завершується утворенням простих молекул, а зумовлює утворення великих агрегатів молекул – іонних кристалів, що складаються з великої кількості частинок. Іонні звязки мають велику міцність, тому іонні кристали характеризуються високими температурами плавління і кипіння
Металевий звязок
Металевий звязок – це багатоцентровий хімічний звязок з дефіцитом електронів в твердому або рідкому стані. Його утворюють спільні валентні електрони атомів металів.
Як і ковалентний звязок він утворюється за допомогою спільних електронів. У ковалентному звязку загальна електронна пара належить тільки двом сусіднім атомам, у металевому звязку загальні електрони належать всьому кристалу, тобто вони делокалізовані по всьому обєму кристала. Ця делокалізація є наслідком багатоцентровості.
Металевий звязок ненасичений і ненапрямленний. У чистому виді характерний тільки для лужних і лужно-земльних металів. Для перехідних металів у кристалі існують і металевий і ковалентний звязки, тобто частина валентних електронів належать всім атомам, а частина утворює звичайні ковалентні звязки.
Делокалізовані електрони утворюють електронний газ, який при накладенні зовнішного електричного поля утворює електричний струм, тобто набуває певного руху.
Делокалізовані електрони спричинюють гарну тепло- і електропровідність металів. При збільшенні температури вони зменшуються внаслідок збільшення невпорядкованості системи – розладу руху іонів в вузлах металевої решітки і руху електронів. При низьких температурах спостерігається надпровідність, тому що рух іонів зменшується і вони не заважають напрямленому руху електронів.
Питання і задачі
Дати визначення поняттю "хімічний звязок". Які види хімічного звязку Ви знаєте?
Основні характеристики і властивості ковалентного звязку.
Пояснити утворення ковалентного звязку методом валентних звязків.
Теорія гібридізації. Геометрична конфігурація молекул.
Локалізований і делокалізований звязок.
Поляризація молекул. Дипольний момент звязків і молекул.
Іонний звязок, принцип і приклади його утворення.
Металевий звязок і його відмінності від ковалентного звязку.
Визначити тип звязку і пояснити його утворення у молекулах HCl, H2, NaCl, Fe, AlCl3, O2, CO2, HNO3.
