
Химическая кинетика.катализ
.pdfМинистерство образования и науки Российской Федерации
ГОУ ВПО «Алтайский государственный технический университет им. И.И. Ползунова»
А.В.Протопопов, Н.Г.Комарова
Химическая кинетика Катализ
Методическое пособие к лабораторному практикуму по физической химии
Барнаул 2011
Протопопов А.В., Комарова Н.Г. Химическая кинетика. Катализ: Методическое пособие к лабораторному практикуму по физической химии / А.В. Протопопов, Н.Г. Комарова; Алт. гос. техн. ун-т им. И.И.Ползунова.- Барнаул: Изд-во АлтГТУ, 2011. – 76 с.
Методическое пособие содержит указания к выполнению лабораторных работ по курсу «Физическая химия», теоретический материал для самостоятельной работы студентов и вопросы и задания для контроля знаний по разделу «кинетика и катализ».
Рассмотрено и одобрено на заседании кафедры ТППиЭ
Протокол № 7 от 22.04.2011
2
|
Содержание |
|
Введение ........................................................................................................... |
5 |
|
1 Скорость химической реакции..................................................................... |
6 |
|
2 Молекулярность и порядок химической реакции..................................... |
10 |
|
2.1 |
Реакции нулевого порядка....................................................................... |
12 |
2.2 |
Реакции первого порядка......................................................................... |
14 |
2.3 |
Реакции второго порядка......................................................................... |
16 |
2.4 |
Реакции дробного порядка ...................................................................... |
18 |
2.5 |
Необратимые реакции n-ого порядка (кроме n = 1)............................... |
18 |
3 Методы определения порядка химических реакций ................................ |
19 |
|
3.1 |
Метод изоляции или метод избытка Вант-Гоффа ................................ |
19 |
3.2 |
Метод подстановки .................................................................................. |
20 |
3.2.1 Метод подбора кинетического уравнения........................................... |
20 |
|
3.2.2 Графический вариант метода подстановки ......................................... |
20 |
|
3.3 |
Метод определения порядка реакции по доле превращения (метод |
|
Оствальда-Нойеса)........................................................................................ |
21 |
|
3.4 |
Метод начальных скоростей ................................................................... |
23 |
4 Сложные реакции........................................................................................ |
24 |
|
4.1 |
Классификация сложных реакций .......................................................... |
26 |
4.1.1 Обратимые реакции .............................................................................. |
26 |
|
4.1.2 Последовательные реакции .................................................................. |
27 |
|
4.1.3 Параллельные реакции ......................................................................... |
28 |
|
4.1.4 Сопряжѐнные реакции .......................................................................... |
29 |
|
4.1.5 Цепные реакции .................................................................................... |
29 |
|
4.1.6 Гетерогенные процессы........................................................................ |
30 |
|
4.1.7 Фотохимические реакции ..................................................................... |
34 |
|
5 Влияние температуры на скорость химических реакций ......................... |
36 |
|
5.1 |
Энергия активации................................................................................... |
36 |
5.2 |
Связь энергии активации с тепловым эффектом реакции..................... |
38 |
5.3 |
Определение энергии активации............................................................. |
40 |
6 |
Теория активных столкновений ................................................................. |
42 |
7 |
Теория активированного комплекса .......................................................... |
44 |
|
3 |
|
8 Каталитические процессы .......................................................................... |
48 |
|
8.1 |
Катализ...................................................................................................... |
48 |
8.2 |
Автокатализ .............................................................................................. |
52 |
8.3 |
Гомогенный катализ ................................................................................ |
52 |
8.4 |
Гетерогенный катализ.............................................................................. |
53 |
8.5 |
Ферментативный катализ ........................................................................ |
56 |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ .............................................................. |
60 |
|
Лабораторная работа №1............................................................................... |
60 |
|
Лабораторная работа №2............................................................................... |
66 |
|
Лабораторная работа №3............................................................................... |
70 |
|
Вопросы.......................................................................................................... |
72 |
|
Задачи ............................................................................................................. |
73 |
|
Список использованной литературы ............................................................ |
75 |
|
4
Введение
Знание кинетики химических реакций необходимо при разработке технологии различных производственных процессов, изыскания возможности их интенсификации и автоматизации, а также их аппаратного оформления.
Кроме того, кинетика занимается изучением механизма химических реакций и разработкой теории химического взаимодействия (неформальная кинетика). Ввиду того, что химические процессы часто сопровождаются процессами растворения, адсорбции и другими физическими процессами, вопросы кинетики химических реакций тесно связаны с вопросами кинетики ряда физических процессов, например диффузии.
Для исследования химических процессов обычно применяют два метода: термодинамический и кинетический. Их взаимодополнение иллюстрирует следующий пример. Иногда термодинамически реакция возможна (ΔG < 0), но вместе с тем эта реакция протекает бесконечно медленно, и тогда, с точки зрения практики, можно сказать, что она невозможна. Поэтому необходимо изучать кинетику химических реакций для нахождения путей увеличения скорости такой реакции.
Задачи кинетики и термодинамики различны. Термодинамика ставит и решает задачи определения состояния равновесия, константы равновесия, выхода продуктов, но не может определить время достижения равновесия, скорость процесса, концентрации веществ в любой момент времени. Эти задачи решает химическая кинетика. Но химическая кинетика может увеличить скорость реакции только той, которая является термодинамически возможной.
Пример 1
Если одну из форм углерода – графит (гексагональная структура), устойчивую при стандартных условиях, при высоких температурах и давлениях перевести в алмаз (кубическая кристаллическая решетка), а затем произвести резкую закалку, то структура алмаза будет сохраняться при нормальных условиях. Таким образом, при стандартных условиях алмаз находится в метастабильном (квазиравновесном) состоянии, так как равновесным в этом случае является структура графита. С точки зрения термодинамики при этих условиях алмаз должен превращаться в графит ( Gф.п. 0), но этот процесс протекает бесконечно медленно. (Перестройка алмаза в графит должна протекать с перемещением атомов, а при комнатной температуре такое перемещение атомов почти невозможно). Если же алмаз нагреть до 10000С в вакууме, то процесс сильно ускоряется, и алмаз все же переходит в графит. Особенно быстро этот процесс протекает в
5

присутствии металлического железа, поэтому алмазным инструментом нельзя обрабатывать сплавы на основе железа.
Пример 2
Для процесса окисления всех органических веществ кислородом воздуха до СО2 и Н2О G 0. Однако в природе, например, залежи нефти остаются неизменными длительное время. Дело в том, что в этом случае процесс окисления протекает просто очень медленно.
Химическая термодинамика не изучает скорости реакции, а для химической кинетики именно они являются предметом исследования.
1 Скорость химической реакции
Скорость химической реакции может быть дана через степень
превращения. В реакции |
|
|
|
|
|
aA |
+ bB |
→ cC |
+ dD |
τ=0 |
n0A |
n0B |
n0C |
n0D |
τ |
nA - n0A |
nB - n0B |
nC - n0C |
nD - n0D |
Во второй строчке показано количество прореагировавших веществ ко времени τ. Эта величина разная для различных веществ и по значению, и по знаку. Но если каждую из них поделить на соответствующий стехиометрический коэффициент, то все отношения будут одинаковыми и иметь положительный знак, поскольку а, в < 0; с, d > 0. Эта величина называется химической переменной (или степенью протекания реакции), ξ (кси).
|
n |
A |
n0 |
n |
B |
n0 |
n n0 |
n |
D |
n0 |
|
|||
|
|
A |
|
|
B |
|
C C |
|
|
D |
(1.1) |
|||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
a |
|
|
b |
c |
|
|
d |
||||
|
|
|
|
|
|
|
|
|||||||
Скорость реакции – это скорость изменения химической переменной
(степени превращения, степени протекания реакции) во времени: |
|
|||||||||
' |
d |
|
1 |
|
dn |
|
моль |
' 0 |
|
|
|
|
i |
|
|
; |
(1.2) |
||||
d |
vi |
d |
|
|||||||
|
|
|
|
с |
|
|
||||
где vi – количество молекул i-компонента, участвующего в реакции (стехиометрический коэффициент).
Для того, чтобы исключить влияние объема системы на скорость реакции определяют скорость в единице объема, то есть вводят величину, υ, если объем постоянен:
' 1 dni моль ; 0
(1.3)
V viVd л с
Входе химической реакции ее скорость непрерывно изменяется,
поэтому истинная скорость химической реакции (υi) в любой момент времени есть отношение бесконечно малого изменения концентрации
6
i-компонента dCi к бесконечно малому изменению времени dτ, в течение которого это изменение произошло:
i |
dCi |
(1.4) |
|
d |
|||
|
|
где υi - средняя скорость химической реакции; dCi - изменение концентрации i-компонента; dτ - промежуток времени.
В процессе реакции концентрация исходных веществ уменьшается (dCi /dτ < 0), а концентрация продуктов реакции увеличивается (dCi/dτ >0). Так как скорость реакции всегда величина положительная, то в уравнении для скорости реакции знак ―+‖ относится к продуктам реакции, а знак ―-‖ к исходным веществам.
Следует помнить, что величины скоростей химических реакций, вычисленные по изменению концентраций различных участников химической реакции, связаны между собой стехиометрическими коэффициентами (vi).
Зависимость скорости химической реакции от концентрации ее участников выражается основным законом химической кинетики: “...
скорость химической реакции в любой момент времени при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ, причем каждая из концентраций берется в степени равной коэффициенту перед формулой этого вещества в уравнении химической реакции” (закон
Гульдберга - Вааге, 1867 г.).
В аналитической форме записи закон Гульдберга - Вааге имеет вид:
k Ci |
(1.5) |
|||
|
i |
|
|
|
где k - константа скорости химической реакции. |
|
|||
Для химической реакции в произвольной форме записи |
|
|||
aA + bB |
k1 |
|
cC + dD |
|
|
|
|
||
k2 |
|
|
||
|
|
|
|
|
закон Гульдберга - Вааге дает: |
|
|
|
|
1 k1CAaCBb ... |
- для прямой реакции |
(1.6); |
||
2 k2CCc CDd ... |
- для обратной реакции |
(1.7); |
||
k1 и k2 - константы скоростей прямой и обратной химических реакций, соответственно.
В ходе химической реакции концентрации исходных веществ химической реакции уменьшаются, и вместе с ними уменьшается и скорость прямой реакции. Одновременно растут концентрации продуктов
7
реакции и, соответственно, скорость обратной реакции. Если υ1 = υ2, то υ = 0 и наступает состояние химического равновесия:
k C aCb ... k C c C d ... |
CCc CDd |
|
k1 |
k |
|
(1.8) |
||
C aCb |
|
|
||||||
1 A B |
2 C D |
|
k |
|
|
C |
||
|
|
|
|
|
|
|||
|
|
A B |
|
|
2 |
|
|
|
где kC - константа равновесия химической реакции, определенная ранее термодинамическим методом.
Таким образом, в состоянии химического (термодинамического) равновесия процессы в системе, связанные с химическими реакциями не прекращаются, а непрерывно продолжаются во встречных направлениях с равными скоростями. Такое состояние называется еще состоянием динамического равновесия. Полученный вывод подтверждает тезис о том, что движение - единственно возможная форма существования материи.
Скорость реакции в целом равна скорости реакции по данным веществам, деленной на соответствующие стехиометрические коэффициенты.
Для реакции (1) имеем:
1 dCA |
1 dCB 1 dCC |
1 dCD |
(1.9) |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a d |
b d |
|
c d |
d d |
|||||||||||
|
|
|
||||||||||||||
Вхимической кинетике также различают
1)истинную (или мгновенную) скорость реакции в момент времени τ,
равную
|
dC |
|
(1.10) |
|
d |
||||
|
||||
|
|
|||
2) среднюю скорость реакции за промежуток времени τ, равную |
|
|||
|
C |
|
|
|
(1.11) |
||
|
|||
|
|||
|
|
Выясним, как можно рассчитать скорость реакции в некоторый момент времени τ1 графически. Для этого на основании экспериментальных данных строятся кинетические кривые.
Кинетическая кривая зависимость концентрации участвующих в реакции веществ от времени.
Эти кривые для исходных веществ имеют вид убывающих функций, а для продуктов реакции – вид возрастающих функций (рисунок 1.1).
8
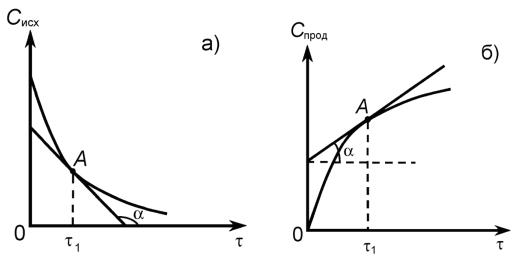
Рисунок – 1.1 Зависимость концентрации (С) исходного вещества (а) и продукта реакции (б) от времени (τ)
Рассмотрим, как определить скорость реакции по данному веществу (υi) в момент времени (τ1), исходя из соответствующих кинетических кривых. Данному времени (τ1) соответствует точка А на кинетических кривых. Если провести касательные к данным кривым в точке А, то, как следует из геометрического смысла производной dCi/dτ, скорость – это тангенс угла наклона касательных к положительному направлению оси τ. Он будет численно равен производной от концентрации по времени в точке τ1. Таким образом, истинная скорость реакции по кинетической кривой для исходных веществ будет:
i |
|
dCi исх |
tg |
(1.12) |
|
||||
|
|
d |
|
|
по кинетической кривой для продуктов реакции:
i |
|
dCi прод |
tg |
(1.13) |
|
||||
|
|
d |
|
|
Механизмом химической реакции называют совокупность элементарных процессов, через которые проходит эта реакция.
Практически все реакции в природе являются сложными, т.е. состоят из совокупности элементарных стадий. Экспериментально установлено, что при Т = const скорость сложных реакций зависит от концентрации исходных, промежуточных веществ, а иногда и от концентрации продуктов реакции и инертных веществ.
Выражение для скорости сложной реакции всегда находят опытным путем. В общем случае для прямой реакции (1.6) можно записать
k CAn1 CBn2 |
(1.14) |
где n1 порядок реакции по веществу А, n2 порядок реакции по веществу В,
9

k константа скорости реакции, не зависящая от концентрации реагирующих веществ.
Физический смысл константы скорости состоит в том, что она численно равна скорости химической реакции при единичных концентрациях всех реагирующих веществ (например, CA= CB = 1 моль/л).
2 Молекулярность и порядок химической реакции
Химические реакции разделяются по признаку их молекулярности или по признаку порядка химической реакции.
Молекулярность химической реакции равна числу молекул (или других частиц), одновременным воздействием, между которыми осуществляется элементарный акт химического превращения.
В зависимости от числа таких частиц различают моно (одно-) молекулярные, би (двух-) молекулярные и три (трех-) молекулярные реакции.
Мономолекулярные реакции - реакции разложения молекул:
I2 = 2I.
Для них закон Гульдберга - Вааге дает:
dC kCI . d 2
К бимолекулярным реакциям относятся взаимодействия двух
одинаковых или различных молекул: |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
Н2 + I2 = 2НI, |
|
|
|
|
|
||||||||||
|
|
|
dC |
kC |
C |
I2 . |
|
|||||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
d |
|
|
Н2 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
К тримолекулярным относятся реакции вида: |
||||||||||||||||||
2NO + Н2 = N2O+Н2O |
|
|
(a) |
|||||||||||||||
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н2 + 2О2 = 2Н2O, |
|
|
|
(б) |
|||||||||||
для которых справедливы соотношения: |
|
|
|
|
|
|
|
|||||||||||
|
а |
|
dC |
|
k |
|
|
C |
2 |
C |
|
, |
||||||
|
|
|
|
|
H2 |
|||||||||||||
|
|
|
|
|
d |
а NO |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
b |
|
dC |
k |
|
C |
|
|
C 2 |
|
||||||||
|
|
H2 |
|
|||||||||||||||
|
|
|
d |
|
b |
|
|
O2 . |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Молекулярность реакции - понятие теоретическое. Для того, чтобы знать молекулярность, нужно представлять, как именно протекает данная реакция, через взаимодействия каких молекул, через какие стадии.
10
