
Химическая кинетика.катализ
.pdf
проходящего поляризованного света. Это свойство и позволяет регистрировать процесс протекания реакции гидролиза непосредственно в поляриметре.
Как известно, угол вращения плоскости поляризации α прямо пропорционален концентрации С и толщине слоя раствора l :
(4)
где [d] - удельное вращение, т.е. вращение при толщине слоя l= 1 дм и концентрации вещества С = 1 г/мл. Знаки «+» и «-» указывают на правое и левое вращение, соответственно.
Раствор сахарозы вращает плоскость поляризации поляризованного света вправо (удельное вращение [d]cax = +66,55 (º·мл)/(дм·г)), а смесь продуктов гидролиза сахарозы - влево ([d]гл = +52,56 (º·мл)/(дм·г); [d]фрук = -91,90 (º·мл)/(дм·г)). По мере протекания инверсии сахарозы и накопления фруктозы и глюкозы, угол вращения плоскости поляризации света реакционной смеси уменьшается до 0º, затем становится отрицательным и приближается к предельному значению α∞, соответствующему окончанию инверсии.
Если угол вращения в начальный момент αо, а в момент времени τ от начала реакции ατ, то разность αо - α∞ пропорциональна начальной концентрации сахарозы, а разность ατ - α∞ пропорциональна концентрации сахарозы в момент времени τ.
Следовательно, константа скорости согласно уравнению (18) выражается формулой:
k |
|
1 |
ln |
0 |
|
|
|
|
|
|
|
(5) |
|||
|
|
|
|
|
|
|
|
Таким образом, еѐ можно рассчитать экспериментально определив значения ατ и α∞, построив по полученным данным график, из которого находят ао .
Приборы и материалы
Поляриметр; термостат или сушильный шкаф; аналитические весы; мерные колбы на 25 мл - 2 шт.; мерный цилиндр на 50 мл; плоскодонная колба на 100 мл; фильтровальная бумага.
Устройство и принцип работы поляриметра
Для определения угла вращения плоскости поляризации света служит полутеневой поляриметр типа СУ-2, схема которого изображена на рисунке (1).
61

Рисунок – 1 Схема полутеневого поляриметра:
1 - поляризатор; 2 - анализатор; 3 - указатель; 4 - лимб; 5 - окуляр; 6 - поляриметрическая трубка; 7 - светофильтр; 8 - источник света; 9 - лупа; 10 - зеркальце.
Основными частями поляриметра являются поляризатор 1, проходя через который луч становиться плоскополяризованным, и анализатор 2, измеряющий угол вращения плоскости поляризации.
Поляризатор 1 состоит из двух призм Николя, причѐм меньшая призма прикрывает половину поля зрения. Плоскости поляризации этих призм находятся под некоторым углом друг к другу, поэтому поле зрения, видимое в окуляр 5, разделено на 2 части, различающиеся по цвету и яркости освещения. Поляризатор в приборе закреплѐн жѐстко и неподвижен.
Анализатор (или призма Николя) может вращаться вокруг оптической оси прибора.
Рисунок – 2 |
Рисунок – 3 |
В полутеневом поляриметре положение плоскости поляризации проходящего света определяется по наступлению равной слабой освещѐнности в окуляре прибора всего поля зрения (установка на полутень). Такое положение называется полутеневым и принимается за нулевое положение прибора (положение с на рисунке 2).
Ошибочно принимать за нулевое положение равномерное осветление всего поля в окуляре!
62
Если полутеневое положение найдено правильно, то малейший поворот анализатора вправо или влево приводит к нарушению равномерности освещѐнности обеих половин поля зрения (рисунок 2а и
2в)!
Если между поляризатором и анализатором поместить поляриметрическую трубку 6, заполненную раствором оптически активного вещества, то произойдѐт изменение плоскости поляризации луча света, проходящего через раствор. Для восстановления нулевого положения понадобиться повернуть анализатор на угол, равный углу вращения плоскости поляризации исследуемого вещества.
Угол вращения отсчитывают по нижней части шкалы, изображѐнной на рисунке (3) (лимбу), движущейся при вращении анализатора и неподвижному нониусу (верхняя часть шкалы, рисунок 3), расположенному на указателе 3. Точность снятия показаний составляет
0,050.
Ноль нониуса указывает число градусов с точностью до 1,0. Доли градуса определяются по тому делению нониуса, которое совпадает с одним из делений шкалы. На рисунке (3) положение лимба отвечает значению ~ 21,0. Девятое от нуля деление нониуса точно совпадает с одним из делений шкалы лимба, значит, показания прибора соответствуют значению 20,90.
Если цифры по шкале возрастают слева направо, то и по нониусу нужно искать деления справа от нуля и прибавлять найденные десятые доли градуса к целым. В таком случае угол вращения положительный.
Если же положение шкалы относительно нуля нониуса таково, что цифры по ней возрастают влево от нуля, то и по нониусу находят число делений влево от нуля до совпадающего со шкалой деления и прибавляют найденные десятые доли градуса к целым. В этом случае угол вращения будет со знаком минус.
Порядок выполнения работы
Для работы необходимо приготовить 10% раствор сахарозы. Для этого на аналитических весах отвешивают 2,5 г сахарозы, помещают навеску в мерную колбу на 25 мл, добавляют дистиллированной воды 10-15 мл, растворяя в ней сахарозу, затем доливают дистиллированной водой до метки. Если раствор мутный, его необходимо профильтровать. Затем его переливают в плоскодонную колбу.
Все дальнейшие действия проводят, записывая результаты в таблицу (1), которую необходимо предварительно подготовить!
Далее, в другой мерной колбе на 25 мл готовят 2Н раствор соляной кислоты и добавляют его к раствору сахарозы.
63
Момент вливания кислоты отмечают по часам, записывают в таблицу
(1) во 2-м столбце первой строки, и считают его моментом начала реакции! В 3-м столбце первой строки записывают 0.
Смесь тщательно перемешивают круговыми движениями колбы, быстро заливают в предварительно промытую дистиллированной водой поляриметрическую трубку, затем переливают обратно в колбу, всѐ время помешивая. Эта процедура необходима для промывки поляриметрической трубки исследуемым раствором.
После чего раствор заливают в трубку, следя, чтобы в ней не оставалось пузырьков воздуха. Для этого еѐ наполняют до краѐв так, чтобы жидкость образовала выпуклый мениск. Затем сверху осторожно подносят стѐклышко и отпускают его так, чтобы оно опустилось точно на торец трубки. Если в трубке заметны пузырьки, стѐклышко снимают, сверху доливают раствор и повторяют опускание стѐклышка. После этого навинчивают штуцер, прижимающий стекло к торцу трубки, следя за тем, чтобы трубка не протекла.
Все описанные операции проводят над раковиной и следят за тем, чтобы капли раствора не попали на одежду, так как он содержит кислоту, разрушающую многие ткани! Также после этого необходимо тщательно сполоснуть руки, если на них попал раствор!
Наполненную трубку обтирают снаружи фильтровальной бумагой. Особенно тщательно протирают стѐкла, закрывающие концы трубки, следя, чтобы на них не было капель и разводов. Трубку помещают в поляриметр и делают первое измерение. Результаты измерения записывают во вторую строку таблицы, отмечая по часам время, прошедшее от начала реакции и угол вращения во 2-м, 3-м и 4-м столбце соответственно.
Следующие измерения проводят через 10, 20, 30, 50 и 80 мин. от начала реакции. Угол вращения определяют, находя полутеневое положение поляриметра. Все определения следует делать по возможности быстро и обязательно записывать время отсчѐта и показания прибора во 2-м, 3-м и 4-м столбце каждой строки таблицы (1).
Оставшуюся в колбе смесь накрывают часовым стеклом и помещают в термостат или сушильный шкаф с фиксированной температурой 60-70 0С.
Смесь в термостате при повышенной температуре может находиться не более 30 мин.! Еѐ дальнейшее нагревание приводит к значительному потемнению раствора, так что оптическое измерение становится невозможным! Начало пожелтения раствора свидетельствует о том, что смесь необходимо из термостата немедленно вынуть!
За 20 - 25 мин. до конца опыта раствор вынимают из термостата и оставляют охлаждаться до комнатной температуры. Его измерение
64
проводят последним, перед заливкой предварительно сполоснув трубку этим же раствором. Результат измерения записывают в последнюю строчку таблицы (1) для α∞.
Расчѐтная часть. Нахождение константы скорости
Результаты опыта сводят в таблицу (1). Константы скорости реакции вычисляют для каждого момента времени (кроме первой и последней строки) и определяют еѐ среднее значение.
Таблица 1 – Константа скорости реакции инверсии сахарозы.
|
Момент отсчѐта |
Угол |
|
|
Константа |
||
№ |
|
|
|
|
|||
|
От начала |
||||||
|
вращения |
ατ - α∞ |
ln(ατ - α∞) |
скорости, |
|||
опыта |
По часам |
реакции. |
|||||
ατ |
|
|
k, τ-1 |
||||
|
|
|
|||||
|
|
мин. |
|
|
|
|
|
1 |
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
30 |
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
50 |
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
80 |
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
90 |
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
∞ |
|
|
|
|
|
|
|
|
|
|
|
|
|
Значение угла вращения ατ соответствующий моменту начала реакции (αо ), определяют из графика зависимости ln(ατ - α∞) от τ. График строят на листе миллиметровой бумаги формата не менее А5 по данным таблицы. Величину (ατ - α∞) находят экстраполяцией до пересечения графика с осью y, соответствующего начальному моменту времени τ = 0 , как показано на рисунке (5). Вычислив константу скорости реакции для каждого момента, вычисляют kсредн как среднее арифметическое всех значений ki.
65
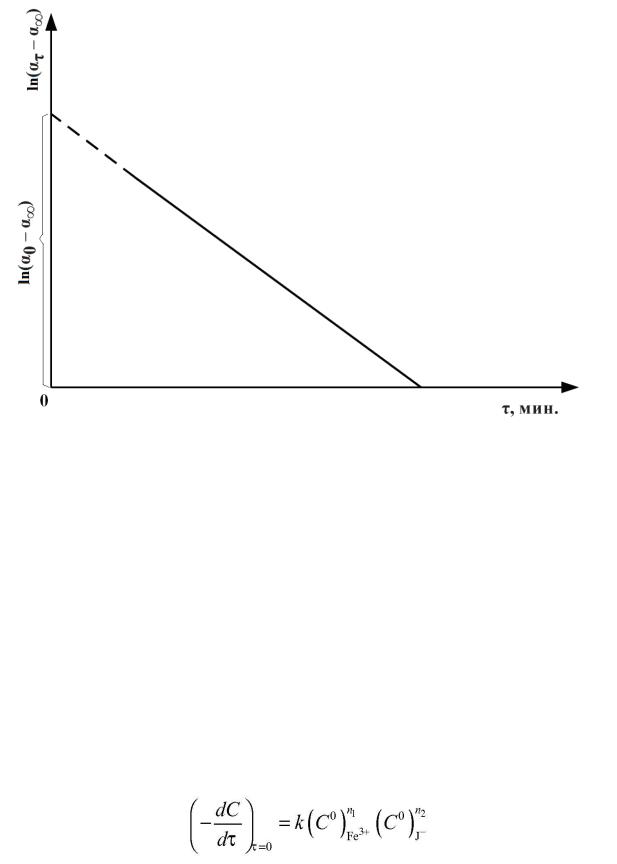
Рисунок – 5 График зависимости ln(ατ-α∞) от времени реакции
Лабораторная работа №2
Определение порядка реакции окисления иодид ионов ионами трехвалентного железа
Цель работы: познакомиться с дифференциальным методом начальных скоростей определения порядка реакции на примере реакции окисления иодид-ионов ионами трехвалентного железа.
Общие теоретические сведения
Для определения частных порядков по отношению к FеЗ+ и J- используют дифференциальный метод начальных скоростей. Допускают, что начальная скорость реакции определяется уравнением
(6)
где и - начальные концентрации Fе3+ и J-; n1 и n2 - частные порядки.
После логарифмирования уравнения (6):
66

(7)
Если в серии опытов изменяют начальную концентрацию ионов трехвалентного железа, а концентрацию ионов иода сохраняют постоянной (в избытке), то уравнение можно записать в виде:
(8)
где A2 = lnk + n2ln(C°)J- - постоянная величина.
Если же в серии опытов изменяют начальную концентрацию иода, а концентрацию трехвалентного железа сохраняют постоянной (в избытке), то уравнение (7) можно преобразовать к виду:
|
(9) |
где A1 = lnk + n2ln |
- постоянная величина. |
Уравнения (8) и (9) используются для определения частных порядков по отношению к ионам трехвалентного железа и ионам иода.
Реактивы и оборудование
Конические колбы - 4 шт., бюретки - 5 шт., секундомер.
0,025 М раствор КJ; 0,1 М раствор HCl; 0,1 М раствор KCl; 0.0167 М раствор FеСl3; 0,005 M раствор Nа2S2O3; 1%-й раствор крахмала.
Порядок выполнения работы
I. Определение частного порядка по отношению к Fе3+
1. В четыре колбы наливают растворы FеСl3, HCl, KCl и дистиллированную воду в тех соотношениях, которые указаны в таблице (2).
Таблица 2 – Рабочие растворы компонентов
Растворы, мл |
Колба 1 |
Колба 2 |
Колба 3 |
Колба 4 |
0,0167 М FеСl3 |
10 |
20 |
30 |
40 |
0,1 М HCl |
10 |
10 |
10 |
10 |
0,1 М KCl |
40 |
30 |
20 |
10 |
Н2О |
20 |
20 |
20 |
20 |
|
|
67 |
|
|

2.В первую колбу добавляют несколько капель 1 %-го раствора крахмала, 20 мл 0,025 М раствора КJ, раствор энергично встряхивают. Момент вливания раствора КJ из бюретки в колбу принимают за начало реакции (включают секундомер). Выделившийся иод в результате протекания реакции взаимодействует с крахмалом, и реакционная смесь окрашивается в синий цвет. Записывают время появления синей окраски.
3.Через 2 мин после начала реакции в реакционную смесь вливают
0,005 M Nа2S2O3 до исчезновения синей окраски. Отмечают на бюретке количество добавленного раствора тиосульфата натрия и время повторного появления синей окраски.
4.Через 2 мин снова добавляют раствор тиосульфата натрия до исчезновения синей окраски. Записывают объем добавленного тиосульфата натрия и время появления синей окраски. Эту операцию проводят 5-6 раз.
5.Аналогичные опыты выполняют со второй, третьей и четвертой колбами.
Обработка результатов измерений и содержание отчета
1. В момент появления синей окраски количество добавленного тиосульфата натрия эквивалентно количеству двухвалентного железа:
(10)
где - концентрация тиосульфата натрия; СХ - концентрация двухвалентного железа; - общий объем израсходованного тиосульфата натрия от начала реакции к моменту времени (мл); V - объем реакционной смеси (мл).
Из уравнения следует:
(11)
Результаты измерений заносят в таблицу (3).
Таблица 3 – Экспериментальные данные
2. Для нахождения скорости реакции в начальный момент времени используют эмпирическое уравнение
(12)
где α и β - постоянные величины.
68
Легко показать, что (dC/ dτ)τ-0 = 1/β .
Величину β определяют из тангенса угла наклона прямой в координатах 1/Cx=f(1/τ). Вычисленные значения 1/β записывают в таблицу (4).
Таблица 4 – Расчетные данные
На основании полученных значений в четырех опытах строят график в координатах ln(1/β)=f(ln ). Тангенс угла наклона прямой будет равен частному порядку n1 по отношению к Fe3+
II. Определение частного порядка по отношению к J-
1. В четыре колбы наливают растворы КJ, HCl, KCl и дистиллированную воду в тех соотношениях, которые указаны в таблице (5).
Таблица 5 – Рабочие растворы реагентов
Растворы, мл |
Колба 1 |
Колба 2 |
Колба 3 |
Колба 4 |
0,025 М КJ |
10 |
20 |
30 |
40 |
0,1 М HCl |
10 |
10 |
10 |
10 |
0,1 М KCl |
32,5 |
30 |
27,5 |
25 |
Н2О |
27,5 |
20 |
12,5 |
5 |
1.В первую колбу добавляют несколько капель 1 %-го раствора
крахмала и 20 мл 0.0167 М раствор FеСl3. Отмечают время начала реакции.
2.В дальнейшем методика работы такая же, как и при определении порядка реакции по отношению к Fe3+.
3.Опытные и расчетные данные заносят в таблицы, аналогичные
таблицам (3) и (4) при определении порядка реакции по отношению к
Fe3+.
4. Порядок реакции n2 по отношению к J- находят из графика ln 1/β = f(ln(C0)J-)
III. Определение общего порядка реакции
Общий порядок реакции равен сумме частных порядков по отношению к Fe3+ и J-:
n = n1 + п2 |
(13) |
69 |
|

Дополнительное задание
Проверить полученные результаты выводом кинетического уравнения для изучаемой реакции, предполагая следующую схему протекания реакции:
применив к промежуточному продукту J2- принцип квазистационарных концентраций Боденштейна (концентрация промежуточных продуктов ≈ 0).
Лабораторная работа №3
Определение константы скорости реакции первого порядка
Цель работы: ознакомиться с закономерностями протекания гомогенных реакций на примере окисления иодид-ионов пероксидом водорода и определить константу скорости реакции расчетным методом.
Общие теоретические сведения
Скорость окисления иодид-ионов пероксидом водорода в кислой среде определяется скоростью реакции:
2 HJ + Н2О2 → J2 + 2 Н2О.
(14)
Поскольку концентрация ионов H+ постоянна (кислота вводится в
большом избытке), скорость реакции зависит только от концентрации пероксида водорода:
где υ - скорость реакции, [концентрация]/[время]; C°H2O2 - концентрация пероксида водорода, [концентрация] в начальный момент времени; СН2О2 - концентрация пероксида водорода, [концентрация]; k - константа скорости реакции, [время -1].
За скоростью реакции можно следить, отмечая время, за которое образовавшийся J2 прореагирует с определенным количеством тиосульфата натрия в разные промежутки времени от начала реакции:
J2 + 2 Nа2S2O3 → 2 NaJ + Na2S4O6.
По этой реакции иодид-ионы возвращаются в реакционную смесь.
70
