
Химическая кинетика.катализ
.pdfВ противоположность молекулярности порядок реакции - экспериментальная величина. Он связан с опытной зависимостью скорости данной реакции от концентрации исходных веществ.
Для простых реакций, протекающих в полном соответствии с их стехиометрическим уравнением, порядок и молекулярность численно совпадают.
Причины несовпадения порядка реакции и ее молекулярности
таковы:
а) Один из реагентов находится в большом избытке. Тогда в ходе реакции его концентрация изменяется незначительно и в уравнении закона Гульдберга - Вааге может быть принята постоянной.
б) Если данная реакция гетерогенная, то в зависимости от условий ее протекания порядок химической реакции изменяется.
в) Порядок каталитических реакций также может отличаться от молекулярности. Причина - сложный механизм таких реакций, не отражаемый стехиометрическим уравнением.
г) Наконец, для сложной реакции, протекающей в несколько стадий, характерно то, что основное влияние на скорость реакции может оказать какая-либо промежуточная стадия, которая и определит, в конечном итоге, порядок всей реакции.
Например, порядок реакции разложения пентаоксида азота:
2N2O5 = 2N2O4 + O2,
казалось бы, должен быть равен двум. Исследования показали, что реакция протекает в несколько стадий (результаты анализа химического состава газовой фазы):
N2O5 = N2O3 + O2, |
(1) |
N2O3 = NO2 + NO, |
(2) |
NO + N2O5 = 3NO2, |
(3) |
4NO2 = 2 N2O4, |
(4) |
причем стадия (1) является наиболее медленной, а поэтому и определяющей скорость всего процесса. Поэтому и суммарная реакция - бимолекулярная реакция первого порядка.
По признаку ―порядок химической реакции‖ различают реакции нулевого, первого, второго и третьего порядков.
Порядок реакции по веществу определяется как показатель степени n, в которой концентрация этого вещества входит в выражение для скорости реакции, полученное опытным путем.
Общий порядок реакции равен сумме порядков по веществам, т.е.
n = n1 + n2.
Величины n1 и n2 совпадают со стехиометрическими коэффициентами только для простых реакций (одностадийных). Для сложных реакций n1 a и n2 b.
11
Если реакция является простой, то есть протекает в одну стадию (одностадийная реакция), то при T = const ее скорость пропорциональна концентрации реагирующих веществ, возведенных в степени, равные их стехиометрическим коэффициентам в уравнении реакции.
Тогда для скорости прямой реакции (1.6) можно записать
k CAa CBb |
(2.1) |
Рассмотрим необратимые гомогенные простые реакции нулевого, первого и второго порядков.
С точки зрения формальной кинетики необратимыми являются такие реакции, для которых через некоторое время с начала их протекания исходные вещества не удается обнаружить аналитическими методами.
2.1 Реакции нулевого порядка
Для реакций нулевого порядка (n = 0) скорость реакции постоянна и не зависит от концентрации исходных веществ. Например, для реакции
АB
всоответствии с основным постулатом химической кинетики (1.5) можно записать
|
dCA |
k0 |
CA 0 |
k0 |
(2.2) |
|
d |
||||||
|
|
|
|
|
||
где СA текущая концентрация вещества А. |
|
|
||||
Разделим переменные |
|
|
|
|
||
|
dCA = k0 dτ |
|
(2.3) |
|||
и проинтегрируем уравнение |
|
|
|
|
||
C |
|
t |
|
|
||
( dCA ) |
k0 d |
|
(2.4) |
|||
C0 |
|
t 0 |
|
|
||
Здесь С0A начальная концентрация вещества А в начальный момент времени τ = 0, СA концентрация А в момент времени t (текущая концентрация А).
Результирующее уравнение, описывающее зависимость концентрации вещества А от времени, будет иметь вид:
С = С0 k0 τ или |
k0 |
C0 |
C |
(2.5) |
|
|
|||
|
|
|
|
Единицы измерения k0 [концентрация·время-1]. Если концентрация выражена, например, в моль/л, а время в секундах, то k0 выражается в моль/(л·сек).
12

Время, в течение которого концентрация исходного уменьшается в два раза, называется периодом полупревращения. Оно обозначается τ1/2.
Для реакции нулевого порядка
|
|
|
C0 0,5 C0 |
|
C0 |
|
1/ 2 |
|
|
|
2k0 |
|
|
|
|
вещества
(временем)
(2.6)
т.е. время полупревращения прямо пропорционально начальной концентрации вещества (при увеличении С0 в 2 раза, τ1/2 увеличивается в 2 раза).
Зависимость текущей концентрации участников реакции от времени представлена на рисунке (2.1).
Рисунок – 2.1 Зависимость текущей концентрации от времени реакции
Реакции нулевого порядка имеют место в тех случаях, когда убыль вещества в результате протекания химической реакции восполняется доставкой его из другой фазы. Например, реакция омыления эфира водой может протекать по нулевому порядку при условии, что взаимная растворимость эфира и воды малы,
СН3СООС2Н5 + Н2О СН3СООН + С2Н5ОН
и при уменьшении концентрации эфира в воде из эфирного слоя каждый раз поступает его новая порция.
Если одно из реагирующих веществ взято в большом избытке, то реакция будет иметь нулевой порядок по данному веществу.
Нулевой порядок наблюдается также, если скорость процесса лимитируется подачей энергии, необходимой для активации реагирующих молекул (фотосинтез).
13

2.2 Реакции первого порядка |
|
|||||
Рассмотрим реакцию первого порядка |
|
|
|
|||
|
А В. |
|
|
|||
Скорость этой реакции описывается уравнением |
|
|||||
|
dCA |
k C |
|
(2.7) |
||
|
|
A |
||||
|
|
d |
1 |
|||
|
|
|
|
|
||
Разделим переменные |
|
|
|
|||
|
dCA |
k d |
|
(2.8) |
||
|
|
|||||
|
CA |
1 |
|
|||
|
|
|
|
|||
проинтегрируем уравнение
C |
|
dCA |
C |
t |
|
|
( |
) |
d ln CA k1d |
||
|
|||||
C0 |
|
CA C0 |
t 0 |
||
где С0 начальная концентрация вещества А в начальный
τ= 0, С текущая концентрация А в момент времени τ. Результирующее уравнение имеет вид:
(2.9)
момент времени
|
|
|
C |
0 |
|
k1 |
|
|
lnC = lnC0 |
k1τ |
или |
ln |
|
|
(2.10) |
||
|
|
|||||||
|
|
|
C |
|
|
|
||
Отсюда |
C C0 e k1 |
|
|
|
|
|
(2.11) |
|
т. е. концентрация вещества А в ходе реакции уменьшается экспоненциально (рисунок 2.2). Очевидно, что концентрация продуктов нарастает тоже по экспоненте.
Единица измерения константы скорости реакции первого порядка
[время-1]: |
|
|
|
|
|
k1 |
|
1 |
ln |
C0 |
[например, с 1 или мин 1] (2.12) |
|
C |
||||
|
|
|
|
||
Рисунок – 2.2 Зависимость текущей концентрации от времени реакции
14

Время полупревращения для реакции первого порядка не зависит от начальной концентрации вещества этот факт характерен только для реакций первого порядка и может служить признаком, определяющим этот тип реакций
1/ 2 |
1 |
ln |
C0 |
|
ln 2 |
|
|
|
|
(2.13) |
|||
k1 |
0,5 C0 |
|
||||
|
|
|
k1 |
|||
Рисунок – 2.3 Кинетические кривые реакции первого порядка для различных начальных концентраций.
Зависимость логарифма концентрации вещества А от времени имеет линейный характер и представлена на рисунке (2.4).
Рисунок – 2.4 Линейная зависимость концентрации от времени
По наклону прямой можно определить k1 (tg = k1). К числу односторонних реакций первого порядка относятся реакции радиоактивного распада, некоторые реакции разложения сложных веществ (карбонатов, кристаллогидратов) при их нагревании, реакции изомеризации и др.
15

2.3 Реакции второго порядка
Рассмотрим реакцию второго порядка
А + В D.
Скорость этой реакции, в соответствии с основным постулатом химической кинетики (1.5), описывается уравнением
dCA dCB k2 CA CB d d
Если начальные концентрации веществ А и В равны (С0А тогда реакция может быть представлена в виде
2А D.
|
dCA |
k |
C 2 |
|
|||
|
d |
2 |
A |
|
|
|
Разделим переменные:
dCC 2 k2d
и проинтегрируем
C |
dC |
|
|
|
|
k2 |
d |
||
2 |
||||
C |
C |
|
0 |
|
0 |
|
|
|
Для нахождения интеграла используем формулы:
|
|
xndx |
xn 1 |
const |
||||||||||||
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
n 1 |
|
|
|
|||
|
dx |
1 |
1 |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
const |
||||||
xn |
|
n 1 |
xn 1 |
|||||||||||||
Получим |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
C |
|
|
k2 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
C |
|
C |
0 |
|
|
|
0 |
|||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Следовательно
(2.14) = С0В = С0),
(2.15)
(2.16)
(2.17)
(2.18)
(2.19)
(2.20)
|
|
|
|
|
|
1 |
|
|
|
1 |
k |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
(2.21) |
||||||||
|
|
|
|
|
|
C |
|
C0 |
|
|
|
2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Отсюда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
1 |
|
|
|
1 |
|
|
|
1 |
|
C0 |
C |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2.22) |
|||||
|
|
|
|
|
|
|
|
|
C |
|||||||||||
|
|
C C0 |
|
|
C0 |
|
||||||||||||||
Единица измерения константы скорости реакции второго порядка [концентрация 1·время 1]. Если концентрация выражена в моль/л, а времяв секундах, то k2 выражается в [л/(моль·сек)].
16
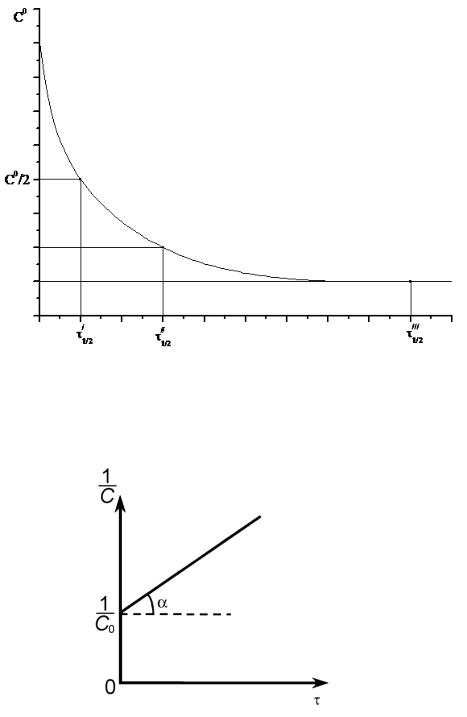
Время полупревращения для реакции второго порядка обратно пропорционально начальной концентрации веществ:
1/ 2 |
|
1 |
(2.23) |
|
|||
|
|||
|
|
k2C0 |
|
Отсюда видно, что время полураспада зависит от начальной концентрации. Во сколько раз уменьшается концентрация, во столько раз увеличивается полупериод реакции.
Рисунок – 2.5 – Кинетическая кривая реакции второго порядка
Зависимость обратной концентрации вещества А от времени имеет линейный характер. Она представлена на рисунке (2.6). Эта зависимость дает возможность определить k2 (k2 = tg ).
Рисунок – 2.6 К расчету константы скорости реакции второго порядка
17

В случае, когда для реакции второго порядка А + В D начальные концентрации реагирующих веществ не равны (С0А С0В), уравнение для константы скорости принимает следующий вид:
k2 |
|
|
1 |
ln |
C0BCA |
(2.24) |
|
(C0 A |
C0B ) |
C0 ACB |
|||||
|
|
|
|
где СА и СВ текущие концентрации веществ А и В в момент времени τ.
2.4 Реакции дробного порядка
Рассмотрим реакции дробного порядка на примере реакций половинного и полуторного порядков.
Скорость таких реакций, в соответствии с основным постулатом химической кинетики (1.5), описывается уравнением (а) для половинного
порядка; б) для полуторного порядка) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
а) |
dC |
|
|
k 1 |
|
C 12 |
|
и |
|
|
б) |
dC |
|
k3 |
C 32 |
(2.25) |
||||||||||||||||||||||
|
|
d |
|
|
2 |
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d |
|
|
|
2 |
|
|
|
||||
Разделим переменные: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
а) |
|
dC |
|
k 1 |
|
d |
и |
|
б) |
|
|
dC |
|
k3 |
d |
|
|
|
(2.26) |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
1 |
|
|
2 |
|
|
|
3 |
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
C 2 |
|
|
|
|
|
|
|
|
|
|
|
C 2 |
|
|
|
2 |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
и проинтегрируем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
dC |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
dC |
|
|
|
|
|
|
|
|
|
|
||||||
а) |
|
|
k1 |
d |
и |
б) |
|
|
|
k3 |
d |
|
(2.27) |
|||||||||||||||||||||||||
|
1 |
|
|
3 |
|
|||||||||||||||||||||||||||||||||
|
C0 |
|
C 2 |
|
|
|
|
|
|
2 0 |
|
|
|
|
|
C0 |
C 2 |
|
|
|
2 |
0 |
|
|
||||||||||||||
После интегрирования получим: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
|
|
2 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
k 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
k3 |
|
|
||||||||||
|
C |
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
C0 |
|
|
|
||||||||||||||
а) |
|
1 |
|
|
|
2 |
|
|
|
|
и |
б) |
|
1 |
|
|
|
|
2 |
|
|
|
(2.28) |
|||||||||||||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C0 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
||||||
|
0 |
|
|
|
|
|
|
|
|
|
2 C0 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.5 Необратимые реакции n-ого порядка (кроме n = 1)
Аналогичный подход применяется к выводу кинетических уравнений для константы скорости реакций более высоких порядков. Можно
показать, что для реакции типа |
|
|
|
|
|
|
|
|
|
|
||
А + В + С + … продукты |
|
|||||||||||
при условии С0А = С0В = С0С = … константа скорости |
определяется |
|||||||||||
уравнением |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
1 |
|
|
1 |
|
1 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
kn |
|
|
|
|
|
|
n 1 |
n 1 |
(2.29) |
|||
|
n 1 |
|
|
|
||||||||
|
|
C |
|
|
C0 |
|
|
|||||
Отсюда для времени полупревращения получим
18
|
|
2n 1 1 |
|
|
или 1/ 2 |
|
const |
(2.30) |
1/ 2 |
n 1 C n 1 |
k |
|
C n 1 |
||||
|
0 |
|
n |
|
|
0 |
|
|
3 Методы определения порядка химических реакций
На практике исследование скорости химических реакций начинают с определения порядков этой реакции по каждому из реагирующих веществ и (или) порядка реакции в целом. Для реакции с участием нескольких
веществ определить n ni можно только поэтапно, определяя порядки
по отдельным веществам, а затем определяют ni любым из описанных ниже методов.
Методы определения порядка реакции можно подразделить на:
1. Интегральные:
а) Метод подстановки; б) Графический;
в) Метод по доле превращения.
2. Дифференциальные:
а) Метод избытка Вант-Гоффа; б) Метод начальных скоростей.
3.1 Метод изоляции или метод избытка Вант-Гоффа
Заключается в определении частного порядка данной реакции по каждому веществу отдельно, общий порядок реакции находится суммированием частных порядков реакции.
Если в исследуемой реакции участвуют несколько реагирующих веществ, то общий порядок реакции n ni , где ni порядок по каждому
участнику реакции. Частный порядок ni можно определить, взяв все вещества, кроме данного, в большом избытке. Так, в случае реакции
А + В + С D
скорость равна
kCAn1 CBn2 CCn3 |
(3.1) |
Если вещества В и С взяты в большом избытке, |
то при протекании |
реакции их концентрации практически не изменяются, т.е.
n2 |
n3 |
const k |
|
n1 |
(3.2) |
kCB |
CC |
|
и k CA |
Тогда, определив порядки реакции по каждому из реагирующих
веществ, можно найти общий порядок реакции: |
|
n = n1 + n2 + n3 |
(3.3) |
Также можно использовать графический вариант метода избытка Вант-Гоффа. Здесь используется полная кинетическая кривая
19

расходования одного из веществ. Все другие вещества берутся в большом избытке, чтобы их концентрации в ходе реакции оставались практически постояннми.
Получив зависимость С=f(τ), дифференцируют графически или аналитически и получают значения dCi/dτ=υi в разные моменты времени τ.
Далее, логарифмируя кинетическое уравнение
A kCAnA CBnB kCAn
ln A ln k n ln C A (3.4)
получают уравнение прямой в координатах ln υA = f(ln CA).
Построив линейную зависимость, можно рассчитать порядок реакции по веществу А, как тангенс угла наклона прямой.
3.2Метод подстановки
3.2.1Метод подбора кинетического уравнения
Заключается в подстановке экспериментальных данных изучения зависимости концентрации вещества от времени в кинетические уравнения различных порядков. Подставляя в приведѐнные в таблице уравнения значения концентрации реагента в разные моменты времени, вычисляют значения константы скорости. Частный порядок реакции по данному веществу равен порядку того кинетического уравнения, для которого величина константы скорости остаѐтся постоянной во времени.
Таблица 3.1 – Выражение константы скорости для различных порядков реакции
Порядок реакции 
 Выражение для константы скорости
Выражение для константы скорости
1
2
3
3.2.2 Графический вариант метода подстановки
Экспериментальные значения концентраций реагирующих веществ наносятся на график, отражающий изменение концентрации исходного вещества (для реакций нулевого порядка – концентрация продуктов) в зависимости от времени. При этом выбираются такие координатные оси, чтобы график представлял собой прямую линию. Если
20
