
Практическая часть
Цель настоящей работы состоит в практическом овладении методом количественного флуориметрического анализа и приемами количественной оценки величин квантовых выходом фотохимических реакций в биологически значимых молекулах на примере триптофана в свободном состоянии и в составе белка.
Приборы и принадлежности:
Флуориметр
Ультрафиолевый облучатель.
Кварцевая кювета для измерения интенсивности флуоресценции
Водный раствор триптофана
Водный раствор бычьего сывороточного альбумина
Устройство флуориметра.Флуориметр (схема прибора представлена на рис. 2) собран на базе спектрофотометра «Spectromom201». Источником возбуждающего света является дейтериевая лампа (1), излучение которой с помощью зеркального конденсора (2) фокусируется на входную щель монохроматора (3). Монохроматический пучок света кварцевой линзой (5) фокусируется на кювете (6), находящейся в специальном держателе кюветного отделения. Флуоресценция образца с помощью зеркала направляется на светофильтр (7), не пропускающий кванты возбуждающего света. Затем прошедшее светофильтр излучение с помощью системы из зеркала и кварцевой поворотной призмы (8 и 10 соответственно) направляется на фотокатод фотодетектора (ФЭУ-39, 11). ФЭУ питается от высоковольтного стабилизированного источника постоянного напряжения (ВС-22, 12), а его сигнал регистрируется с помощью цифрового рН-метра ОР-211 (13), работающего в режиме милливольтметра. Источником питания дейтериевой лампы служит стабилизатор ЭПС-86.
Включение флуориметра.
Проверить, закрыта ли шторка кюветного отделения. Ручка закрывания шторки расположена перед блоком ФЭУ, на правой части кюветного отделения. Для закрывания шторки она поворачивается против часовой стрелки до упора.
Включить дейтериевую лампу. Для этого сначала перевести в положение «ВКЛ» выключатель «Накал» на блоке ЭПС-86, а через 2-3 минуты - выключатель «Высокое напряжение». При включении лампы в блоке зажигаются нагрузочные лампы накаливания.
Подать питание на ФЭУ: на источнике питания ВС-22 перевести в положение «ВКЛ» сначала тумблер «Сеть», а через 2-3 минуты – тумблер «Выход».
С помощью регулятора «STD1» на передней панели рН-метра добиться нулевых показаний, компенсировав регистрируемый темновой ток. Поскольку по схеме включения ФЭУ на землю подается «+» цепи, регистрируемый сигнал будет всегда иметь знак «-» перед цифрой.
Порядок проведения измерений флуоресценции
Установить кювету с исследуемым образцом в держатель кюветного отделения.
На барабане развертки спектра монохроматора установить длину волны 280 нм.
Закрыть крышку кюветного отделения, установить дополнительную тканевую светоизоляцию.
Открыть шторку фотодетектора. Рукоять для открывания шторки поворачивается по часовой стрелки до упора.
Дождаться стабилизации показаний на рН-метре и зафиксировать их.
Для повышения точности измерений измерить Jфизучаемого объекта еще 2 раза. Рассчитать среднее значениеJф по 3 измерениям.
Задание 1. Регистрация концентрационных зависимостей Jф для свободного триптофана и бычьего сывороточного альбумина (БСА) в водных растворах.
Приготовить 11 проб раствора триптофана в воде. Объем каждой пробы – 1 мл, интервал концентраций триптофана в пробах – от 0 до 0,1 мг/мл, шаг изменения концентрации – 0,01 мг/мл. Навеска рассчитывается на основании требуемого количества исходного маточного раствора. Концентрация триптофана в маточном растворе – 0,1 мг/мл. Разведения маточного раствора при приготовлении проб выполняются согласно таблице 1.
Приготовление образцов водного раствора триптофана для построения калибровочной концентрационной зависимости интенсивности его флуоресценции.
№» пробы
Конечная концентрация триптофана в образце, мг/мл
Объем вводимого маточного раствора, мл
Объем вводимой дистиллированной воды, мл
Общий объем образца, мл
1.
0
0
1,0
1,0
2.
0,01
0,1
0,9
1,0
3.
0,02
0,2
0,8
1,0
4.
0,03
0,3
0,7
1,0
5.
0,04
0,4
0,6
1,0
6.
0,05
0,5
0,5
1,0
7.
0,06
0,6
0,4
1,0
8.
0,07
0,7
0,3
1,0
9.
0,08
0,8
0,2
1,0
10.
0,09
0,9
0,1
1,0
11.
0,10
1,0
0
1,0
Аналогичным образом, используя маточный раствор с концентрацией 1 мг/мл, приготовить 11 проб водного раствора БСА. Интервал концентраций БСА в пробах – от 0 до 1,0 мг/мл, шаг изменения концентрации – 0,1 мг/мл.
Измерить интенсивности флуоресценции всех образцов. На основании полученных концентрационных зависимостей Jфопределить концентрации триптофана и БСА, соответствующие конечной части линейного участка этих зависимостей.
Задание 2. Определение квантовых выходов фотолиза свободного триптофана в водном растворе и триптофановых остатков в составе молекулы бычьего сывороточного альбумина.
Используя данные, полученные при выполнении задания 1, приготовить по 4 мл растворов триптофана и БСА, соответствующих конечной части линейного участка зависимостей Jф=f(c). ИзмеритьJф этих образцов (объем раствора, помещаемый в кювету, должен составлять 1 мл).

Включить ультрафиолетовый облучатель (его схема приведена на рис. 3). Для включения сначала следует вставить вилку шнура питания этого устройства в сетевую розетку, затем нажать кнопку «Пуск» и удерживать ее в нажатом положении 10-15 секунд. В момент отпускания кнопки происходит зажигание лампы. Если лампа облучателя не зажглась, повторить нажатие на кнопку «Пуск».
Внимание! Используемая в облучателе ртутно-кварцевая лампа БУВ-30П является высокоинтенсивным источником ультрафиолетового излучения! При работе с данным источником следует защищать глаза и неприкрытые одеждой участки кожи от повреждения избыточным ультрафиолетовым излучением. Нельзя разворачивать ультрафиолетовый излучатель, направляя излучение лампы в сторону помещения практикума. Не рекомендуется пребывать в зоне действия излучения источника более, чем это требуется для работы с облучаемыми образцами.
Излучение лампы стабилизируется примерно за 10 минут с момента включения.
После стабилизации источника излучения налить подлежащие облучению растворы триптофана и БСА в пластиковые стаканчики для облучения. Напомним, что объем облучаемого раствора в каждом стаканчике должен составлять 4 мл.
Разместить стаканчики с облучаемыми растворами под лампой ультрафиолетового облучателя. Поскольку стенки стаканчиков непрозрачны для ультрафиолетового света, необходимо следить за тем, чтобы во время облучения лампа находилась точно над серединой открытой поверхности образца.
Измерить интенсивности флуоресценции водных растворов триптофана и БСА, облучавшихся в течение 10, 20, 30, 40, 50 и 60 минут. Для этого облучение в необходимый момент времени прерывается, образец извлекается из облучателя, тщательно перемешивается. 1 мл раствора помещается в кювету, и на флуориметре анализируется его Jф. Затем раствор из кюветы переливается обратно в стаканчик для облучения, он опять помещается под лампу облучателя, отсчет времени облучения продолжается. Для сокращения времени эксперимента удобно облучать одновременно растворы триптофана и БСА в 2-х стаканчиках, начав их облучение со сдвигом в 5 минут относительно друг друга. При таком приеме за время измеренияJфодного образца подходит время измерения этого показателя у другого.
Окончив облучение, выключить ультрафиолетовый облучатель. Для его выключения необходимо удалить вилку сетевого шнура из розетки. Внимание: При удалении вилки питания из сетевой розетки следует делать это, держась за корпус вилки, а не за сетевой шнур.
На основании полученных величин Jфоблученных разное время (Jф(Е)) и необлученных (Jф(0)) растворов триптофана и БСА построить зависимости
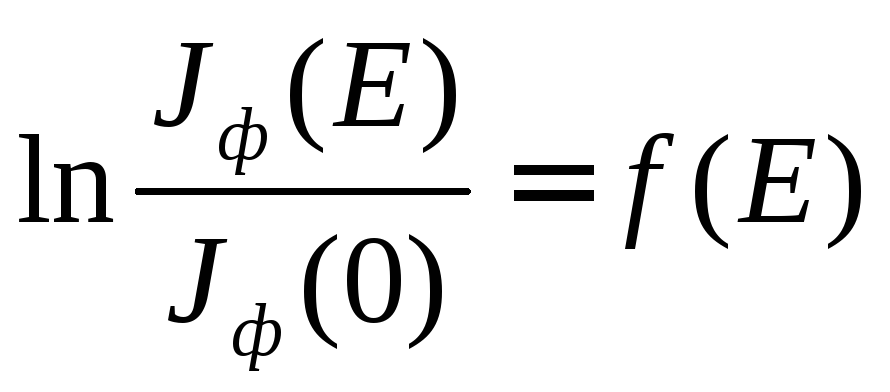
Следует иметь в виду, что доза излучения в данном случае выражается в количестве квантов. Этот показатель рассчитывается на основании того, что суммарная интенсивность излучения примененного излучателя в ультрафиолетовой части спектра составляет 20 Дж/м2/с, причем 80% этого излучения составляют кванты с длиной волны 253,8 нм. Напомним, что общая экспозиционная доза излучения рассчитывается по формуле
![]()
где Е– доза облучения,J– его интенсивность (в данном случае размерность интенсивности должна быть квант/м2/с),S – освещенная площадь объекта в м2, аt время облучения в секундах. При расчетах можно считать, что фотолиз триптофана и триптофанилов в белке вызывают только кванты с длиной волны 253,8 нм. Не забывайте ввести поправку Моровитца.
Из построенных зависимостей рассчитать величины для свободного триптофана в водном растворе и триптофановых остатков в составе молекул сывороточного альбумина быка (254для свободного триптофана – 2870 лмоль-1см-1;254для БСА – 11000 лмоль-1см-1). Сопоставить полученные значения, объяснить причины различий.
По окончании работы все приборы, входящие в состав экспериментальной установки, выключаются. Использованные пробирки и другая посуду следует обязательно промыть. Особенно тщательно промывается кювета флуориметра, для мытья которой используется моющее средство. После удаления видимых загрязнений кювета тщательно, не менее 20 раз, прополаскивается водопроводной водой, а затем – не менее 5 раз дистиллированной.
Отчет и выводы
В отчете по работе должны содержаться:
Концентрационные зависимости интенсивности флуоресценции для триптофана в водном растворе и для водного раствора БСА с указанием на выбранные для облучения концентрации.
Построенные в полулогарифмических координатах (согласно уравнению (2)) дозовые зависимости интенсивности флуоресценции триптофана в водном растворе и водного раствора БСА.
Значения для свободного триптофана в водном растворе и триптофановых остатков в составе молекул сывороточного альбумина.
В выводах обсуждается следующее:
Каковы пределы концентраций триптофана и БСА в водных растворах, при которых зависимость Jф=f(c) сохраняет относительную линейность?
Каковы значения для свободного триптофана в водном растворе и триптофановых остатков в составе молекул сывороточного альбумина и почему эти значения различаются?
